母鼠長期銅暴露對子代雄性SD大鼠睪丸功能的影響
曾雅惠,楊文艷,楊連玉 (吉林農業大學 動物科學技術學院/動物醫學院/吉林省動物營養與飼料科學 重點實驗室,吉林 長春 130118)
銅(Cu)是生物體必不可少的過渡金屬元素,作為金屬酶的組成成分,直接參與體內代謝、神經遞質合成、自由基清除等過程,對機體的生理功能和生長發育起著重要的作用[1-2]。高銅可促進動物生長,因此被作為添加劑廣泛應用于畜牧行業生產中,但高劑量的銅代謝緩慢,易導致動物慢性銅中毒[3-6]。關于銅負荷的肝毒性、腎毒性、免疫抑制等導致機體氧化損傷均有報道,亦有研究表明銅負荷對機體生殖系統的毒性作用也非常明顯[7-8]。李英等[9]研究發現高銅可引起銅在睪丸中沉積,影響精子數量及其活力,損傷雄性生殖。然而目前,母體銅營養水平是否對出生后其子代的生殖系統發育和功能產生影響,尚未可知。因此本試驗建立親代大鼠長期銅暴露模型,觀察子代大鼠睪丸組織形態、精子活力,探究親代不同銅水平對子代大鼠血清抗氧化指標及睪丸功能的影響。
1 材料與方法
1.1 實驗動物及分組實驗動物選用SPF清潔級,健康程度良好、胎次相同、體質量相近(44.04±3.05) g 的21日齡斷奶雌性SD大鼠24只,購自長春市寬城區宏達動物養殖場。隨機分為3個日糧處理組,每組8只雌性大鼠,每天12 h光照,飼養溫度24℃,相對濕度50%,自由飲水采食。
1.2 主要試劑酶聯免疫分析試劑盒購自上海酶聯生物科技有限公司,飼料級含銅25% CuSO4·5H2O(廣澤,中國),PrimeScript TM RT reagent Kit with gDNAEraser(TaKaRa,日本),硝酸(HNO3),無水乙醇購自長春商貿添侯生物科技有限公司。
1.3 動物模型及日糧設計3個日糧處理組分別飼喂A、B、C 3種不同銅水平日糧。A 組飼喂AIN-93G基礎日糧,B 組飼喂AIN-93G基礎日糧+CuSO4120 mg/kg,C組飼喂AIN-93G基礎日糧+CuSO4240 mg/kg。試驗過程中,每天定時飼喂1次(17:00),自由采食和飲水,預飼7 d,試驗期8周,與全同胞性成熟雄性SD大鼠和籠交配,妊娠后單籠飼養,并繼續染銅至子代大鼠斷乳后。日糧配方見表1。
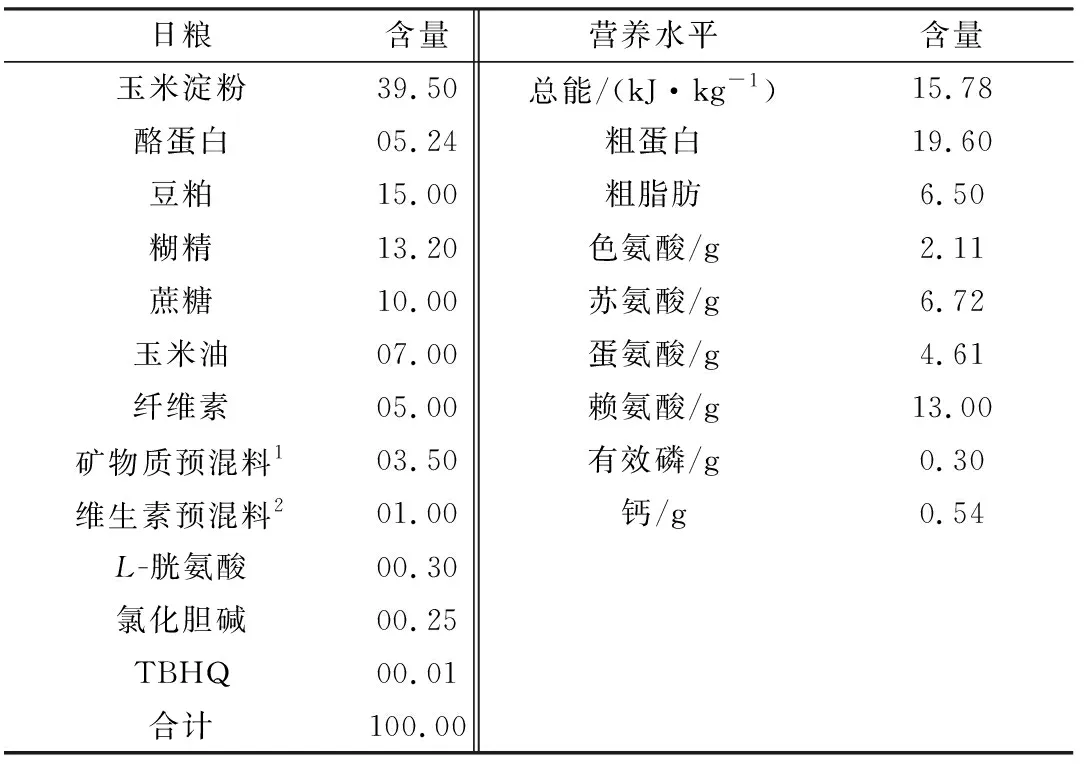
表1 日糧成分及營養水平 %
1.4 樣本采集及數據收集子代大鼠3周齡后,每組均繼續飼喂AIN-93G基礎日糧,待子代雄性大鼠10周齡每組隨機取8只作為實驗動物,分別標記A0、B0、C0組。空腹眼球采血,斷頸處死,分離雙側睪丸和附睪,左側分離后稱量睪丸和附睪濕重,計算臟器指數,用于睪丸石蠟切片,右側于4℃預冷4%多聚甲醛中固定,用于組織銅的測定。附睪用于精液質量檢測。
1.5 血清銅、睪丸組織銅的測定取1 mL血清樣品于三角瓶中,加5 mL濃HNO3和2 mL HClO4于電熱板上消煮至透明,有少量白煙。靜置冷卻,加2.5 mL 10% HNO3,轉入50 mL容量瓶中,用去離子水定容,搖勻待測,同時做空白試驗。待測液用電感耦合等離子發射光譜(ICP-7500)測定。睪丸組織同上。
1.6 血清中抗氧化指標的測定將血液離心,收集上清,試劑盒采用雙抗體夾心法測定大鼠血清中谷胱甘肽過氧化物酶(GSH-Px)及超氧化物歧化酶(SOD)活力、丙二醛(MDA)含量、銅藍蛋白(CP)水平,并嚴格按照說明書操作。
1.7 精液質量檢測脫頸法處理大鼠后,切除附睪尾,用眼科剪剪開,置于1 mL預熱的PBS的離心管中,37℃培養箱孵育3 min,使精子游出,用精子稀釋液將精子懸液稀釋20倍,取10 μL稀釋后的精子懸液滴在精子計數板上在光學顯微鏡下計數,用活動的精子數與總精子數的比值表示精子活力。
1.8 睪丸組織的切片觀察左側睪丸組織于4%多聚甲醛中固定超過24 h后置于包埋盒中,在自動脫水機中按照70%乙醇、80%乙醇、90%乙醇、95%乙醇、100%乙醇、二甲苯、二甲苯Ⅱ的順序進行脫水,用石蠟包埋,準備切片,再用蘇木精-伊紅染色,用中性樹膠封片,最后在顯微鏡下觀察。
2 結果
2.1 子代大鼠體質量、睪丸濕重、附睪濕重、睪丸及附睪臟器指數由表2可知,子代大鼠體質量、睪丸濕重、附睪濕重、睪丸臟器指數及附睪臟器指數隨著親代日糧銅水平的升高而降低,且與A0 組相比,C0組呈顯著降低趨勢(P<0.05)。附睪濕重B0組顯著低于A0組(P<0.05)。

表2 子代大鼠體質量、睪丸濕重、附睪濕重、睪丸及附睪臟器指數的影響
2.2 血清銅、睪丸組織銅水平由圖1可知,子代大鼠血清銅、睪丸銅含量隨日糧銅水平的增加而增加。與A0組相比,B0組血清中銅含量顯著升高(P<0.05),C0組血清中銅含量極顯著升高(P<0.01)。與A0組相比,C0組睪丸中銅濃度顯著升高(P<0.05)。
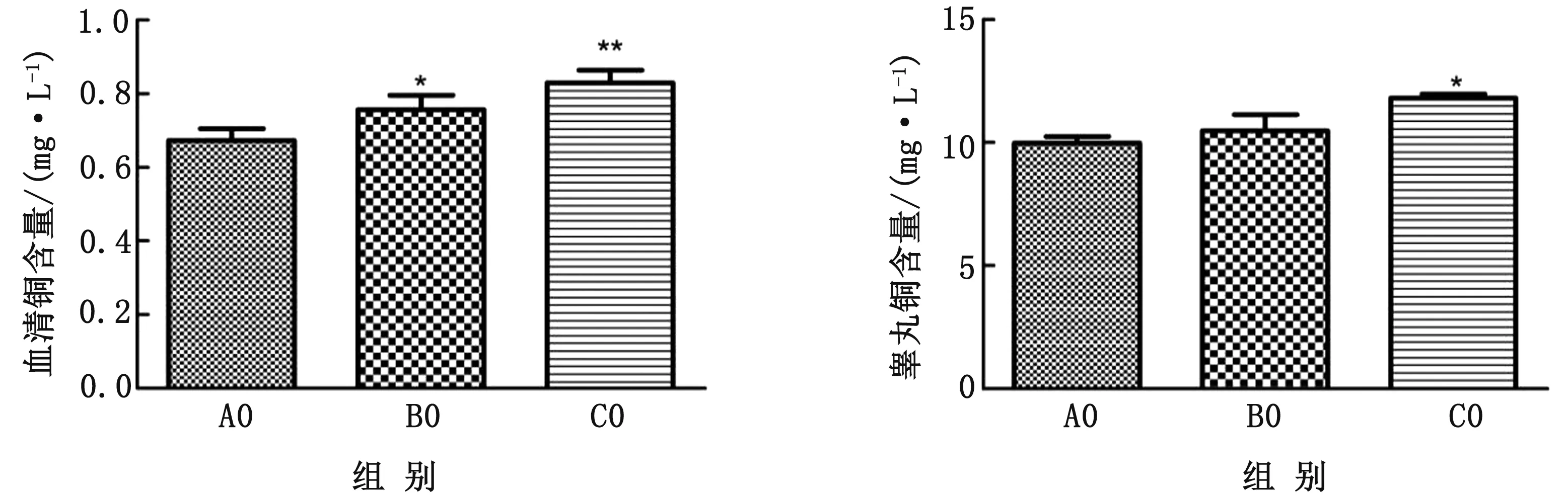
注:與A0相比 *P<0.05;**P<0.01圖1 血清銅(左)、睪丸銅含量(右)
2.3 血清中抗氧化指標的變化由表3結果可知,親代日糧添加120,240 mg/kg硫酸銅,能影響子代大鼠血清中抗氧化指標水平,與A0組相比,親代添加240 mg/kg的硫酸銅能顯著降低子代大鼠血清GSH-Px、SOD水平(P<0.05),但均與B0組差異不顯著。與對照組相比,B0、C0組MDA水平均極顯著升高(P<0.01)。CP水平隨著銅水平增加呈上升趨勢,且C0組顯著高于A0組(P<0.05)。

表3 子代大鼠血清抗氧化指標
2.4 長期銅暴露對子代大鼠精子的影響由表4可知,子代大鼠精子數量、活動率隨著親代染銅水平的升高而呈下降趨勢。與A0、B0組相比,C0組的精子數量和精子活動率顯著降低(P<0.05);C0組的精子畸形率顯著高于A0、B0組(P<0.05)。

表4 大鼠精子數量、活力及畸形率
2.5 睪丸組織的形態學變化如圖2所示,A0組睪丸內部結構正常,生精小管基膜完整,B0組睪丸生精小管擴張且排列松散,C0組睪丸發育不佳,生精小管基膜不完整,生精細胞排列層次不清晰,精子減少,睪丸間質細胞數減少。
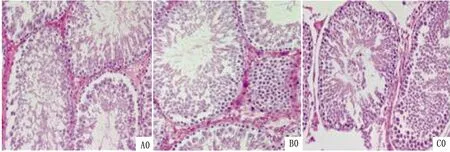
圖2 大鼠睪丸組織切片(HE × 200)
3 討論
銅可以通過胎盤和母乳由母體向后代進行轉移,胎兒的銅營養完全依賴于母體,妊娠期胎盤作為母體和胎兒之間物質傳遞的紐帶,使銅在胎盤轉運過程中優先供給胎兒,導致胎兒體內銅的含量較高。HADDAD 等[10]研究發現用130 mg/kg硫酸銅飼喂妊娠期大鼠,其后代出現生長和發育遲緩的現象,本試驗也獲得了相似的結果,不同銅水平日糧飼喂親代大鼠對子代雄性大鼠體質量、睪丸濕重、睪丸系數有降低的趨勢,但與吳國星等[11]的試驗結果不同,這可能與實驗動物的種類及器官的敏感度不同導致。隨著日糧銅水平的提高和子代大鼠日糧采食時間的延長,血清和睪丸中的銅水平均呈升高的趨勢,通過相關性分析表明,兩組數據顯著正相關。表明,親代飼喂不同水平銅日糧會導致銅在子代大鼠體內蓄積,影響大鼠體質量及組織濕重。
動物日糧添加銅能顯著提高血清銅SOD活性[12],但高劑量的銅可引起機體組織的病理損傷,導致血清中Cu/Zn-SOD活性降低[13]。GSH-Px能將H2O2分解,產生水和O2,有效防止自由基的生成。血清銅95%是CP結合銅,CP具有氧化酶活性,由肝臟合成,并參與鐵代謝和運輸銅,血清內的CP水平會隨著銅攝入量的增加而顯著升高[14]。本試驗發現,親代覆蓋120,240 mg/kg的銅,子代大鼠血清中SOD和GSH-Px的活性均隨銅水平的增加而逐漸降低,而MDA含量和CP水平逐漸升高,且在親代添加240 mg/kg銅的子代大鼠中顯著升高,這可能是由于親代銅攝入增加了子代肝臟銅濃度,肝臟通過某一途徑繼續合成CP。MDA水平上升,意味著動物體內抗氧化系統可能受到破壞,動物機體膜結構已經發生損傷,提示親代大鼠長期銅暴露后,銅可通過胎盤屏障和血睪屏障進入子代大鼠血清和睪丸內,引起催化類Fenton反應,導致氧化損傷。
睪丸是雄性動物最為重要的生殖器官,主要由曲細精管和間質構成。曲細精管由支持細胞和各級生精細胞組成,前者對生殖細胞具有支持、保護和營養作用。有研究發現,慢性銅暴露的小鼠睪丸組織出現嚴重的空泡化,曲細精管出現較大的不規則空隙,精原細胞和精母細胞數量減少,而睪丸系數無顯著性差異;此外,在高銅暴露的小鼠中發現,精子的活力及運動能力下降,畸形率升高[15-16]。生精小管的萎縮和塌陷、生殖細胞數量的減少和上皮細胞高度的降低是銅暴露小鼠睪丸中典型的組織病理學損傷[17]。本試驗結果顯示,親代銅暴露下,子代大鼠睪丸的生精小管中生精細胞疏散,各級精原細胞排列紊亂且形態異常;精子數量減少,活力下降,畸形率上升,而且銅處理劑量越大,超過機體自身耐受劑量,損傷和病理改變程度就越明顯,睪丸中銅沉積也越多。研究結果說明了高濃度銅引起的睪丸損傷、精子數量及活力降低,其機制可能是高銅激活了線粒體凋亡的信號通路,降低精原細胞和精母細胞的數量并影響精子發育,引起睪丸發生表觀遺傳修飾,最終損傷雄性生殖[18]。綜上所述,親代飼喂高銅日糧,會引起子代大鼠發生氧化應激,影響精子生成及睪丸功能。

