NEFA對奶牛中性粒細胞跨乳腺上皮遷移功能的影響
呂觀新,王 海,武 瑞 (黑龍江八一農墾大學 動物科技學院 獸醫臨床診斷與新獸藥研發實驗室,黑龍江 大慶 163319)
多形核中性粒細胞(poly-morphonuclear neutrophils,PMN)是奶牛體內最豐富的循環粒細胞之一,在奶牛乳腺天然免疫中發揮著重要作用[1]。通常情況下,PMN游離于奶牛外周血中,僅少部分駐存在奶牛組織中。當奶牛發生乳腺感染,病原菌聚集于乳腺腺泡腔內分泌大量炎癥因子,此時,PMN將作為應答向炎癥部位進行募集。PMN從外周血中募集到炎癥部位是一個順時過程,包括:附著、滾動、黏附和跨上皮遷移[2]。只有當PMN跨過奶牛乳腺上皮進入腺泡腔后,通過吞噬、釋放活性氧(ROS)和形成胞外誘捕網(NET)殺滅侵入病原菌,才能保證奶牛乳腺健康[3-5]。
非酯化脂肪酸(non-estesterified fatty acid,NEFA)是一類有機酸,主要由油酸(oleic acid,OA)、棕櫚酸(palmitic acid,PA)和硬脂酸(stearic acid,SA)等構成。血清中NEFA的濃度與脂代謝、糖代謝及內分泌功能密切相關[6-7]。足夠的能量攝入是奶牛發揮泌乳潛力的重要因素,但泌乳初期的奶牛由于內分泌系統的變化,使自身干物質攝入量下降,導致能量負平衡,此時機體會通過脂肪動員來維持能量代謝平衡。
脂肪動員是指儲存在脂肪組織中的脂肪,在一些脂肪酶的作用下逐步水解為NEFA和甘油并釋放進入血液,被其他組織利用進行氧化功能的過程[8]。NEFA是機體主要的儲備能量,圍產期奶牛的高能量需求會進一步促進脂肪動員。此時,奶牛體內大量的NEFA不能被完全氧化分解,進而造成奶牛氧化應激[9]。近年來,NEFA與PMN功能之間的作用關系受到了越來越多的關注。CROOKENDEN等[10]對高NEFA濃度奶牛中分離出的PMN進行轉錄組測序后發現粒細胞募集、干擾素信號傳導和細胞凋亡有關的基因下調,表明發生代謝應激的圍產期奶牛PMN功能受損,奶牛體內NEFA濃度過高會對先天免疫系統產生負面影響,并可能導致圍產期奶牛免疫抑制狀態的發生。HAMMON等[11]在研究圍產期奶牛外周血PMN功能、能量狀態和子宮健康之間的關系時發現,血液中NEFA含量顯著升高和干物質采食量下降后,能量負平衡奶牛的PMN殺菌能力顯著受損。ZERBE等[12]在研究肝臟甘油三酯含量與PMN功能關系時發現,從甘油三酯含量高的奶牛中分離出的PMN趨化和吞噬功能受損,呼吸暴發產生的ROS量也顯著下降,這可能有助于解釋能量負平衡奶牛子宮內膜炎的患病率更高的原因。CARRILLO等[13]研究發現OA可以誘導人PMN活化并通過鈣信號介導ROS產生。
綜上所述,圍產期奶牛持續加劇的能量負平衡狀態使奶牛體內NEFA濃度不斷升高,對PMN功能產生不利影響,這可能是圍產期奶牛更易患傳染性疾病如乳腺炎、子宮內膜炎等疾病的原因。目前對于NEFA和PMN遷移功能方面的研究較少。因此,本研究擬通過體外構建Transwell跨乳腺上皮遷移模型,并以此模型研究不同濃度的OA、PA及SA對PMN遷移功能的影響,為通過奶牛天然免疫系統防控奶牛乳腺炎提供理論依據。
1 材料與方法
1.1 實驗動物自黑龍江省安達市某規模化牧場隨機選取健康且處于泌乳期的奶牛。
1.2 主要試劑DMEM/F12培養基、RPMI 1640培養基和胎牛血清(FBS)購自Gibco公司;Transwell 24孔通透性嵌套(3.0 μm)和膠原蛋白(Collagen Ⅰ)購自Corning公司;PMN趨化肽N-Formyl-Met-Leu-Phe(fMLP)購自Sigma公司;牛外周血中性粒細胞分離Kit購自天津灝洋生物制品科技有限責任公司;胰蛋白酶、DMSO和Hank's緩沖液購自北京索萊寶科技有限公司;硬脂酸鈉溶液、油酸鈉溶液和棕櫚酸鈉溶液購自西安鯤創科技發展有限公司。
1.3 Transwell跨乳腺上皮遷移模型構建MAC-T細胞由本實驗室培養與凍存。將MAC-T細胞從液氮中取出,37℃水浴解凍。吸取細胞液至15 mL離心管中并加入等體積的DMEM/F12完全培養基(含10% FBS,青霉素/鏈霉素100 mg/L),1 500 r/min離心3 min,收集沉淀。加入DMEM/F12完全培養基重懸混勻細胞,以1×106/mL接種于25 cm2細胞培養瓶中,補充完全培養基至5 mL,于37℃、5% CO2培養箱中培養。待細胞長至培養瓶底達90%時,棄去瓶內培養基,用PBS洗滌2~3次,加入2 mL 0.25%胰酶,室溫或置于細胞培養箱內37℃消化。待鏡下觀察細胞變圓且有部分脫落時,加入4 mL完全培養基終止消化,按1∶2傳代培養;用乙酸(0.006 mol/L)將Collagen Ⅰ稀釋至0.012 mg/L,將Transwell嵌套倒置于無菌培養皿上,將稀釋好的Collagen Ⅰ均勻鋪在面積為0.33 cm2的Transwell嵌套底膜后,將培養皿置于生物安全柜中靜置過夜風干。將先前培養生長狀況良好的MAC-T(1×105個)接種于包被有Collagen Ⅰ的Transwell嵌套底膜,于37℃、5% CO2培養箱中6 h,取出平皿用Hank's液沖洗嵌套底面去除未貼壁細胞;用無菌鑷子將Transwell嵌套正置放入24孔板中,向Transwell嵌套中加入200 μL完全培養基,對應孔中加入500 μL完全培養基,于37℃、5% CO2培養箱中培養。待鏡下觀察細胞生長至底膜達90%時,將嵌套取出并用Hank's液沖洗2~3次后移回24孔板。
1.4 PMN分離與鑒定隨機挑選奶牛進行尾根靜脈采血至含枸櫞酸鈉的一次性負壓采血管中。備好15 mL離心管,做好標記,每管先加入4 mL PMN分離試劑A,后加入2 mL PMN分離試劑C;吸取1 mL 外周血緩慢加于分離液C上層,2 500 r/min離心30 min;取新離心管,將第2層乳白色環狀細胞層吸出到新離心管中,再加入適量紅細胞裂解液1 500 r/min離心10 min,重復1~2次直至無紅細胞殘留;棄上清用Hank's液洗滌2~3次,1 500 r/min 離心10 min,最后底部沉淀用1 mL RPMI 1640完全培養基重懸混勻,用Trypan blue染色后用于PMN活性鑒定,并用Countess細胞計數儀進行細胞計數;用DAPI染色后用熒光顯微鏡進行PMN純度鑒定。
1.5 NEFA對PMN跨奶牛乳腺上皮細胞遷移功能的影響用DMSO將PMN趨化肽fMLP稀釋至10 μmol/L,再將油酸鈉溶液、棕櫚酸鈉溶液和硬脂酸鈉溶液用去離子水稀釋,使油酸鈉溶液使用濃度分別為0.130,0.260,0.520 mmol/L,棕櫚酸鈉溶液使用濃度分別為0.1,0.2,0.4 mmol/L,硬脂酸鈉溶液使用濃度分別為0.04,0.08,0.16 mmol/L。取12個Transwell嵌套至24孔板中,每12孔為一組,其中前6孔作為空白對照組,其余6孔作為不同濃度的NEFA組分的試驗組,每組重復檢測3次。向每個嵌套中依次加入100 μL PMN(1×105個),并向空白對照組嵌套加入100 μL RPMI 1640完全培養基,試驗組嵌套加入100 μL各使用濃度的NEFA組分。依次向嵌套對應孔中加入990 μL RPMI 1640完全培養基及10 μL fMLP(10 μmol/L),使孔中fMLP終濃度為100 nmol/L。將放有Transwell嵌套的24孔板置于37℃、5% CO2培養箱中孵育2 h。將24孔板取出并移除Transwell嵌套,將孔中液體反復吹打混勻后,每孔收集300 μL液體到流式專用管中,用流式細胞儀進行計數。
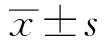
2 結果
2.1 Transwell跨乳腺上皮遷移模型構建對MAC-T進行復蘇培養,顯微鏡下觀察可見細胞均勻分布于培養瓶中,部分開始貼壁生長(圖1A);繼續培養至48 h,可見培養瓶底面呈典型上皮細胞樣的細胞,生長面積達95%以上(圖1B);在Transwell嵌套底面接種MAC-T,6 h后可見大部分MAC-T已貼壁生長(圖1C);繼續培養至48 h時,觀察底面可見MAC-T生長狀況良好,已覆滿整個底面,可用于后續試驗(圖1D)。

A.剛復蘇的MAC-T細胞;B.貼壁后的MAC-T細胞;C.接種MAC-T細胞 6 h;D.接種MAC-T細胞 48 h圖1 MAC-T細胞在Transwell嵌套底膜的培養(100×)
2.2 PMN活性及純度鑒定結果如圖2所示,PMN存活率大于95%,純度大于90%,滿足后續試驗要求。

圖2 PMN活性及純度鑒定
2.3 NEFA對PMN跨奶牛乳腺上皮細胞遷移功能的影響用不同濃度PA、SA和OA分別刺激PMN后,分別收集對應孔300 μL液體到流式專用管中,用流式細胞儀進行計數。結果顯示,PA和SA對PMN跨乳腺上皮遷移數量并無顯著影響(P>0.05)(圖3A、B);但不同濃度的OA可顯著促進PMN跨乳腺上皮遷移數量(P< 0.01),其作用特點呈劑量依賴效應(圖3C)。結果表明,NEFA的不同組分對PMN跨乳腺上皮遷移能力具有不同影響,其中,OA可以呈劑量依賴形式,促進PMN跨乳腺上皮遷移。

*表示與空白對照組差異顯著(P<0.05);**表示與空白對照差異極顯著(P<0.01);無*表示與空白對照組差異不顯著圖3 PA、SA及OA對PMN跨奶牛乳腺上皮遷移功能的影響
3 討論
健康奶牛體內NEFA濃度不高于0.4 mmol/L,泌乳初期的奶牛通過干物質采食所攝取的能量不能滿足全部能量需求,機體需要通過脂肪動員來維持能量代謝平衡[14]。圍產期奶牛的高能量需求會進一步促進脂肪動員,奶牛體內大量的NEFA不能被完全氧化分解,進而造成奶牛氧化應激[15]。有研究表明,NEFA的不完全氧化是導致圍產期奶牛免疫功能降低,患病風險升高的關鍵因素之一[16]。以往NEFA與PMN功能的研究集中在PMN趨化性、吞噬功能和ROS產生方面,而尤為重要的PMN遷移功能方面的研究較少[10-12]。
因此,本試驗構建Transwell跨乳腺上皮遷移模型,體外研究了不同濃度的OA、PA及SA對PMN遷移功能的影響。結果表明,PA和SA對PMN跨乳腺上皮遷移功能并無顯著影響,各濃度OA對PMN遷移功能均具有極顯著的促進作用,造成這種現象的原因可能是PMN表面存在游離酸脂肪受體-1(GPR40),OA可通過GPR40并以劑量依賴方式調節PMN細胞內的鈣動員,并以此增強了PMN遷移功能[17]。有研究表明,OA可通過活化蛋白激酶ERK信號通路促進Ca2+內流,Ca2+的升高直接影響F-肌動蛋白骨架重塑以及遷移過程中的整聯蛋白信號級聯傳導,從而促進PMN遷移功能[18-19]。綜上所述,NEFA不同組分對奶牛PMN遷移功能具有不同的影響,OA可以促進PMN跨乳腺上皮遷移能力,提示通過改善飼料成份和配比,提高OA在奶牛體內NEFA中的占比,可能有助于防治奶牛乳腺炎。

