m6A甲基化修飾在胃癌中的研究進展*
賈麗娟 張云強 綜述 張百紅 岳紅云 審校
作者單位:①甘肅中醫(yī)藥大學(xué)第一臨床醫(yī)學(xué)院(蘭州市730000);②中國人民解放軍聯(lián)勤保障部隊第九四〇醫(yī)院腫瘤科;③中國人民解放軍聯(lián)勤保障部隊第九四〇醫(yī)院眼科;④甘肅省人民醫(yī)院普外二科
胃癌(gastric cancer,GC)是消化系統(tǒng)最常見的惡性腫瘤之一,在世界范圍內(nèi)具有較高的發(fā)病率和死亡率,目前在全球癌癥死亡率中位居第3 位[1]。GC 早期癥狀不典型,通常在進展期被發(fā)現(xiàn)。目前,主要以手術(shù)治療為主,近年來GC 手術(shù)的規(guī)范化為患者的治療策略奠定了較好的基礎(chǔ)。同時,化療藥物、靶向藥物、免疫治療藥物的研發(fā)及應(yīng)用為不同發(fā)展階段的GC 患者治療提供了更多的選擇性。盡管如此,GC 患者的5年總生存率(overall survival,OS)仍較低[2]。GC 的發(fā)生發(fā)展是一個多步驟、多因素和多基因參與的極其復(fù)雜的過程,因此深入研究GC 的發(fā)病機制成為人類亟待解決的難題。
近年來,N6-甲基腺苷(N6-methyladenosine,m6A)RNA 表觀遺傳修飾成為腫瘤研究的熱點。研究已證實m6A RNA 修飾異常與多種腫瘤的發(fā)生發(fā)展密切相關(guān),其通過影響RNA 的轉(zhuǎn)錄、加工、翻譯和代謝等過程影響腫瘤的發(fā)生發(fā)展[3]。因此,本文就 m6A RNA 甲基化修飾在GC 發(fā)生發(fā)展中的作用以及化療耐藥做出綜述,旨在從表觀轉(zhuǎn)錄組學(xué)層面深入了解GC 的發(fā)病機制,為探索GC 靶向藥物治療提供新策略。
1 M6A 甲基化的概念
m6A 甲基化是指發(fā)生在RNA 中腺嘌呤(A)堿基的第6 位氮原子上的甲基化修飾,其是真核生物中mRNA 上最為常見的RNA 表觀遺傳修飾,不僅調(diào)控編碼RNAs,也修飾長鏈非編碼RNA(long noncoding RNA,lncRNA),主要富集在 mRNA 終止子附近的 3'非編碼區(qū)(3' untranslated region,3'UTR)[4]。m6A 甲基化修飾為一種動態(tài)可逆的調(diào)控修飾,mRNA 在m6A甲基轉(zhuǎn)移酶(m6A methyltransferase)的催化下發(fā)生甲基化,并在去甲基化酶(m6A demethylase)的作用下去掉甲基,重新恢復(fù)為腺苷;且甲基化的 mRNA 能夠被m6A 識別蛋白(m6A recognition protein) 選擇性識別結(jié)合,從而調(diào)節(jié)mRNA 的可變性剪接、出核轉(zhuǎn)運、翻譯和降解,最終調(diào)控轉(zhuǎn)錄后基因的表達。目前,m6A甲基化的蛋白主要分為甲基轉(zhuǎn)移酶、去甲基化轉(zhuǎn)移酶和m6A 識別蛋白。
m6A 甲基轉(zhuǎn)移酶也稱“編碼器”(writers),主要由甲基轉(zhuǎn)移酶樣 3(methyltransferase like 3,METTL3)、METTL14、METTL16)、Wilms' 腫瘤蛋白 1 相關(guān)蛋白(Wilms' tumor 1-associating protein,WTAP)、RNA 結(jié)合模體蛋白 15(RNA binding motif protein 15,RBM15)、病毒樣m6A 甲基轉(zhuǎn)移酶相關(guān)蛋白(virus like m6A methyltransferase associated protein,VIRMA,又稱為KIAA1429)、鋅指CCCH 型結(jié)構(gòu)域蛋白13(zinc finger CCCH domain-containing protein 13,ZC3H13)、Casitas B 系淋巴瘤原癌基因轉(zhuǎn)化序列樣蛋白1(Casitas Blineage lymphoma-trans forming sequence-like protein 1,CBLL1)又稱為HAKAI,均為核心組成的甲基轉(zhuǎn)移酶復(fù)合體催化mRNA 上的堿基發(fā)生m6A 甲基化修飾。在催化 m6A 形成的過程中,METTL14 與 METTL3 形成異二聚體發(fā)揮催化作用,其中METTL3 具有催化活性的亞基,負責(zé)將甲基增加到腺嘌呤第6 位氮原子;METTL14 通過結(jié)合mRNA 并協(xié)助甲基定位,負責(zé)識別底物;WTAP 通過穩(wěn)定METTL3 與METTL14 的相互作用發(fā)揮調(diào)節(jié)亞基的作用;KIAA1429 通過募集甲基轉(zhuǎn)移酶核心成分METTL3/METTL14/WTAP,介導(dǎo)3′UTR 和終止密碼子區(qū)域選擇性m6A 修飾;RBM15 可作為銜接蛋白招募WTAP/METTL3 復(fù)合物,使其選擇性地在特定的m6A 共識別位點進行甲基化;ZC3H13 調(diào)控WTAP 在RNA 上的募集并促進m6A 修飾,主要負責(zé)與RBM15 的連接,發(fā)揮支架作用協(xié)助ZC3H13/WTAP/KIAA1429(VIRMA)/HAKAI復(fù)合物進行核定位,確保m6A 沉積到靶向轉(zhuǎn)錄本上調(diào)控m6A 修飾水平的動態(tài)變化;METTL16 是新發(fā)現(xiàn)的具有催化活性的m6A 甲基轉(zhuǎn)移酶,與METTL3、METTL14 同源,可以靶向結(jié)合U6 小核 RNA(U6 snRNA)引起U6 第43 位的腺嘌呤發(fā)生m6A 甲基化修飾,從而影響U6 snRNP對mRNA 前體的剪接。
m6A 去甲基酶稱為“消碼器”(erasers),能夠“擦除”mRNA 上的m6A 甲基。m6A 去甲基化酶的成分主要包括脂肪質(zhì)量與肥胖相關(guān)蛋白(fat mass and obesity associated protein,F(xiàn)TO)基因和烷基化修復(fù)同源物3/5(alkylation repair homolog 3,ALKBH3)、ALKBH5,保證了m6A 的動態(tài)可逆過程,可去除m6A 甲基化,從而通過影響 m6A 甲基化腺苷去甲基化調(diào)控mRNA 加工、輸出和代謝過程。
m6A 結(jié)合蛋白稱為“讀碼器”(readers),能夠選擇特異性識別mRNA 的m6A 甲基化位點,主要有 YTH結(jié)構(gòu)域家族蛋白(YTH domain family 1/2/3,YTHDF1/2/3)和(YTH domain containing 1/2,YTHDC1/2)、胰島素樣生長因子2 mRNA 結(jié)合蛋白1/2/3(insulin-like growth factor 2 mRNA binding protein,IGF2BP1/2/3)、異質(zhì)核核糖核蛋白(heterogeneous nuclear ribonucleoproteins,HnRNPs) [異質(zhì)核核糖核蛋白C(HnRNPC) 、異質(zhì)核核糖核蛋白G(HnRNPG)、RNA 結(jié)合蛋白異質(zhì)核蛋白A2B1(HnRNPA2B1)] 及真核細胞起始因子3(eukaryotic initiation factor 3,eIF3)。這些蛋白能與m6A 位點結(jié)合,從而促進 mRNA 選擇性剪接、降解、翻譯、核輸出及穩(wěn)定性。
2 m6A 甲基轉(zhuǎn)移酶
2.1 METTL3
METTL3 是甲基轉(zhuǎn)移酶復(fù)合物的主要催化成分,其表達異常可改變 m6A mRNA 的命運,從而影響GC細胞的增殖、轉(zhuǎn)移、侵襲和凋亡。Yue 等[5]研究發(fā)現(xiàn),METTL3 表達水平升高與患者的不良預(yù)后呈正相關(guān),同時發(fā)現(xiàn)METTL3 有助于上皮間質(zhì)轉(zhuǎn)化(epithelialmesenchymal transition,EMT)過程和體內(nèi)的轉(zhuǎn)移。進一步研究發(fā)現(xiàn)在GC 中含1 的鋅指MYM 型(zinc finger MYM-type containing 1,ZMYM1)為METTL3的m6A 靶標(biāo)。METTL3 通過依賴m6A 的方式調(diào)控修飾 ZMYM1 mRNA, 提升ZMYM1 的穩(wěn)定性;ZMYM1 通過招募 CtBP/LSD1/COREST 復(fù)合物與E-鈣黏蛋白(E-cadherin)啟動子相互作用,介導(dǎo)抑制Ecadherin 的轉(zhuǎn)錄而促進EMT 程序和轉(zhuǎn)移,從而影響GC 細胞的浸潤和轉(zhuǎn)移。另有研究[6]發(fā)現(xiàn)METTL3在GC 中發(fā)揮致癌作用,敲除METTL3 可抑制GC 細胞的增殖、遷移和侵襲。機制研究發(fā)現(xiàn)下調(diào)METTL3可誘導(dǎo)失活A(yù)KT 信號通路,主要通過降低AKT 磷酸化水平和下游效應(yīng)因子p70S6K 和cyclin D1 的表達而抑制GC 細胞增殖;同時,METTL3下調(diào)增加了凋亡正性因子Bax 和caspase-3 表達,降低了凋亡負性因子Bcl-2 的表達,進而激活凋亡通路促進細胞凋亡。該研究提示下調(diào)METTL3 可能通過失活A(yù)KT 信號通路和促進細胞凋亡而抑制GC 細胞的遷移、轉(zhuǎn)移和侵襲,有望成為治療GC 的潛在靶點。Wang 等[7]的研究表明,METTL3 在GC 組織中的表達明顯升高,并與不良預(yù)后密切相關(guān)。進一步發(fā)現(xiàn)p300 介導(dǎo)METTL3 啟動子中H3K27 乙酰化活化促進METTL3轉(zhuǎn)錄,從而促進METTL3 的下游靶向基因HDGF 的表達,增加其mRNA m6A 修飾和提高HDGF mRNA的穩(wěn)定性。分泌型HDGF 能促進腫瘤血管生成,而核型HDGF 能激活GLUT4 和ENO2 的表達增加細胞糖酵解的能力。該研究提示METTL3/HDGF/GLUT4/ENO2 軸通過增加糖酵解和血管生成的能力促進GC的發(fā)生和轉(zhuǎn)移。Liu 等[8]研究發(fā)現(xiàn),METTL3 在GC患者中顯著表達,并且隨著腫瘤分期和分級的進展,METTL3 的表達水平逐漸升高。此外,敲除METTL3可降低EMT 相關(guān)蛋白α-平滑肌肌動蛋白的表達,從而抑制GC 細胞增殖和遷移能力。另有研究[9]報道了METTL3 高表達與GC 患者的臨床病理特征和較差的生存期顯著相關(guān),敲除METTL3 能有效抑制細胞增殖、遷移和侵襲能力。進一步RNA-seq 和m6Aseq 分析發(fā)現(xiàn)METTL3 可通過調(diào)控MYC 靶基因上的關(guān)鍵蛋白(如MCM5、MCM6 等)介導(dǎo)m6A 修飾而促進GC 發(fā)生發(fā)展。此外,Yang 等[10]進一步研究發(fā)現(xiàn)在GC 組織和細胞中METTL3 和MYC 的表達均上調(diào);并且METTL3 通過提高MYC m6A 甲基化水平,促進了MYC 蛋白的翻譯,從而增強GC 細胞的增殖、遷移和侵襲。Jiang 等[11]研究發(fā)現(xiàn),在GC 細胞中敲除METTL3 可導(dǎo)致GC 細胞中細胞因子信號抑制(SOCS)蛋白家族SOCS2 表達增加,且SOCS2 的表達與GC 細胞增殖呈負相關(guān)。提示GC 細胞中METTL3 下調(diào)可誘導(dǎo)SOCS2 表達增加而抑制GC 細胞增殖。最近的一項研究[12]發(fā)現(xiàn),m6A 和METTL3表達水平在GC 中升高,且METTL3 表達升高提示患者的惡性程度較高及預(yù)后較差。METTL3 通過依賴m6A/DGCR8 的方式促進pri-miR-17-92 進入致癌miR-17-92 簇,而miR-17-92 能夠靶向抑制腫瘤抑制因子PTEN 或TMEM127 的表達激活腫瘤AKT/mTOR通路,從而促進GC 的生長和轉(zhuǎn)移。
2.2 METTL14
METTL14 在GC 中發(fā)揮抑癌作用。Liu 等[13]通過分析臨床樣本和生物信息學(xué)方法研究發(fā)現(xiàn)METTL14 在GC 組織的表達水平低于癌旁組織,且METTL14 表達與TNM 分期顯著相關(guān);Kaplan-Meier 顯示METTL14高表達患者的預(yù)后優(yōu)于METTL14低表達患者。機制研究發(fā)現(xiàn)METTL14 下調(diào)增加了腫瘤激活因子PI3K、AKT 和mTOR 蛋白磷酸化水平,而METTL14 過表達降低了上述蛋白的表達而抑制GC 細胞增殖和侵襲。此外,研究METTL14 與EMT相關(guān)性,發(fā)現(xiàn)METTL14 過表達組中EMT 相關(guān)的蛋白vimentin、N-cadherin、MMP9 蛋白低表達,而Ecadherin 蛋白高表達;而METTL14 下調(diào)時,上述蛋白的表達相反,從而促進EMT 過程增強GC 細胞的遷移和侵襲。提示METTL14 通過抑制PI3K/AKT/mTOR 通路和調(diào)控EMT 通路來抑制GC 細胞的進展和侵襲,有望成為GC 中一個新興的生物標(biāo)志物。
2.3 WTAP
WTAP 作為甲基轉(zhuǎn)移酶復(fù)合物輔助因子,在調(diào)控m6A 甲基化修飾過程中具有重要的作用。最新的兩項研究證實WTAP 在GC 中扮演致癌基因的作用。一項研究利用組織芯片和癌癥基因組圖譜(the cancer genome atlas,TCGA)數(shù)據(jù)集檢測WTAP 的表達,發(fā)現(xiàn)WTAP 在GC 中高表達,并且其高表達與預(yù)后不良密切相關(guān),證實了WTAP 的表達是GC 生存的獨立預(yù)測因子。機制研究發(fā)現(xiàn)WTAP 的表達與腫瘤免疫調(diào)節(jié)相關(guān),WTAP 低表達可通過增加免疫調(diào)節(jié)核心基因的表達增強腫瘤免疫功能,從而抑制GC 的增殖并同時提高患者的生存預(yù)后;而WTAP 高表達可抑制腫瘤免疫功能而提升GC 的增殖能力[14]。這提示W(wǎng)TAP可通過調(diào)節(jié)腫瘤免疫功能影響GC 的發(fā)生發(fā)展。另一項研究[15]利用m6A 免疫沉淀測序分析(m6A immun oprecipitation sequencing analysis,MeRIP-Seq)分析證實WTAP 和m6A 在GC 組織和細胞中的表達均上調(diào),且WTAP 的高表達與GC 患者預(yù)后不良密切相關(guān)。機制研究發(fā)現(xiàn)WTAP 與GC 的Warburg 效應(yīng)(又稱有氧糖酵解,是指癌癥中葡萄糖代謝和能量供應(yīng)異常)有關(guān);利用體外功能實驗表明,WTAP 過表達能夠促進腫瘤的增殖和提高糖酵解能力;而體內(nèi)異種移植實驗表明,沉默WTAP 可抑制腫瘤的生長。進一步使用MeRIP-Seq 和MeRIP-qPCR 研究發(fā)現(xiàn)腫瘤代謝指標(biāo)HK2 為WTAP 的靶標(biāo),WTAP 可與3'UTR m6A 位點結(jié)合進而增強HK2 mRNA 的穩(wěn)定性,從而促進GC 細胞的發(fā)生發(fā)展。該研究提示W(wǎng)TAP 通過增強HK2 表達和參與調(diào)節(jié)Warburg 效應(yīng)在GC 中發(fā)揮致癌作用,為GC 的治療提供了新的途徑和靶點。
2.4 KIAA1429(VIRMA)
KIAA1429 作為支架連接m6A 甲基轉(zhuǎn)移酶復(fù)合物的催化核心成分,其在GC 中的作用逐漸被發(fā)現(xiàn)。最新的研究[16]采用實時定量聚合酶鏈反應(yīng)和蛋白印跡法檢測KIAA1429 在GC 組織和細胞系中的表達,結(jié)果發(fā)現(xiàn)KIAA1429 在GC 組織表達較癌旁組織表達高。功能實驗發(fā)現(xiàn)上調(diào)KIAA1429 可促進GC 細胞增殖,而下調(diào)KIAA1429 可抑制GC 細胞增殖。通過mRNA 高通量測序和RNA 免疫沉淀法(RNA immunoprecipitation,RIP)分析發(fā)現(xiàn),c-Jun是KIAA1429潛在的調(diào)控基因。值得關(guān)注的是,KIAA1429 能通過非依賴m6A 的方式調(diào)控c-Jun 的表達;此外,c-Jun 過表達可解除KIAA1429 基因下調(diào)引起的GC 細胞增殖抑制。該研究提示KIAA1429 在GC 中發(fā)揮致癌作用,可作為GC 潛在預(yù)后生物標(biāo)志物和治療靶點。
2.5 METTL16
METTL16 是一種新發(fā)現(xiàn)的m6A 甲基轉(zhuǎn)移酶,主要甲基化 mRNA 的 3'非翻譯區(qū)的 m6A 位點。Wang等[17]研究發(fā)現(xiàn),METTL16 在GC 細胞和組織中高表達,并且其高表達與GC 患者預(yù)后不良相關(guān)。體內(nèi)外實驗均證實METTL16 可促進GC 細胞增殖和腫瘤生長。此外,下調(diào)METTL16 可通過阻斷G1 期向S 期轉(zhuǎn)化進程抑制細胞增殖;進一步機制研究發(fā)現(xiàn)cyclin D1 是METTL16 的下游調(diào)控蛋白;敲除METTL16 可降低GC 細胞中m6A 的整體水平和cyclin D1 mRNA的穩(wěn)定性及其表達。該研究表明,METTL16 在GC中具有促癌作用,通過介導(dǎo)m6A 甲基化水平增強cyclin D1 mRNA 的穩(wěn)定性,上調(diào)cyclin D1 的表達,從而促進GC 細胞的增殖和侵襲,這為探索GC 治療的有效策略提供了可能的途徑。
2.6 RBM15/15B
RBM15 是Split Ends(SPEN)蛋白家族的成員,是保守的RNA 結(jié)合蛋白,其可以通過與剪接體成分相互作用與RNA 結(jié)合。研究者通過檢索TCGA 數(shù)據(jù)庫中GC 患者的生物信息學(xué)分析發(fā)現(xiàn)RBM15 與總生存率(overall survival,OS)密切相關(guān);并且建立RBM15 的GC 預(yù)后風(fēng)險預(yù)測模型,發(fā)現(xiàn)RBM15 的HR<1,可作為GC 的保護基因。進一步體外利用RTPCR 技術(shù)檢測RBM15 結(jié)果顯示,與正常胃黏膜細胞GES-1 相比,RBM15 在GC 細胞中弱表達且RBM15 mRNA 表達下調(diào)。此外,利用免疫組織化學(xué)檢測GC組織和相鄰組織中RBM15 蛋白水平,結(jié)果發(fā)現(xiàn)RBM15 在癌旁組織中高表達,在癌組織中弱表達[18]。該研究標(biāo)明,RBM15 在GC 中可能發(fā)揮抑癌作用。然而,截至目前,關(guān)于RBM15 在GC 中的表達及功能的研究非常有限,未來仍有很大的發(fā)展空間。
3 m6A 去甲基轉(zhuǎn)移酶
3.1 FTO
FTO 是最早發(fā)現(xiàn)的 m6A 去甲基化酶,研究發(fā)現(xiàn)FTO 與GC 的發(fā)生發(fā)展相關(guān),有望成為監(jiān)測GC 預(yù)后的重要分子靶標(biāo)。研究者通過采用組織芯片免疫組織化學(xué)法檢測GC 組織和癌旁正常組織中FTO 的表達情況,發(fā)現(xiàn)FTO 在GC 組織中的表達明顯高于癌旁正常組織;進一步發(fā)現(xiàn)FTO 表達水平與低分化、淋巴結(jié)轉(zhuǎn)移密切相關(guān),且與TNM 分期呈正相關(guān);Kaplan-Meier 分析顯示,高FTO 表達與GC 患者預(yù)后不良顯著相關(guān)[18-19]。Zhang 等[20]研究發(fā)現(xiàn),低m6A 信號與GC的不良臨床病理特征有關(guān);機制研究發(fā)現(xiàn)FTO 過表達,可降低 RNA m6A 甲基化水平,激活 Wnt/PI3K-AKT通路而促進GC 的惡性表型。Yang 等[21]利用RT-qPCR和Western blot 檢測結(jié)果顯示GC 組織中MYC 表達升高;進一步研究發(fā)現(xiàn),F(xiàn)TO 可以去除MYC 基因5′端m6A 修飾,降低GC 細胞中MYC m6A mRNA 表達水平,增加MYC mRNA 穩(wěn)定性,進而提高MYC 在GC 中的表達,最終促進GC 的增殖;相反,沉默F(xiàn)TO后,MYC 表達下調(diào),抑制GC 的增殖。該研究驗證了FTO/m6A/MYC 軸在GC 靶向表觀遺傳修飾中的致癌潛力。
3.2 ALKBH5
ALKBH5 在GC 中異常表達,但目前其在GC 中的作用尚未明確。陸瑛等[22]研究發(fā)現(xiàn)ALKBH5 在彌漫性胃腺癌中的表達低于正常胃黏膜組織。進一步研究發(fā)現(xiàn),ALKBH5 表達下調(diào)后,mRNA去甲基化能力下降,E-cadherin mRNA 的穩(wěn)定性減低,從而使細胞的極性和骨架結(jié)構(gòu)變得更為疏松而更具侵襲性。機制研究發(fā)現(xiàn)ALKBH5 過表達,可下調(diào)基質(zhì)金屬蛋白酶MMP-2、MMP-9 表達而降低EMT 水平,從而抑制GC 細胞轉(zhuǎn)移和侵襲能力。然而,Zhang 等[23]的研究與上述的研究結(jié)果相反,該研究團隊發(fā)現(xiàn)ALKBH5能夠潛在結(jié)合lncRNA NEAT1(nuclear paraspeckle assembly transcript 1),且發(fā)現(xiàn)NEAT1 和ALKBH5在GC 中顯著過表達,同時兩者高表達與GC 中的侵襲和轉(zhuǎn)移相關(guān)。進一步的實驗證實,ALKBH5與NEAT1的表達呈正相關(guān),敲除ALKBH5上調(diào)NEAT1 RNA 的m6A 水平,可抑制GC 中NEAT1 的表達;此外,敲除NEAT1 能夠顯著抑制GC 細胞的侵襲和轉(zhuǎn)移。機制研究發(fā)現(xiàn),ALKBH5 和NEAT1 通過正反饋調(diào)節(jié)EZH2(多梳抑制復(fù)合體的一個亞基)的表達加速惡性表型的形成,從而影響GC 細胞的侵襲和轉(zhuǎn)移。該研究表明,ALKBH5 通過去甲基化lncRNA NEAT1促進GC 侵襲和轉(zhuǎn)移,ALKBH5/ lncRNA NEAT1/ EZH2軸可能是GC 潛在的治療靶點。
4 m6A 結(jié)合蛋白
4.1 YTH 結(jié)構(gòu)域家族
YTH 結(jié)構(gòu)域家族蛋白與含有m6A 的 mRNA 結(jié)合,可調(diào)控mRNA 的定位和穩(wěn)定性,該家族蛋白與GC 的發(fā)生發(fā)展相關(guān)。一項研究[24]通過分析不同人類癌癥數(shù)據(jù)庫的多種生物信息,發(fā)現(xiàn)約7%的GC 患者發(fā)生了YTHDF1 突變,且YTHDF1 高表達與腫瘤高增殖侵襲率和總生存期較差相關(guān)。體內(nèi)外實驗均證實,下調(diào)YTHDF1 可抑制GC 細胞的增殖。機制研究發(fā)現(xiàn)YTHDF1 以依賴m6A 的方式促進Wnt 通路關(guān)鍵受體蛋白7(frizzled 7,F(xiàn)ZD7)的翻譯,從而增強FZD7 的表達,最終激活Wnt/β-catenin 信號通路促進GC 的發(fā)生。該研究結(jié)果證實了YTHDF1 及其m6A介導(dǎo)的Wnt/β-catenin 信號通路在GC 中的致癌作用。此外,另有[25]研究通過對TCGA 數(shù)據(jù)庫GC 患者的m6A 基因進行全面分析,也發(fā)現(xiàn)YTHDF1 在GC 中的表達上調(diào),且 YTHDF1的高表達與高危型GC 患者顯著相關(guān),提示YTHDF1 可能是GC 早期診斷的潛在靶點。最新的一項研究進一步證明YTHDF1 在GC 組織中高表達,且YTHDF1 的上調(diào)與GC 分期、癌灶、腫瘤大小及預(yù)后不良顯著相關(guān),是GC 患者生存不良的獨立預(yù)后因素。體內(nèi)外實驗發(fā)現(xiàn),下調(diào)YTHDF1 可抑制GC 細胞增殖和侵襲,以及抑制體內(nèi)腫瘤的發(fā)生和肺轉(zhuǎn)移,并可同時誘導(dǎo)細胞凋亡。RNAseq、MeRIPseq 和RIP-seq 的交叉實驗表明,USP14 是YTHDF1的下游靶點,且USP14 表達上調(diào)與YTHDF1 表達呈正相關(guān)。進一步發(fā)現(xiàn)YTHDF1 能夠以依賴m6A 的方式促進USP14 蛋白的翻譯,從而促進GC 的發(fā)生和轉(zhuǎn)移[26]。該研究表明,YTHDF1-USP14 在GC 的發(fā)生發(fā)展中具有重要意義,為GC 的預(yù)后、治療或診斷提供了重要依據(jù)。Shen 等[27]分析公共數(shù)據(jù)庫GC 患者中YTHDF2 的表達水平,發(fā)現(xiàn)YTHDF2 在GC 組織表達明顯低于正常胃黏膜組織,且YTHDF2 的低表達與GC 臨床分期和患者的生存預(yù)后密切相關(guān);進一步通過RNA-Seq 實驗發(fā)現(xiàn)YTHDF2 與叉頭蛋白C2(forkhead box protein C2,F(xiàn)OXC2) 的表達呈負相關(guān),且YTHDF2 可通過負向調(diào)控FOXC2 表達水平抑制GC 的惡性增殖。該研究提示YTHDF2 在GC 中扮演抑癌作用,有望為臨床上治療GC 提供一個潛在的靶點。
4.2 IGF2BPs
m6A 結(jié)合蛋白 IGF2BPs 在GC 中異常表達。以往的研究已經(jīng)證實前蛋白易位因子SEC62 具有致癌功能,He 等[28]研究發(fā)現(xiàn),SEC62 在GC 中呈高水平表達,且下調(diào)SEC62 可抑制GC 細胞的增殖同時促進細胞凋亡。機制研究發(fā)現(xiàn),METTL3 與SEC62 mRNA相互作用可誘導(dǎo)修飾SEC62 mRNA 上的m6A,從而促進IGF2BP1 對SEC62 mRNA 的穩(wěn)定作用,最終促進GC 的進展。Wang 等[29]研究發(fā)現(xiàn),m6A 修飾基因IGF2BP1、IGF2BP2 和IGF2BP3 在GC 組織中的mRNA 表達顯著升高。進一步研究發(fā)現(xiàn),IGF2BP1 表達水平較高提示患者的總生存期較差,該研究表明IGF2BP1 在GC 中可能發(fā)揮致癌作用。有研究[30]為確定IGF2BP1 參與GC 細胞的增殖和轉(zhuǎn)移情況,將IGF2BP1 siRNA 靶向轉(zhuǎn)染到人GC 細胞SGC7901和MGC803 中,功能實驗顯示,下調(diào)IGF2BP1 能顯著抑制GC 細胞的增殖。此外,敲除IGF2BP1 能誘導(dǎo)細胞凋亡并伴有Bax 表達升高和Bcl-2、Bcl-Xl 表達降低,同時導(dǎo)致GC 細胞周期S 期檢查點蛋白質(zhì)CDK2、cyclin A2 表達減少及細胞周期S 期阻滯,從而顯著抑制GC 細胞的增殖和轉(zhuǎn)移。免疫組織化學(xué)分析顯示IGF2BP1 在GC 組織中高表達且主要在細胞質(zhì)中表達。該研究結(jié)果進一步揭示出IGF2BP1 在GC 中發(fā)揮致癌作用。此外,Shen 等[31]研究發(fā)現(xiàn),長鏈非編碼RNA LINC01559 在GC 細胞中表達顯著上調(diào)。功能實驗檢測顯示沉默LINC01559 可抑制GC 細胞的增殖、遷移和EMT 過程。此外,染色質(zhì)免疫沉淀(chromatin immunoprecipitation,ChIP)實驗表明,作為轉(zhuǎn)錄因子的(zinc finger E-box binding homeobox 1,ZEB1)可與LINC01559 的啟動子結(jié)合,促進GC 細胞中LINC01559 的表達;而LINC01559 通過招募IGF2BP2 穩(wěn)定ZEB1 mRNA 的表達促進GC 的進展。該研究證實ZEB1 誘導(dǎo)的LINC01559 通過招募IGF2BP2 穩(wěn)定ZEB1 mRNA 表達,從而加速GC 細胞增殖、遷移和EMT 過程。
4.3 EIF
EIF3 是最大的真核起始因子,具有m6A 的讀碼功能,在翻譯起始進程中起著核心作用。He 等[32]研究發(fā)現(xiàn), EIF3D 在GC 中表達上調(diào),其高表達與GC不良臨床預(yù)后顯著相關(guān)。另有研究[33]使用cBioPortal和Oncomine 數(shù)據(jù)庫發(fā)現(xiàn)在GC 樣本中存在EIF3H基因改變(突變、缺失和擴增),并且 EIF3H mRNA 在GC 組織中也上調(diào)。機制研究發(fā)現(xiàn)下調(diào)EIF3H 可使細胞周期阻滯在G0/G1 期而抑制GC 細胞的增殖;同時通過上調(diào)促凋亡因子和下調(diào)抗凋亡因子誘導(dǎo)細胞凋亡。這些結(jié)果提示EIF3H 可作為臨床治療GC 的一個新的治療靶點。此外,EIF3B 是EIF3 復(fù)合物的主要支架亞基,在mRNA 翻譯、細胞生長和腫瘤發(fā)展中起著重要的調(diào)控作用。Ma 等[34]研究發(fā)現(xiàn),EIF3B 在人慢性胃炎和GC 組織中表達上調(diào),且EIF3B 的表達與GC的分期和進展有關(guān)。提示幽門螺桿菌(Helicobacter pylori,Hp)感染可上調(diào)GC 細胞中EIF3B 的表達,提示EIF3B 可能參與了Hp 的致癌過程。進一步發(fā)現(xiàn)下調(diào)EIF3B 可以通過調(diào)控癌相關(guān)基因的表達來抑制GC 細胞的增殖和轉(zhuǎn)移。此外,另有研究[35]顯示EIF3B 在GC 組織中表達顯著上調(diào),且EIF3B 高表達與腫瘤浸潤深度、淋巴結(jié)轉(zhuǎn)移、TNM 分期及不良預(yù)后顯著相關(guān)。機制研究發(fā)現(xiàn)EIF3B 通過調(diào)控EMT 和STAT3 信號通路促進腫瘤細胞的遷移和侵襲;同時基因富集分析(GSEA)和Western blot 結(jié)果表明,上調(diào)EIF3B 表達能增強PI3K/AKT/mTOR 信號通路的活性,從而促進GC 的進展。敲除EIF3B 可以抑制移植瘤的生長和體內(nèi)肺轉(zhuǎn)移。該研究證實了EIF3B 在GC 發(fā)生發(fā)展中發(fā)揮著致癌作用,是GC 患者的獨立預(yù)后因素,這可能有助于探索和發(fā)現(xiàn)GC 治療的新靶點。
4.4 hnRNPs 超家族蛋白
hnRNPs 超家族蛋白中的部分蛋白被鑒定為m6A 甲基化結(jié)合蛋白質(zhì),它們的異常表達會影響mRNA 的穩(wěn)定性、翻譯、剪接以及腫瘤的增殖轉(zhuǎn)移,但是目前其在GC 中的作用尚無大量的文獻報道。Chen 等[36]研究通過檢索TCGA 數(shù)據(jù)庫分析GC 中hnRNPR 的表達,結(jié)果顯示,與正常組織相比,HnRNPR在GC 組織中顯著高表達。更重要的是,免疫組織化學(xué)染色結(jié)果顯示:HnRNPR 在GC 組織中也顯著高表達,且hnRNPR 的高表達與腫瘤的侵襲性密切相關(guān)。CCNB1 是一種有絲分裂特異性因子,其與CDK1 形成復(fù)合物調(diào)節(jié)細胞周期G2-M 的轉(zhuǎn)變;CENPF 是著絲粒家族的成員,其負責(zé)調(diào)控腫瘤轉(zhuǎn)移。機制研究發(fā)現(xiàn)hnRNPR 的表達與CCNB1、CENFP的表達呈正相關(guān),hnRNPR 高表達可通過正反饋上調(diào)CCNB1 和CENPF 的表達,直接與CCNB1 和CENPF mRNA 相互作用調(diào)控GC 的細胞周期和腫瘤轉(zhuǎn)移,從而促進GC 細胞的增殖與轉(zhuǎn)移。該研究提示hnRNPR-CCNB1/CENPF軸可能是治療GC 患者的潛在靶點[36]。提示hnRNPA2B1 在各類GC 細胞中均過表達,而在胃腺黏液癌中hnRNPA2B1 擴增最多,且hnRNPA2B1的過表達與低生存率相關(guān)。細胞功能實驗發(fā)現(xiàn)hnRNPA2B1 通過促進細胞增殖和轉(zhuǎn)移,同時抑制細胞凋亡來維持GC 的惡性表型。此外,機制研究發(fā)現(xiàn)BIRC5-202 是hnRNPA2B1 的關(guān)鍵下游靶點,hnRNPA2B1 可與幾個核心剪接體共同表達,調(diào)控抗凋亡因子BIRC5 的可變剪接,增加致癌亞型BIRC5-202 的表達,從而促進GC 細胞增殖和轉(zhuǎn)移[37]。
目前的研究結(jié)果表明,m6A 甲基化在GC 的發(fā)生發(fā)展中具有重要作用,未來可能會成為GC 治療的潛在藥物靶點,表1。
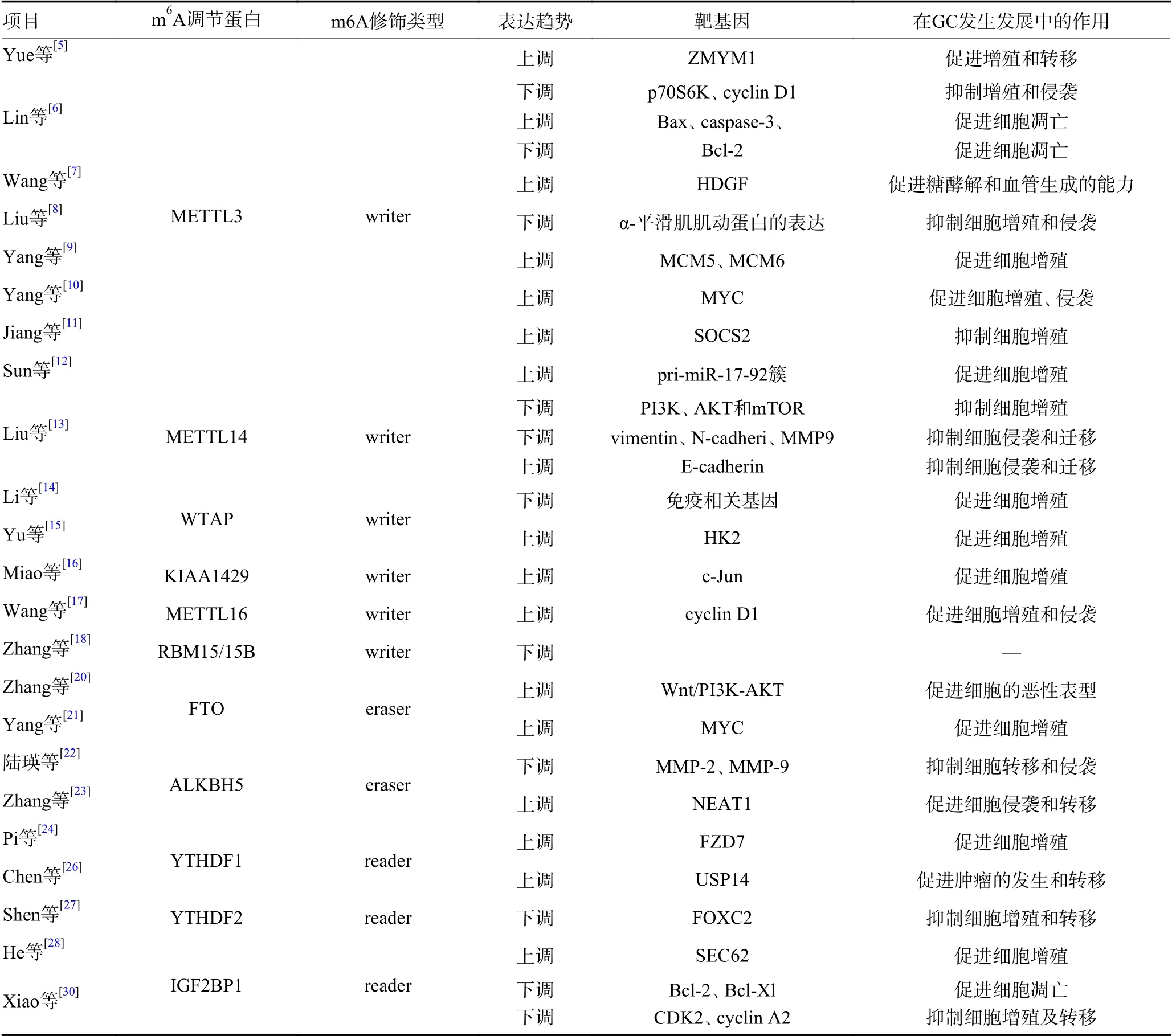
表1 GC 中m6A 調(diào)節(jié)蛋白的表達與功能
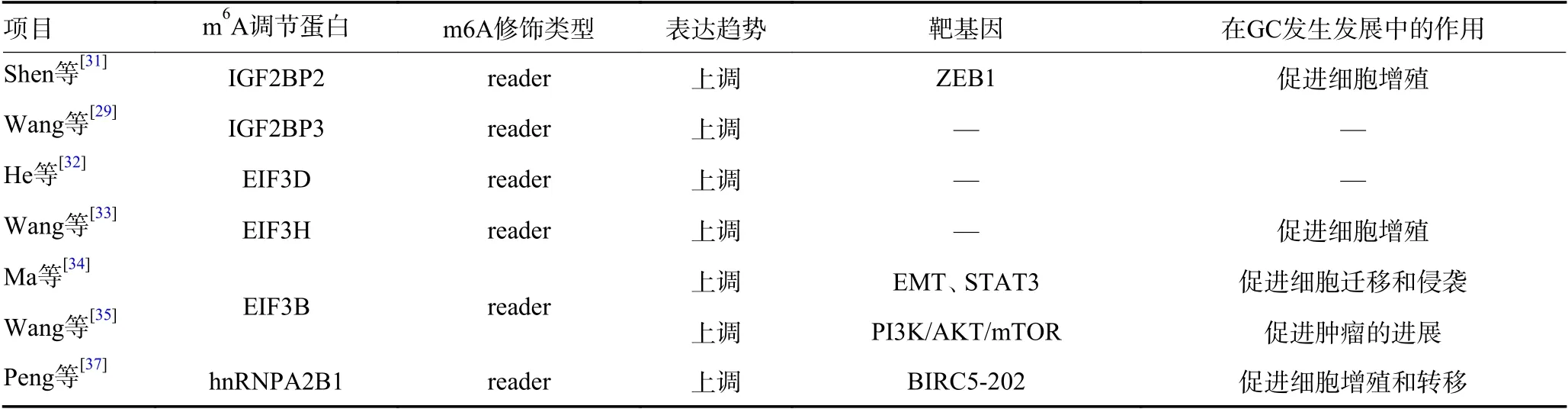
表1 GC 中m6A 調(diào)節(jié)蛋白的表達與功能(續(xù)表1)
5 m6A 與GC 化療耐藥
在腫瘤的治療過程中,化學(xué)藥物治療有著不可替代的作用。但是,由于許多遺傳和表觀遺傳信息的改變,化療耐藥仍然是惡性腫瘤治療失敗的最大原因。m6A 修飾相關(guān)蛋白在GC 化療耐藥中發(fā)揮重要的作用,有望成為GC 耐藥治療的新靶點。質(zhì)子泵抑制劑可能是一種較好的治療策略,可增加GC 細胞對抗腫瘤藥物的敏感性。用奧美拉唑預(yù)處理可增強5-FU、DDP、TAX 對GC 細胞的抑制作用。Feng 等[38]研究發(fā)現(xiàn),用奧美拉唑預(yù)處理可誘導(dǎo)FTO 表達下調(diào)而提升細胞總m6A 水平。進一步機制研究發(fā)現(xiàn)奧美拉唑誘導(dǎo)的FTO 抑制可增強激活mTORC1 信號通路,并抑制自噬,從而提高GC 細胞化療藥物誘導(dǎo)的細胞凋亡而提高療效。同時,經(jīng)奧美拉唑誘導(dǎo)的FTO 沉默通過依賴m6A 機制提高mTORC1 下游凋亡相關(guān)的腫瘤抑制基因DDIT3 的轉(zhuǎn)錄水平而促進細胞凋亡。該研究提示m6A 修飾FTO 可能在GC 中提高質(zhì)子泵抑制劑奧美拉唑介導(dǎo)的化療敏感性。此外,一項Ⅱ期研究中,證實了依維莫司對以前治療過的晚期GC 患者顯示出了良好的療效。近期研究發(fā)現(xiàn)依維莫司可靶向干預(yù)GC 中METTL3/miR-17-92/TMEM127或PTEN/mTOR信號通路而提高化療敏感性;進一步研究發(fā)現(xiàn)METTL3 高表達的GC 對mTOR 抑制劑依維莫司表現(xiàn)出更高的敏感性,并且依維莫司可以劑量依賴的方式逆轉(zhuǎn)METTL3 誘導(dǎo)的腫瘤增殖。該研究結(jié)果揭示了METTL3 水平可能是依維莫司治療GC 療效的潛在預(yù)測因子,也為依維莫司治療m6A/METTL3 水平較高的GC 提供了理論依據(jù)[12]。
6 結(jié)語與展望
綜上所述,目前已證實m6A 甲基化修飾在GC 的發(fā)生發(fā)展中發(fā)揮重要作用,參與調(diào)控GC 的增殖、轉(zhuǎn)移、凋亡和調(diào)節(jié)化療耐藥性,并影響著GC 的預(yù)后。但目前m6A 甲基化相關(guān)蛋白在GC 中的研究仍較少,亟需更多大規(guī)模的臨床研究進一步闡明m6A 甲基化修飾調(diào)控GC 及誘發(fā)GC 的分子機制,探索可能作為GC 早期診斷和治療的敏感性更高的m6A 甲基化標(biāo)志因子,將有助于為臨床GC 患者判斷預(yù)后及探索新的靶向治療創(chuàng)造更多的機遇。

