血管緊張素Ⅱ對慢性深部胸骨感染患者清創術中低血壓的預警作用
姚歡杰 王凱璇 崔振田 陸龍 郭文治
據統計開胸心臟術后大約有0.5%~6.8%患者會發生胸骨感染,嚴重者會累及切口深部的胸骨或胸骨后組織及縱膈筋膜,稱為深部胸骨感染(deep sternal wound infection,DSWI)[1,2],其病死率可高達8%~45%[3,4]。外科清創加肌瓣轉移重建是這類患者的主要治療手段,然而這些患者由于長期處于感染狀態,全身麻醉后血管擴張加上手術清除壞死胸骨和組織時炎性介質的釋放,術中常容易出現血管擴張性休克。而術中低血壓以及大量使用血管活性藥均會導致許多不良反應[5,6]。文獻報道,發生血管擴張性休克的患者30天后死亡率可高達50%[7]。研究表明機體的腎素-血管緊張素-醛固酮系統參與了感染的進程和血壓的調節[8,9],血管緊張素Ⅱ是其發揮作用的最主要激素,可以收縮血管、激活交感神經系統、增加心肌收縮力、促進醛固酮和加壓素的分泌及抗尿鈉排泄。2017年FDA批準血管緊張素Ⅱ用于治療成人血管擴張性休克。本研究旨在研究術前血管緊張素Ⅱ值與這類患者術中低血壓的關系,將為減少此類患者術中低血壓及低血壓導致的各種并發癥提供重要參考。
1 資料與方法
1.1 一般資料 選取2019年7月至2021年2月行胸壁病損清除術且年齡≥18歲、ASA≤Ⅲ級、心功能≤3級的Ⅱ、Ⅲ型胸骨感染患者21例,Ⅱ型常發生于術后1個月,存在疏松結締組織炎、縱隔化膿及骨髓炎;Ⅲ型發生在術后的數月甚至數年,常表現為慢性竇道形成和局部疏松結締組織炎[10]。排除標準:Ⅰ型切口淺表感染患者;合并腎性高血壓;冠脈搭橋術后仍存在心絞痛癥狀的患者;合并其他嚴重疾病,ASA>Ⅲ級、心功能>3級,EF<50%的患者。
1.2 麻醉方法 患者入手術室后監測血壓、心率、脈搏血氧飽和度、腦電雙頻指數;在局麻下行橈動脈穿刺置管,監測有創動脈血壓后進行麻醉誘導。誘導:咪達唑侖0.04 mg/kg,丙泊酚1.5 mg/kg,依托咪酯0.2 mg/kg,順式阿曲庫銨0.3 mg/kg,舒芬太尼0.4 μg/kg。氣管插管后丙泊酚4~12 mg·kg-1·h-1、瑞芬太尼0.2~0.4 μg·kg-1·min-1持續泵注聯合1%七氟烷靜吸復合維持麻醉。術中根據目標導向液體治療進行補液,晶體使用乳酸鈉林格,膠體使用萬汶。圍術期根據血壓水平使用血管活性藥。手術結束后拔管送回病房。
1.3 觀察指標 全身麻醉后出現低血壓,收縮壓下降超過基礎值的20%或者MAP≤65 mm Hg,排除麻醉或手術因素并積極容量復蘇后,需持續給予血管活性藥才能維持血流動力學穩定,則被定義為由于長期慢性感染導致的術中低血壓(A組),否則為B組。術中心血管不良事件(ACVE)包括:(1)血流動力學波動劇烈:與患者基礎血壓、心率相比術中血壓、心率升高或降低幅度超過基線水平的30%;(2)心肌缺血/梗死;(3)影響血流動力學的心律失常;(4)心力衰竭、心源性死亡。記錄術中發生低血壓的人數并分組,記錄誘導后(T1)、插管后5 min(T2)、清除壞死胸骨/肋軟骨/疏松結締組織時(T3)、手術結束時(T4)、拔管后5 min(T5)的MAP、CO、SVV;記錄術中ACVE的發生率,記錄術后并發癥包括但不限于ACVE、低血壓、再次感染、急性譫妄、術后30 d死亡等;入院時、術中1 h時以及術后感染控制后出院前1 d分別抽取靜脈血,測量術前、術中、術后的ATⅡ值。
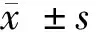
2 結果
2.1 一般資料比較 21例患者中有5例患者符合低血壓的定義,故A組5例,B組16例。A組的感染時長明顯短于B組(P<0.05);其余資料差異無統計學意義(P>0.05)。見表1。

表1 2組一般資料和術中情況比較
2.2 2組不同時間點血管緊張素Ⅱ值比較 B組中有1位患者術前、術中、術后血管緊張素Ⅱ值分別為184.8 pg/ml、132.8 pg/ml、140.5 pg/ml,統計箱圖表明該患者的所有血管緊張素Ⅱ值均為極端值,查閱相關資料,發現其數值遠遠超出正常人血管緊張素Ⅱ值范圍,考慮到血管緊張素Ⅱ與血壓調節有關,該患者平時血壓較高在 160/80 mm Hg左右,但從未查明原因及治療過,可能因此導致其血管緊張素Ⅱ數值較高異常,故剔除該患者的一組數據。A組術前、術中的血管緊張素Ⅱ值均高于B組(P<0.05);2組術后血管緊張素Ⅱ值差異無統計學意義。在A組中,術前血管緊張素Ⅱ值明顯高于術中及術后感染控制后的血管緊張素Ⅱ值(P<0.05);B組術中與術前相比血管緊張素Ⅱ值下降(P<0.05),術后與術前相比差異無統計學意義(P>0.05)。見表2。
2.3 術中不同時間點的MAP、CO、SVV值比較 在T1、T2、T3時間點,A組的MAP明顯低于B組(P<0.05);其他時間點無差異(P>0.05)。2組各時間點

表2 2組不同時間點的血管緊張素Ⅱ值比較
的CO、SVV指標差異均無統計學意義(P>0.05)。見表3。
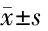
表3 不同時間點MAP、CO、SVV比較
2.4 術中心血管不良事件發生率及術后不良事件比較 2組患者術中發生的ACVE主要包括血流動力學波動劇烈、心肌缺血,無其他嚴重心血管不良事件的發生。A組ACVE發生率高于對照組(P<0.05)。通過30天隨訪,2組無1人發生急性譫妄、嚴重低血壓和術后心血管不良事件;B組中有1例患者術后2周突發暈厥,為貧血導致,還有1例患者術后仍存在感染,進行二次清創手術。而A組均無不良反應。見表4。

表4 2組心血管不良事件比較 例(%)
2.5 術前血管緊張素Ⅱ值對低血壓的預測 將組間比較有意義的客觀術前指標血管緊張素Ⅱ值、感染時間為自變量納入二元Logistic回歸。結果表明術前血管緊張素Ⅱ值(OR=0.955,95%CI 0.876~1.042,P=0.298)、感染時間(OR=1.024,95%CI 0.995~1.054,P=0.108)不是低血壓的危險因素(P>0.05)。ROC分析結果顯示,術前血管緊張素Ⅱ值為57.6 pg/ml時,約登指數最大,其敏感性為100%,特異性為66.7%,AUC曲線下面積為0.827,表明診斷有一定的準確性。見圖1。
3 討論
隨著近年來正中開胸心血管直視手術的逐漸普及,術后胸骨和縱隔感染的發病率也明顯增加,大多數患者常表現為Ⅱ型或Ⅲ型DSWI,這些患者圍術期死亡率大大增加[2]。手術清創是唯一治療手段,但手術中常常出現嚴重的低血壓甚至是血管擴張性休克。然而,手術室內的低血壓,即使是一過性的也會導致不良的后果[11,12]。Walsh等[13]研究表明術中短時間的低血壓也與急性腎損傷、心肌損傷或心臟并發癥及病死率風險顯著增加相關。對于因感染導致的血管擴張性休克患者,膿毒癥救治指南(SSC)推薦去甲腎上腺素為一線用藥[14],但后來許多研究發現大劑量的使用兒茶酚胺類藥也會增加內臟器官缺血壞死、增加心律失常的風險[15]。因此,如何預防術中低血壓,減少血管活性藥的使用,改善預后尤為重要。

圖1 血管緊張素Ⅱ值與術中低血壓的ROC曲線
當發生低血壓時,腎素-血管緊張素-醛固酮系統(RAAS)會被激活[16]。血管緊張素Ⅱ是發揮作用的最主要激素,對動脈血壓的急、慢性調節均起著關鍵作用。在一項預實驗中發現,在兒茶酚胺類和加壓素治療的基礎上加入人血管緊張素Ⅱ可以增加血管擴張性休克患者的MAP,從而減少兒茶酚胺的用量[17]。2017年Khanna等[7]發表的血管緊張素Ⅱ治療高輸出量休克(ATHOS-3)3期試驗表明血管緊張素Ⅱ可顯著增加對高劑量兒茶酚胺類血管加壓藥無反應的血管擴張性休克患者的血壓。血管緊張素Ⅱ在感染性休克患者體內如何改變一直存在爭議,有研究認為,在膿毒癥期間,內皮功能障礙會降低ACE活性,從而降低血管緊張素Ⅱ水平[18]。但也有研究表明,膿毒癥可能會導致RAAS的高表達促進血管緊張素Ⅱ分泌,血管緊張素Ⅱ可以促進促炎細胞因子和趨化因子的合成,加重炎癥反應,增加活性氧的產生[8]。Kienbaum等[9]的研究顯示當人體發生全身炎癥反應綜合征時,腎素-血管緊張素系統(RAS)會顯著激活來維持容量和血管張力。還有一些早期研究認為血管緊張素Ⅱ的表達水平可能因階段而異[19]。基于這些研究,可以考慮慢性DSWI患者體內血管緊張素Ⅱ值可能也存在改變,故本研究采用前瞻性隊列研究的方法,研究ATII與DSWI患者之間的關系,探索其對術中低血壓的預警作用。
本研究結果發現2組患者術前血管緊張素Ⅱ值均在正常范圍內,但低血壓患者的血管緊張素Ⅱ值明顯高于對照組,且其感染時長大部分在3個月以內,明顯短于對照組,這可能表明在慢性感染的早期,機體RAAS處于激活的狀態,導致血管緊張素Ⅱ水平偏高。而Bucher等[20]發現在膿毒癥模型中,腎上腺ATR的表達水平較低,使血管緊張素Ⅱ對腎上腺的刺激減低,從而導致兒茶酚胺的釋放減少,誘發了敗血癥休克。基于這些研究,或許可以解釋血管緊張素Ⅱ值較高患者為何容易出現低血壓。原因可能為低血壓組患者體內ATR受體表達降低,機體對血管緊張素Ⅱ的反應性和敏感性降低,因此機體需要更高的血管緊張素Ⅱ水平與其結合來維持容量和血管張力,使血壓維持在正常范圍。同時,麻醉藥物可抑制RAAS的激活[21],麻醉后,機體激活的RAAS被抑制,血管緊張素Ⅱ濃度下降,血管張力下降加上麻醉藥本身的擴血管作用,使其表現為嚴重的低血壓。而對照組患者機體RAAS并未代償,則不會出現明顯的麻醉后嚴重低血壓。
本研究發現低血壓組患者術中ACVE發生率高于對照組,這與前人研究結果[13]一致,但術后30 d內隨訪發現2組死亡率和不良反應無差別,可能因為本研究中定義的低血壓并非是嚴格意義上的兒茶酚胺抵抗性休克(即血管擴張性休克)。本研究結果表明,術前血管緊張素Ⅱ值、感染時間均不是術中低血壓的危險因素,但2組術前血管緊張素Ⅱ值卻存在著統計學差異。通過ROC分析,可以得出低血壓組患者血管緊張素Ⅱ的cut-off值為57.6 pg/ml,此時的敏感度為100%,特異度為66.7%,AUC曲線下面積為0.827,表明診斷有一定的準確性。由于本研究的樣本量較小,不可避免的會出現偏倚風險,隨著后期樣本量的增加,術前血管緊張素Ⅱ值可能會是術中低血壓的危險因素,ROC曲線得出的臨界值也會更加準確。

