SGK1調控NF-κB通路影響宮頸癌細胞增殖和凋亡的機制研究
祁海云 王榮蘭 聶偉
宮頸癌是女性中第四大最常見的癌癥,也是全世界最致命的婦科惡性腫瘤之一[1]。在全球范圍內,宮頸癌的死亡率和發病率越來越高,并且已嚴重影響女性的健康和生命[2]。目前外科手術、放射療法和化學療法用于宮頸癌的治療,但是由于大多數患者確診時已處于晚期,治療效果十分有限[3]。此外,放射療法或化學療法不僅殺傷癌細胞,而且對正常細胞也存在毒性作用。因此,這些療法會降低治療效果并經常引起嚴重的不良反應[4]。因此,迫切需要開發用于晚期宮頸癌的新型有效的治療策略。血清和糖皮質激素調節激酶1(serum and glucocorticoid-induced kinase 1,SGK1)屬于SGK家族,在多種生理病理過程中發揮作用[5]。SGK1能夠調控多種信號轉導途徑調節細胞增殖、分化、存活和凋亡[6,7]。目前研究發現,SGK1在多種腫瘤如結直腸癌、卵巢癌和前列腺癌等中呈高表達,促進腫瘤的生長和進展[8]。然而,SGK1在宮頸癌中的功能及作用機制尚不完全明確。對與細胞增殖和凋亡相關的信號通路的研究有助于探究癌癥的主要機制,從而找到預期的治療靶點。越來越多的證據表明NF-κB信號傳導途徑參與了宮頸癌細胞的啟動和發展[9]。因此,本實驗旨在探究SGK1在宮頸癌中的表達及其對宮頸癌細胞增殖和凋亡的影響,并初步研究其作用機制。
1 材料與方法
1.1 標本采集 組織標本選取2018年6月至2020年1月青海省婦幼保健院收治行手術治療的宮頸癌患者,標本采集前患者均未接受化療、放療和激素治療,患者經病理確診為宮頸癌且適合手術治療,20例標本均于全子宮切除術中取得,另取同期20例正常宮頸組織為對照。所有標本采集經患者及家屬知情同意,本研究經醫院倫理會批準。
1.2 細胞株與主要試劑 人宮頸癌細胞株Caski(美國ATCC公司);RPMI 1640培養基(美國Sigma公司);胎牛血清(美國Invitrogen公司);MTT試劑、NF-κB信號通路激活劑PMA(武漢博士德生物工程有限公司);AnnexinⅤ-FITC/PI細胞凋亡檢測試劑盒(北京四正柏生物科技有限公司);全蛋白提取試劑盒(南京凱基生物公司);SGK1、NF-κB和IκBα單抗(美國Acbam公司);SGK1抑制劑GSK650394、辣根過氧化物酶標記的二抗、BCA蛋白檢測試劑盒、ECL化學發光試劑(碧云天生物技術研究所)。
1.3 細胞體外培養 人宮頸癌細胞Caski常規復蘇后接種到細胞培養瓶中,內含10%胎牛血清、100 U/ml青霉素-鏈霉素雙抗的RPMI 1640培養基,將細胞培養瓶放置在37℃、5% CO2、飽和濕度的培養箱中培養,隔天更換新的培養液,待細胞貼壁生長呈單層匯合時,使用0.25%胰蛋白酶消化細胞并進行傳代培養。取處于對數增殖期的Caski細胞用于后續實驗。
1.4 實驗分組 對數生長期的Caski細胞分為Control組、GSK組和GSK+PMA組,其中GSK組Caski細胞以20 μmol/L SGK1抑制劑GSK650394(參照前期基礎研究濃度)干預24 h,GSK+PMA組Caski細胞以20 μmol/L SGK1抑制劑GSK650394和1 μmol/L NF-κB信號通路激活劑PMA干預24 h,Control組Caski細胞添加等量PBS作為對照。
1.5 MTT實驗 對數生長期的Caski細胞接種到96孔板中,接種密度為2×103個/孔,放置在37℃培養箱過夜培養,待細胞生長匯合至50%以上時,按照1.4分為對照組和試驗組,分別于處理12、24、48 h時行MTT檢測,即在12、24、48 h時向每孔細胞中添加濃度為5 mg/ml的MTT試劑0 μl,放置在常規培養箱培養4 h,取出細胞,除去細胞上清培養液,再向細胞中加入二甲基亞砜溶液150 μl,振蕩10 min,待底部結晶完全溶解后采用全自動酶標儀測定各孔細胞的光密度值(OD值),檢測波長設為570 nm,以OD值的大小反映細胞增殖活力的高低。實驗重復3次,取均值。
1.6 流式細胞術檢測 對數期的Caski細胞以1×104個/孔接種到6孔板中,待細胞生長至單層融合時按照上述1.4方法分組和處理24 h,采用胰酶消化各組Caski細胞,收集細胞并以PBS洗滌細胞3次,加入400 μl Binding Buffer重懸細胞制成單細胞懸液,向細胞懸液中添加AnnexinⅤ-FITC 5 μl,混勻后加入PI染液5 μl,輕輕混勻,放置在室溫下避光孵育15 min,向細胞懸液中補充100 μl Binding Buffer,采用流式細胞儀檢測,分析各組Caski細胞凋亡情況。實驗重復3次,取均值。
1.7 Western blot實驗 宮頸癌Caski細胞同1.4分組處理24 h后,收集各組Caski細胞以及人正常宮頸組織和宮頸癌組織標本,使用全蛋白提取試劑盒提取總蛋白。采用BCA法對總蛋白進行定量檢測,在蛋白樣品中加入適量上樣緩沖液,沸水浴致蛋白質變性。每個泳道孔添加等量變性蛋白樣品,進行SDS-PAGE(12%分離膠和5%濃縮膠)電泳,采用半干法進行轉膜,并將硝酸纖維素膜置于含5%脫脂奶粉的封閉液室內,室溫封阻1 h,加入稀釋的相應一抗(SGK1、NF-κB和IκBα一抗均為1∶500稀釋),4℃雜交過夜,次日洗膜后添加1∶2 000稀釋的二抗,室溫雜交2 h,洗膜,采用ECL化學發光試劑進行顯影,采集圖像,以β-actin為內參,使用Image J軟件分析目的蛋白和內參蛋白條帶灰度值,以目的蛋白和內參蛋白條帶灰度值的比值表示各組Caski細胞中目的蛋白相對表達水平。實驗重復3次,取均值。
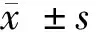
2 結果
2.1 SGK1在宮頸癌組織中呈高表達 Western blot分析SGK1蛋白在人正常宮頸組織和宮頸癌組織中的表達情況,結果顯示,SGK1蛋白在宮頸癌組織中的表達顯著高于正常宮頸組織(P<0.05)。見圖1,表1。

圖1 Western blot分析SGK1蛋白在人正常宮頸組織和宮頸癌組織中的表達

表1 SGK1蛋白在人正常宮頸組織和宮頸癌組織中的表達水平比較
2.2 3組Caski細胞中SGK1蛋白表達水平比較 Western blot檢測各組Caski細胞中SGK1蛋白表達情況,結果顯示,與Control組相比,GSK組Caski細胞中SGK1蛋白表達水平明顯下調(P<0.05),與GSK組相比,GSK+PMA組Caski細胞中SGK1蛋白表達水平明顯上調(P<0.05)。見圖2,表2。

圖2 Western blot檢測3組Caski細胞中SGK1蛋白表達

表2 SGK1蛋白在3組Caski細胞中的表達水平比較
2.3 3組Caski細胞增殖能力比較 MTT實驗檢測3組Caski細胞增殖活力,結果顯示,與Control組相比,GSK組Caski細胞在24和48 h時OD值均降低(P<0.05),與GSK組相比,GSK+PMA組Caski細胞在24和48 h時OD值均升高(P<0.05),3組Caski細胞在12 h時OD值差異不顯著(P>0.05)。見表3。

表3 3組Caski細胞在12、24和48 h時OD值比較
2.4 3組Caski細胞凋亡率比較 流式細胞術檢測3組Caski細胞凋亡率,結果顯示,與Control組相比,GSK組Caski細胞凋亡率明顯升高(P<0.05),與GSK組相比,GSK+PMA組Caski細胞凋亡率明顯降低(P<0.05)。見圖3,表4。

圖3 流式細胞術檢測各組Caski細胞凋亡率

表4 3組Caski細胞凋亡率比較
2.5 3組Caski細胞中NF-κB和IκBα表達水平比較 Western blot分析各組Caski細胞中NF-κB和IκBα的表達水平,結果顯示,與Control組相比,GSK組Caski細胞中NF-κB和IκBα的表達水平明顯升高(P<0.05),與GSK組相比,GSK+PMA組Caski細胞中NF-κB和IκBα的表達水平明顯降低(P<0.05)。見圖4,表5。

圖4 Western blot分析3組Caski細胞中NF-κB和IκBα的表達水平

表5 3組Caski細胞中NF-κB和IκBα的表達水平比較
3 討論
宮頸癌是導致全球健康問題的重要原因,尤其是對于女性而言。有數據顯示,隨著生活壓力的增加,宮頸癌的發病率已大大提高,并呈現年輕化趨勢[10]。目前尚缺乏高效的宮頸癌治療策略,并且還存在各種各樣的副作用。因此,迫切需要尋找新的治療靶標以抑制宮頸癌發病率的上升。越來越多的證據表明SGK1是一種應激誘導的生存因子,并且在生理病理條件下(例如生長因子、糖皮質激素、細胞因子和各種細胞應激)可迅速誘導SGK1的表達[11]。同時,SGK1可促進人類多種類型的惡性腫瘤的細胞存活,減少細胞凋亡。例如,Pan等人研究顯示,與鄰近的正常組織相比,在肺腺癌組織的中檢測到SGK1蛋白表達水平顯著升高,且抑制SGK1的表達可通過阻滯細胞周期至G2/M期抑制肺腺癌細胞的增殖[12]。藜蘆醇在體外培養的細胞內可抑制SGK1的表達,進而影響人肝癌HUH7細胞的增殖和存活[13]。在卵巢癌中,SGK1抑制劑SI113能夠抑制癌細胞A2780增殖,增強基于紫杉醇的化療作用,抵消紫杉醇耐藥性的發展并恢復對紫杉醇耐藥的敏感性[14]。最近研究發現,在宮頸癌中抑制SGK1能夠降低褪黑激素的抗氧化能力,導致ROS過度積累,從而增強宮頸癌細胞的細胞毒性[15]。然而,SGK1在宮頸癌組織中的表達情況及對宮頸癌細胞增殖和凋亡的影響及機制尚不清楚,基于此開展了本實驗。本實驗結果顯示,SGK1蛋白在宮頸癌患者組織中表達異常升高,提示SGK1在宮頸癌中可能起促癌作用。此外,SGK1抑制劑GSK650394處理的宮頸癌Caski細胞中SGK1蛋白表達明顯下調,SGK1蛋白下調能夠抑制Caski細胞增殖能力,促進Caski細胞凋亡。提示SGK1蛋白在宮頸癌的惡性進展中發揮重要作用。
眾所周知,NF-κB信號通路與多種細胞功能有關[16]。在靜息狀態下,NF-κB位于細胞質中,并與保護核定位信號的抑制蛋白IκB結合形成復合物,當細胞受到外界刺激后,包漿內IKK被激活使得IκB激酶IKK-α活化解離出NF-κB,隨后NF-κB轉位至細胞核發揮調控作用。多項研究表明,NF-κB信號傳導途徑在多種癌癥類型中被激活[17-19]。例如NF-κB信號通路的異常激活與宮頸癌的進展以及預后不良密切相關[20]。NF-κB信號通路在細胞凋亡中起著重要作用,此外,有人指出活化的NF-κB促進細胞增殖,存活和血管生成[21]。本實驗中,施加SGK1抑制劑能夠明顯抑制NF-κB和IκBα的表達,表明抑制SGK1蛋白能夠阻斷NF-κB信號通路的激活。提示SGK1對宮頸癌細胞增殖和凋亡的調控作用可能與阻斷NF-κB信號通路的激活有關。本實驗使用NF-κB信號通路激活劑PMA與SGK1抑制劑GSK650394共同處理人宮頸癌Caski細胞,結果發現PMA能夠逆轉GSK650394對Caski細胞增殖抑制和凋亡誘導的作用。這些實驗結果表明,下調SGK1通過抑制NF-κB活性來阻斷子宮頸癌細胞的增殖并刺激細胞凋亡。
綜上,本研究發現SGK1蛋白在宮頸癌組織中異常高表達,功能實驗結果顯示,抑制SGK1能夠阻礙宮頸癌細胞增殖并誘導細胞凋亡,其作用機制可能與阻斷NF-κB信號通路有關。隨著對SGK1蛋白研究的深入,SGK1有望成為宮頸癌診斷和預后的標志分子。

