骨代謝標志物在骨質疏松中的應用進展
王健 廖燚 袁鋒
骨質疏松癥是骨骼代謝最常見的疾病,約有1/2的女性和1/5的男性預期會在一生中經歷一次骨質疏松性骨折[1]。女性一生的骨質疏松性骨折的發病率和死亡率很高,其髖部骨折死亡的風險大致相當于乳腺癌。由于這些嚴重的臨床后果,骨質疏松癥的診斷、治療和監測至關重要。在這方面的主要挑戰是骨質疏松在出現骨折前無癥狀;對于其臨床診斷和后續治療主要依靠放射學,并根據臨床病史和人口學的情況對有風險的患者進行實驗室檢測[2]。骨質疏松癥的發病機制是破骨細胞吸收骨骼的能力與成骨細胞形成骨骼的能力不平衡造成的,這種失衡多發生于具備骨質疏松癥的臨床風險因素的患者中。這些危險因素包括更年期婦女、高齡、糖皮質激素的使用以及其他內分泌疾病如甲狀腺功能亢進或甲狀旁腺功能亢進,或其他慢性全身性炎癥。雖然放射學檢測技術仍然是診斷骨質疏松癥的主要手段,但其已被證明只能預測一部分骨折風險[1,2]。此外,放射學檢測的骨量變化可能滯后人們希望可以發現骨骼生理變化數月甚至落后1年[3]。由于骨質疏松癥直接來自于成骨細胞和破骨細胞的數量及其活動變化的結果,隨之而來的是這些細胞活性的生物標志物反映了當前的骨轉換水平,這就是骨代謝標志物(bone turnover marker,BTM)。他們可能還會提供對總骨量的放射學評估以外的其他信息,這是因為骨質疏松的患者在低的骨轉換水平具有與高的骨轉換水平不相同的生物物理特性和骨折的風險。
1 骨代謝標志物分骨形成標志物及骨吸收標志物
首先可以歸類為反映骨骼吸收的指標及形成的指標,然后進一步分類為進入骨吸收或形成過程中釋放的基質產物或以破骨細胞或成骨細胞的數量或活性相稱的水平直接分泌到循環中的細胞產物(圖1)。
1.1 I型C端和N端端肽膠原 I型膠原蛋白是最豐富的蛋白質成分。骨的I型C端和N端端肽膠原蛋白(CTX和NTX)都是I型片段來自三肽的端肽區域的膠原蛋白成熟膠原蛋白末端附近的部分破骨細胞吸收
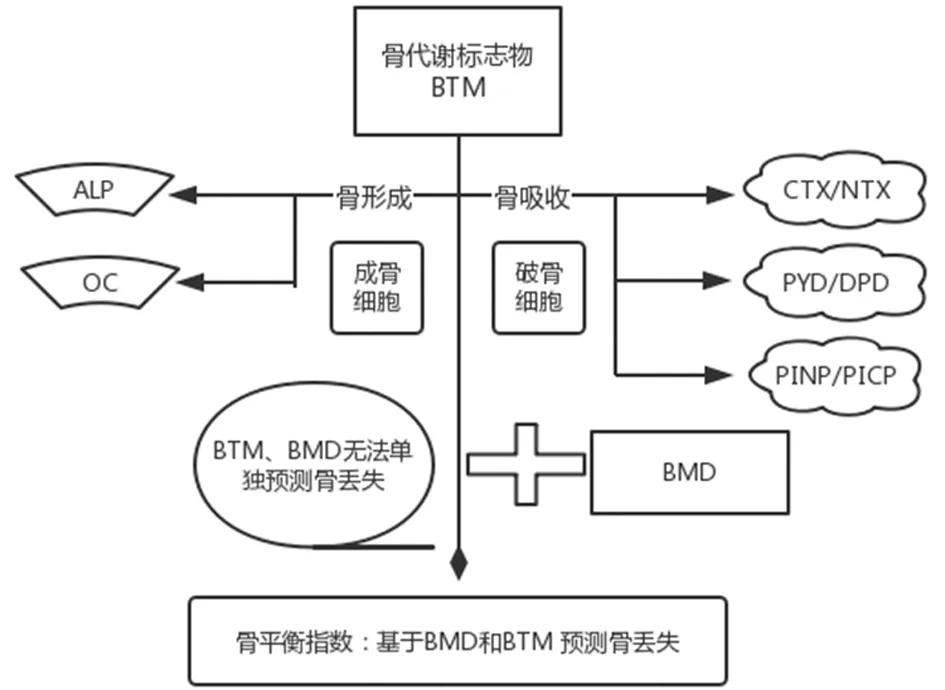
圖1 骨代謝標志物產生及其在骨量評價中作用
過程中裂解端肽。在骨質,它們釋放進入循環速率與骨吸收活性成正比。CTX是組織蛋白酶K介導的骨吸收的特定產物,代表了組織蛋白酶K對骨的直接代謝導致CTX釋放,但不是替代骨分解代謝酶,例如基質金屬蛋白酶teinases[4]。相反,另一個BTM,I型C末端交聯的端肽基質金屬蛋白酶釋放膠原蛋白(ICTP)或胰蛋白酶也是骨骼消化的產物。ICTP對骨吸收的反映,在實質性的骨腫瘤中的響應速度比在絕經后骨質疏松癥要更加靈敏中。但是,ICTP因為它只能手動RIA,因此他的臨床應用受到限制,因此在此不再贅述。
雖然α1型膠原肽鏈與α2型膠原肽鏈交織在一起,NTX檢測也可以識別α2型膠原鏈的N端端肽的肽鏈。值得注意的是,CTX八肽還包含一個從新合成形式逐漸轉變為異構化和種族化的天冬氨酰(CTX)隨時間變化為的異構形式。到期到交聯形成賴氨酸的存在CTX肽,它們以單體形式存在(αCTX和βCTX)和二聚體(α-αCTX,α-βCTX,和β-βCTX)。αCTX相對于βCTX可以提供有關膠原蛋白沉積與吸收之間的效能,但還需要進一步驗證才能確定該比率的潛在臨床效用[5]。CTX分析可以顯示出不同程度的αCTX和βCTX和各種CTX二聚體,其中大多數CrossLaps認可的檢測方法主要是β-βCTX,而Alpha CTX分析可以識別α-αCTX。
通常,CTX和NTX分析顯示出大致相似的臨床效用和測試特征[6]。CTX和NTX足夠小,可以腎臟清除,因此血清/血漿和尿液的樣本都可以用來檢測。在臨床實踐中,CTX最常在血清中進行分析,而NTX通常在尿液中運行。盡管許多參考實驗室都可以使用血清NTX測定,但檢查樣本選擇尿液相對于血清對于NTX來說在抗吸收治療方面顯示出較小的變化[7]。
1.2 吡啶啉和脫氧吡啶啉 骨骼中的I型膠原蛋白顯示出廣泛的網絡共價交聯有助于評估骨骼的整體生物力學特性。吡啶啉(PYD)和脫氧吡啶并啉(DPD)是特定的交聯PYD在端肽區域中賴氨酸或羥賴氨酸殘基之間的結構性膠原蛋白中形成,在膠原蛋白三螺旋中具有特定位點具有2種形式,由3個羥基賴氨酸殘基形成的羥基糖基PYD和衍生自1個賴氨酸和2個羥基賴氨酸殘基。羥賴氨酸是由賴氨酰羥化酶[賴氨酸原膠原,2-氧戊二酸5-雙加氧酶1(PLOD1)]的作用形成,在Ⅵ型Ehlers-Danlos綜合征中有缺陷。因此,在Ⅵ型Ehlers-Danlos綜合征可降低羥基賴氨酸PYD與賴氨酰基PYD的比例,用作診斷Ⅵ型的輔助證據埃勒斯-丹羅斯綜合征[8]。而PYD位于DPD主要在骨骼中發現,包括骨骼和軟骨在內,因此被認為可以成為骨轉換的更具體標志。PYD和DPD在骨骼吸收后釋放,隨后通過腎臟清除[9]。尿液中約有30%~50%的PYD是以游離形式存在,其余與肽結合或更大的蛋白質復合物[10]。自由物種是假設是從骨骼釋放后肽結合的PYD的代謝形成的[11]。PYD具體是通過HPLC檢測其天然熒光定量或通過ELISA檢測,取決于與游離總和酸水解是否進行分析以及分析肽結合的片段[12]。
1.3 Ⅰ型N和C末端前肽膠原 成骨細胞分泌Ⅰ型膠原蛋白為完整分子包含N和C端前肽隨后在細胞外空間分裂。因此,Ⅰ型膠原的N和C末端前肽(PINP和PICP)水平是成骨細胞的Ⅰ型膠原蛋白分泌的標志物。PINP和PICP作為分析物具有都相似特性,但是PINP已得到更廣泛的研究,因此將成為此處考慮的重點。PINP最初是作為Ⅰ型膠原蛋白的3條蛋白質鏈中的前肽并隨后轉化為單體形式循環。因此,化驗可同時測量單體和三聚體PINP(總PINP)或僅測量三聚體PINP(完整PINP)。三聚體PINP通過清除劑受體的攝取被清除,而單體PINP主要在腎臟清除。因此,完整而完整的PINP顯示良好與健康對照的相關性,血液透析患者的總PINP濃度大大增加是由于單體PINP的清除受損[13]。
1.4 骨特異性堿性磷酸酶 測量總堿性磷酸酶(ALP)水平可以通過酶活性可以顯示出骨重塑活動的程度,尤其是在骨轉換嚴重紊亂的情況下,例如骨Paget病,在這種情況下,總ALP的效用因總代表4種ALP基因產物的ALP活性[堿性磷酸酶、腸(ALPI),堿性磷酸酶、肝/骨/腎(ALPL),堿性磷酸酶、胎盤(ALPP),堿性磷酸酶、胎盤像2(ALPPL2)]。堿性磷酸酶的每一種亞型對標不同的組織特異性疾病過程的反應。其中,只有骨骼特異性ALPL基因的亞型反映了骨合成代謝活性,因為它成骨細胞以特定方式直接釋放到循環中與數量和微分狀態成比例[14]。歷史上有很多確定同工型特異性ALP水平的方法或為了監測骨代謝活性,目前優選使用特異性識別骨特異性ALP(骨ALP)的免疫測定法。重要的是,當前可用于骨ALP的免疫測定法未顯示出完全的特異性,仍顯示出與肝臟ALP的一定程度的交叉反應性。因此,骨ALP增加需謹慎解釋,需關注患有肝病的患者血脂水平。骨ALP表達是在間充質祖細胞分化成骨細胞的早期獲得的,骨ALP本身是天然的焦磷酸礦化抑制劑,如因突變導致的佝僂病樣的低磷血癥患者潛在的嚴重骨骼疾病不適于使用ALPL檢測。
1.5 骨鈣素 骨鈣素(OC)是49個氨基酸,與鈣結合最成熟的成骨細胞分泌的多肽骨骼中發現豐富的非膠原蛋白。OC有最近重新引起人們的廣泛關注是因為基礎和翻譯骨骼生物學的發現,因為它可作為骨源激素起作用,影響男性生育力,葡萄糖穩態,中樞神經系統直接影響的行為以及肌肉在小鼠中的功能[15-17]。成骨細胞分泌的大多數OC被摻入有機基質中,后來骨化成骨頭,但是有一小部分被分泌出來進入流通。因此,OC被廣泛認為是骨形成標記,實際上,OC濃度與直接測量骨骼有關通過組織形態計量學形成[18]。但是,OC摻入有機骨基質中的部分在破骨細胞吸收過程中可被釋放。因此,骨吸收可直接影響血清OC濃度,盡管這種作用的實際意義尚不清楚。OC還含有3種谷氨酸(氨基酸13、17和20)經歷了維生素K依賴的羧基化,增加OC對羥基磷灰石的親和力[19]。與此一致依賴于維生素K的翻譯后加工,用維生素K拮抗劑(如華法令)治療,會增加未羧基化或羧基化OC的相對量,并可能降低血清總OC濃度[20]。一部分OC隨后經歷脫羧,只有未羧化的OC能夠調節葡萄糖穩態[21]。臨床應用一直很感興趣測量未羧基化的OC,具有尚未作為臨床檢測方法實施研究環境。
值得注意的是,由于OC不穩定,用于OC測量的樣品具有特殊的收集和運輸要求。建議將樣品保持在4℃附近,并在收集后4 h內進行處理。始終觀察到樣品溶血以減少OC,可能是通過提高OC降解水平而達到的。OC的這種不穩定性主要是不穩定的6-氨基、酸性C端序列的特性,分析缺少該序列的更穩定的片段,即N-Mid-OC片段(第1~43位氨基酸)已在臨床上發現了實用性完整OC的測量[22]。
2 測量BTM中的分析前因素
只要BTM提供了對骨轉換的綜合系統性測量,影響因素的分析前因素收集時的骨轉換會影響他們的濃度。這些預分析因素可以分為可控因素,例如季節性或晝夜變化,以及不可控因素,包括人口統計變量,例如年齡和性別。骨吸收之間可控因素,顯示顯著晝夜節律變化,血清CTX,NTX和OC濃度在凌晨至午夜之間達到峰值(23點)[23]。這個晝夜節律大多數BTM通常都能觀察到這種作用CTX在晝夜節律變化中顯示出最高幅度[24]。此外,絕經前女性耦合程度表現出最大的差異的季節變化發生骨重塑的峰值在冬季[25]。餐后骨吸收水平下降,這也是導致骨吸收增加的重要原因。CTX在清晨產生,這通常是每天禁食時間最長的時間。餐后骨骼重塑下降由于胃腸激素的作用,例如胰高血糖素樣肽2,會減少骨吸收[26]。因此,建議早上在空腹時抽血測量血清CTX,以增加測量的準確性。骨形成標記似乎較少受這些因素影響[27]。觀察到運動會導致體內BTM濃度的急劇變化,因此建議您進行運動抽樣前要避免48 h[28]。吸煙習慣、較低的BMI也會影響到基礎的BTM濃度[29]。骨轉換率也隨著月經周期而變化,在月經的中后期增加,卵泡期和黃體中期下降[30]。因此,絕經前女性的理想做法是在月經周期的卵泡期獲得在BTM濃度中一致的基線。
除了這些影響骨轉換的因素之外,影響BTM清除率的患者因素也將影響測量結果。最值得注意的是,CTX,NTX,單體PINP和OC顯示出腎臟清除率的功能,并且會隨著腎功能不全通常會增加[34]。抗酒石酸酸性磷酸酶(TRAP),一種破骨細胞分泌的酶,與骨吸收活動有關,是少數幾個不通過腎臟清除的分解代謝的BTM之一,因此可以在腎功能不全的患者中使用。但是,與CTX或NTX相比,預測斷裂骨折風險的一般能力較差,限制了TRAP分析的實用性[32]。專門測量破骨細胞衍生的TRAP同工型TRAP5b,而不是所有血清TRAP活性[33]。對于合成代謝BTM,骨ALP不通過腎臟清除,在腎功能不全的情況,可能會改善這些局限性[34]。大多數BTM是存在于非骨骼組織的Ⅰ型膠原中或其他涉及基質重塑的疾病過程的組織,例如全身性硬化癥,充血性心力衰竭,或擴張型心肌病已顯示出增加BTM濃度[35-37]。人口因素是不可控制的BTM中的分析前變異。20多歲和30多歲的男人通常比女性顯示較高的BTM基礎濃度[38,39]。但是,在50歲以后,情況正好相反,因為隨年齡增長女性的基線水平顯示出更快的吸收,最可能與更年期過渡相關[40]。作為BTM濃度反映可用的骨重塑的表面總面積和在這些部位中相對重塑活性,年輕人相對更多的BTM基線濃度是因為其骨骼質量的更大。在成長中的孩子大大提高了形成和吸收標記物可以被檢出,與身高變化呈現正相關性,在青春期達到頂峰[41]。與DPD相比,CTX或NTX的青春期高峰更為明顯,可以觀察到DPD濃度增加直到青春期未出現下降[42]。成年后,BTM在此期間傾向于保持較低的基礎水平,直到女性絕經后其濃度增加。這些人口統計因素對BTM的影響水平突出了產生參考的挑戰是年齡和性別類別之間的間隔,尤其是BTM的許多標準基于年輕女性形成。人口因素對骨代謝的影響的研究較少,包括男性、兒童的可用數據較少,無法用于建立參考依據[43]。在確定骨骼質量時最常用的雙能X射線吸收法(DXA),通常主要是比較患者的值不是參考的年齡和性別匹配的參考區間(稱為Z得分),而是引用性別匹配的是與健康的年輕人參考區間(T評分)。理由是骨量決定骨折風險的因素,而不是看患者的骨量是否在參考年齡的骨量范圍內。類似的考慮也可能會擴展到BTM標記,因為有人建議35~45歲女性參考間隔從各個年齡段的BTM中的相對最低點得出[29]。
3 BTM的應用
大多數骨質疏松性骨折不發生在骨礦物質密度(BMD)測試為骨質疏松的個體中,而是發生在骨量減少的患者中。骨質疏松癥患者(DXA的BMD T評分1~2.5掃描)的個人骨折風險低于骨質疏松癥患者(T評分2.5),骨量減少的患者的數量較大,這意味著大多數骨折將在骨量減少的人群中發生[44]。
因此,由于骨折發生率相對較低,然而可能發病的人群卻又比較巨大,因而迫切輔助工具預測骨折風險以及識別最能從骨質疏松癥藥物治療中受益的人。解決此問題的一種方法是應用先進的射線照相技術,例如DXA衍生的小梁骨評分和高分辨率外周定量計算機斷層掃描,以提供更多的風險分層數據[45,46]。BTM的測量方法已被研究為另一種解決此問題的潛在方法。在這里,我們將總結BTM在臨床骨質疏松癥管理中的效用,主要集中在絕經后骨質疏松癥。
3.1 使用BTM預測骨丟失 由于在體內測量總骨量反映了活動的破骨細胞和成骨細胞這些細胞譜系的活性的平衡,更年期期間的骨的流失迅速增加[47]。由于骨吸收和形成是通常相伴的,成骨細胞活動指數增加通常伴隨著破骨細胞的骨吸收的增加。多項研究調查了BTM,更年期狀態和伴隨的破骨細胞引起的骨質流失。總體而言,雖然建立了絕經前BTM水平與隨后的骨質流失明確的關系,老年女性的BTM水平與隨后的骨質流失之間的關聯明顯較少。因此,合理的認識明顯改變的BTM水平與老年人的骨質的加速流失是比較合理的[2]。
目前,大多數女性在絕經期還沒有系統地經過骨質疏松的篩查。因此,納入常規監測BTM進入臨床實踐以識別“骨質流失”,他們可能會繼續發展成骨質疏松癥,這提出了嚴峻的挑戰。在評估此類篩查的有效性和成本效益的前瞻性隨機臨床試驗缺乏的情況下,目前不建議使用BTM作為一項公共衛生措施以識別患者快速骨質流失的風險[48]。
一種增加BTM實用性的方法預測骨丟失是基于以下觀察,骨量反映了骨形成的數量減去吸收的數量。因此,理想情況下,骨形成和骨吸收BTM將是合并成一個反映凈骨量的丟失,將BTM測量值與骨組織的改變聯系起來是一個挑戰,骨平衡指數是解決這一問題的創造性方法,并基于回歸確定相對患者隊列中OC與尿液NTX的含量骨量穩定。然后,對患者進行評估相對于此回歸標準來確定是否NTX相對于OC的數量高于或低于預期對應于穩定骨量的量。初步驗證表明,骨平衡指數可能是預測骨質流失的有用方法,但是,需要進行研究以進一步了解該方法的適用性[49]。
3.2 使用BTM預測骨折風險 鑒于骨密度不能完全預測骨折的風險,已經進行了許多研究來確定相伴的BTM濃度與隨后的骨折風險。明顯地,必須區分的是BTM預測骨丟失和骨折的能力的不同,如上所述,他們具有預測骨折風險的能力,由于人口統計學,臨床和骨骼微體系結構因素的不同,在給定的整體骨量水平下,因為患者的骨折風險可能明顯不同。總體而言,前瞻性研究分析骨形成標記與后續骨形成標記之間的關系骨折風險未能顯示出明顯的合成代謝效用的BTM[2]。
相反,多個研究表明,骨骼標志物的增加吸收可預測隨后的脆性骨折[50]。有趣的是,初次測定后5年,在長期隨訪研究中未檢測到這種關聯增加骨吸收標記與骨折風險的增加[51]。值得注意的是,合并癥可能會改變BTM與BMD測量之間的關系以預測骨折風險。如研究最多的例子之一,BMD測量低估了糖尿病患者的骨折風險[52]。因此,如何最好地應用BTM進行估算糖尿病患者的骨折風險應積極進一步研究。盡管這些發現將重吸收性BTM的濃度增加和骨折風險聯系在一起,但幾乎沒有數據關于這種測量在日常中的實用性臨床實踐。ROC分析未能證明低BMD和高BMD相結合BTM檢測到的女性發生骨折風險的風險比低風險高[53]。
總之,在所有人群中,雖然BTM是流行病學家研究骨折風險的強大工具,目前的證據不足以建議其常規使用來識別患者中誰將從骨質疏松癥藥物聯合療法中獲得最佳利益。但是,應該區分患有“繼發性”骨質流失的患者,例如甲狀旁腺功能亢進,甲狀腺功能亢進,維生素D缺乏和超蛋白血癥,因為BTM可能在這些方面區分出高風險的患者亞群。此外,由于未滿足降低發病率和死亡率的臨床需求,正在積極推動骨質疏松性骨折的研究來最好地將BTM應用于日常監控骨折風險,BTM在該領域的新應用將來可能會出現。見圖2。
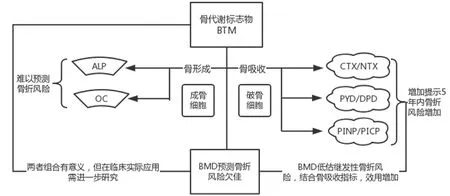
圖2 BTM預測骨折的價值
3.3 使用BTM監測骨質疏松癥 與BTM用于確定有快速骨丟失風險患者的作用有限相反,將BTM應用于指導骨質疏松癥的治療具有更大的效用。BTM響應的變化模式治療方法已有很好的描述,這些變化已經用于預測骨密度的增加和減少骨折風險的治療效果。
3.4 治療效果 抗吸收劑直接抑制骨質破骨細胞的骨吸收,在骨吸收標記中,因此導致相對較快的減少抑制程度。骨吸收隨每種抗吸收劑的不同而不同,具體取決于劑量和作用機制。這種抑制骨吸收導致骨減少由于連接破骨細胞和成骨細胞活性的生理機制,形成標記。作為其中的一些破骨細胞直接介導偶聯作用,破骨細胞是抑制破骨細胞吸收能力同時保留破骨細胞的抗吸收劑,與減少破骨細胞的藥物相比,對骨形成的影響較小。例如,組織蛋白酶K的抑制劑(屬于傳統的抗吸收劑)可降低CTX的水平[54]。但是,作為組織蛋白酶K的抑制劑卻沒有影響破骨細胞的數量,現有的破骨細胞仍然能夠刺激成骨細胞的募集和分化。因此,使用鈣蛋白酶K抑制劑的骨形成標志物的減少少于雙膦酸鹽和地諾單抗可以阻止破骨細胞分化或殺死活性破骨細胞的減少[55,56]。破骨細胞和成骨細胞之間的這種聯系可以也有相反的作用,焦油使成骨細胞影響破骨細胞對骨的吸收。重組人甲狀旁腺激素(PTH)1-34(特立帕肽)的典型特征是合成代謝劑,導致骨骼的骨化和吸收標記物增加[54]。抗硬化素單克隆抗體,一種正在研究的合成代謝藥物,還導致骨的劑量依賴性增加形成標記,但與特立帕肽不同,血清CTX降低[57]。
4 臨床結果
骨質疏松癥治療開始后早期的BTM預測BMD變化。特立帕肽誘導后的第18個月和第24個月的脊柱和髖部BMD變化與基線濃度PINP與正相關[58,59]。應用特立帕肽后PINP在第1個月和第3個月的早期增加是脊柱骨密度增加1~2年的預測因素[58,60]。同樣,BTM的早期減少可以預測長期應用雙膦酸鹽和地諾單抗相關(2~3年)BMD升高[61,62]。此外,BTM的早期變化也與使用一些抗吸收劑可降低骨折風險[63-69]。例如,在骨折干預試驗(FIT)的事后分析中,血清的減少更多PINP,骨ALP和CTX與阿侖膦酸鹽治療以減少脊柱和臀部有關骨折[67]。同樣,尿液中的CTX和尿液中的NTX與利塞膦酸鹽的發生相關減少脊柱骨折[61,63]。在多重雷洛昔芬(MORE)試驗的結果,OC的變化預測的脊柱骨折風險降低效果優于骨密度變化[68]。
每年1次-關鍵性骨折試驗(HORIZON-PFT)研究在健康結果中觀察到PINP和唑來膦酸的關系相似,而唑來膦酸的發生率降低[69]。最后,在停用后監控血漿中的BTM水平或變化,這種療法在臨床上將會有價值。超過5年無治療間隔的參與者骨折干預期間平均接受了5年的阿侖膦酸鹽治療建立了BTM與骨折風險相關,在長期骨折干預試驗中擴展(FLEX)試驗,CTX、PINP和骨骼的水平擴展開始時的ALP不能預測骨丟失[70]。此外,骨骼ALP和停藥后的尿液NTX不能預測骨折發生率[71]。使唑來膦酸用3年的安慰劑進入試驗時的血清的PINP濃度不能預測椎體形態或接受過3次治療的參與者的非椎骨骨折[72]。總之,將BTM與骨質疏松癥治療結合使用仍然限于研究用途,尚未標準化用于臨床。但是,能夠及早發現BTM與骨骼密度掃描相比,骨骼的變化仍然非常可取的。BTM的臨床使用可能受到先前討論的測定方法的分析變異性的限制,并且骨質疏松癥的護理對BTM的未來發展影響很大。
骨質疏松癥的患者可以應用BTM進行于診斷和管理。首先,許多生理因素和疾病因素等混雜因素可能影響BTM的檢測結果,需積極的排除這些因素來更好的應用BTM。其次,BTM結合骨密度的檢查結果所得出骨平衡指數可以預測臨床骨折風險,應仔細選擇適應癥來提高預測的效能上。后期的研究需在影響BTM檢測結果的混雜因素及其預測骨折風險的適應癥的進一步,最終將BTM在臨床更加精準的應用,提高骨質疏松癥及相關骨折的治療結果。

