miR-129-5p對LPS引起星形膠質細胞炎性介質釋放的影響和機制
丁秀麗 祁秀麗 王譽霖
阿爾茨海默病等中樞神經系統疾病嚴重威脅著人們的生命健康和生活質量,這些中樞神經系統疾病的發生與炎癥關系密切[1]。星形膠質細胞具有營養神經元、支持神經元、免疫調節以及信號傳遞的作用,其是膠質細胞中分布最廣泛、體積最大的一類細胞[2]。研究顯示,星形膠質細胞炎癥發生與細胞內基因表達有關,并且這些基因可能是改善炎癥的重要靶標[3]。miRNA是在真核生物體內具有多種生物學作用的非編碼RNA,其沒有開放閱讀框,大小約為22個核苷酸,參與調控細胞分化、衰老、代謝等過程[4]。miRNA能夠通過影響下游靶基因的表達影響多個病理、生理過程[5]。研究報道顯示,miR-129-5p參與腫瘤、動脈粥樣硬化等疾病發生[6,7]。既往的文獻顯示,上調miR-129-5p能夠減輕阿爾茨海默病大鼠神經損傷,抑制炎癥發生[8]。高遷移率族蛋白B1(high mobility group protein B1,HMGB1)是一個在各種細胞中表達的DNA結合蛋白,在組織損傷中發揮促進作用,其表達上調后可以誘導炎癥發生[9]。在星形膠質細胞中發現,HMGB1表達升高后細胞釋放炎性因子水平升高,HMGB1是一個促星形膠質細胞炎性因子[10]。本實驗探討miR-129-5p對脂多糖(lipopolysaccharides, LPS)誘導的星形膠質細胞炎性介質的影響和機制,為臨床上靶向基因抑制神經性炎癥提供參考。
1 材料與方法
1.1 材料 出生2 d的SD大鼠由遼陽森科生物工程有限公司提供;HMGB1抗體購自美國GeneTex;miR-129-5p mimics和mimics control由百奧邁科生物技術有限公司構建;引物由武漢金開瑞生物工程有限公司合成;LPS購自北京索萊寶科技有限公司;IL-6檢測試劑盒購自上海江萊生物科技有限公司;IL-1β檢測試劑盒購自上海紀寧酶聯科技有限公司;TNF-α檢測試劑盒購自上海恒遠生物科技有限公司;NO檢測試劑盒購自北京普利萊基因技術有限公司;WT和MUT由上海康顏生物科技有限公司構建。
1.2 星形膠質細胞分離培養 在無菌條件下取大鼠大腦皮層組織,放在含有D-Hanks液的培養液皿內,在顯微鏡下取出腦膜、血管組織并棄掉,收集大腦皮層組織,用D-Hanks液洗滌2次。用眼科剪把大腦皮層組織剪碎成大小約為1 mm3的組織塊,在組織中添加0.125%的胰蛋白酶,放在37℃消化。用200目的網篩過濾,在4℃,3 000 r/min離心5 min,將上清溶液棄掉,將細胞懸浮在10%胎牛血清、1%青鏈霉素的DMEM細胞培養液中,種植到細胞培養皿內,細胞接種密度為6×104個/cm2,放在37℃,5%CO2培養箱中培養,9 d后,將細胞放在37℃的恒溫振蕩器上,以260 r/min結合18 h。將脫落的細胞棄掉,此時貼壁的細胞為星形膠質細胞。以0.25%的胰蛋白酶消化傳代,種植到細胞培養瓶內繼續培養,取第3代細胞用于后續實驗。
1.3 細胞轉染和分組處理 星形膠質細胞中轉染miR-129-5p mimics和mimics control,細胞轉染方法完全按照Lipofectamine 2000轉染試劑操作說明進行。將轉染miR-129-5p mimics和mimics control后的星形膠質細胞以含有1 μg/ml的LPS細胞培養液中培養,記為miR-129-5p+LPS和miR-NC+LPS組。以沒有轉染的星形膠質細胞用含有1 μg/ml的LPS細胞培養液培養,記為LPS組。以沒有處理的星形膠質細胞作為空白對照,記為Control組。
1.4 miR-129-5p表達檢測 用qRT-PCR方法測定miR-129-5p表達,步驟如下:收集培養1 d以后的Control、LPS、miR-NC+LPS、miR-129-5p+LPS組細胞,在細胞中添加TRizol試劑,提取細胞總RNA,以NanoDrop檢測RNA樣品的濃度和純度。配制反轉錄體系:1 μl的dT primer、2 μg的RNA、2 μl的Random primer,補足DEPC水至13 μl,放在70℃孵育10 min,放在冰上靜置5 min,然后再添加2 μl的dNTP、4 μl的RT-buffer、0.5 μl的RTase、0.5 μl的inhibitor,此時總體積為20 μl,放在25℃孵育10 min,50℃孵育60 min,90℃孵育5 min,4℃孵育1 min。配制PCR體系,包括:0.5 μl的上下游引物、1 μl的cDNA、10 μl的LightCycler 480 SYBR GreenI,添加DEPC水至20 μl。PCR引物為:miR-129-5p F:5’-CUUUUUGCGGUCUGGGCUUGC-3’,R:5’-AAGCCCAGACCGCAAAAAGUU-3’;U6 F:5’-CTCGCTTCGGCAGCACA-3’,R:5’-AACGCTTCACGAATTTGCGT-3’。U6為內參,按照2-ΔΔCt法計算miR-129-5p表達水平。
1.5 IL-6、IL-1β、TNF-α、NO水平檢測 收集培養1 d以后的Control、LPS、miR-NC+LPS、miR-129-5p+LPS組細胞培養液上清,以ELISA法測定IL-6、IL-1β、TNF-α水平,步驟完全按照IL-6檢測試劑盒、IL-1β檢測試劑盒、TNF-α檢測試劑盒說明進行;以Griess法檢測NO水平,步驟完全按照NO檢測試劑盒說明進行。
1.6 miR-129-5p靶基因預測和鑒定 利用生物信息學軟件(targetscan)預測miR-129-5p的靶基因,發現miR-129-5p和HMGB1的3’UTR端有結合位點。以熒光素酶報告系統鑒定二者的靶向關系:將WT、MUT分別與miR-129-5p mimics、mimics control共轉染到星形膠質細胞中,培養1 d,以熒光素酶活性檢測試劑盒測定熒光素酶活性變化。WT、MUT分別為野生型(含有HMGB1的3’UTR端結合位點)、突變型(含有突變HMGB1的3’UTR端結合位點)熒光素酶報告載體。
1.7 HMGB1蛋白表達檢測 以Western blot方法檢測HMGB1蛋白表達,步驟如下:收集培養1 d以后的Control、LPS、miR-NC+LPS、miR-129-5p+LPS組細胞,在細胞中添加蛋白抽提試劑,放在冰上充分裂解20 min以后,收集裂解試劑,在4℃,12 000 r/min離心10 min,吸取蛋白上清溶液,以BCA方法測定蛋白濃度。在蛋白樣品中添加5×Loading Buffer充分混合以后,放在100℃孵育15 min。在SDS-PAGE凝膠中添加30 μg蛋白樣品,SDS-PAGE凝膠采用5%的濃縮膠和10%的分離膠,設置100 V的電壓電泳,肉眼觀察染料進入到凝膠的底部以后,停止電泳,取出凝膠。將凝膠放在轉移緩沖液中浸泡10 min。轉膜電壓設置為70 V,轉膜時間為40 min,轉膜裝置放在冰上進行。取出NC膜,以5%的脫脂奶粉封閉以后,放在1∶1 000稀釋以后的一抗反應液中,在4℃的環境中孵育過夜,然后將NC膜放在1∶4 000稀釋以后的二抗溶液中,放在室溫中結合2 h。在NC膜上滴加ECL顯色試劑。β-actin作為參照,分析HMGB1蛋白表達變化。
1.8 HMGB1對miR-129-5p影響細胞炎性介質釋放的作用檢測 分別將miR-129-5p mimics、pcDNA3.1和miR-129-5p mimics、pcDNA3.1-HMGB1共轉染到星形膠質細胞中,然后以1 μg/ml的LPS細胞培養液培養,記為miR-129-5p+NC+LPS組和miR-129-5p+HMGB1+LPS組,按照1.5中方法檢測細胞培養液中IL-6、IL-1β、TNF-α、NO水平,按照1.7中方法檢測細胞中HMGB1蛋白表達。
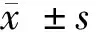
2 結果
2.1 miR-129-5p mimics提高LPS條件下星形膠質細胞中miR-129-5p表達水平 LPS組細胞中miR-129-5p表達水平低于Control組(P<0.05);miR-129-5p+LPS組細胞中miR-129-5p表達水平高于miR-NC+LPS組(P<0.05)。miR-129-5p mimics提高LPS條件下星形膠質細胞中miR-129-5p表達水平。見表1。
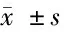
表1 miR-129-5p mimics轉染后LPS誘導的星形膠質細胞中miR-129-5p表達水平
2.2 miR-129-5p mimics抑制LPS條件下星形膠質細胞炎性介質釋放 LPS組細胞培養液上清中IL-6、IL-1β、TNF-α、NO水平高于Control組(P<0.05);miR-129-5p+LPS組細胞培養液上清中IL-6、IL-1β、TNF-α、NO水平低于miR-NC+LPS組(P<0.05)。miR-129-5p mimics抑制LPS條件下星形膠質細胞炎性介質釋放。見表2。
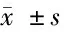
表2 miR-129-5p mimics轉染后LPS誘導的星形膠質細胞釋放IL-6、IL-1β、TNF-α、NO水平
2.3 miR-129-5p和HMGB1靶向關系預測和鑒定 生物信息學軟件發現miR-129-5p和HMGB1的3’UTR端有結合位點。miR-129-5p mimics和WT共轉染后的細胞熒光素酶活性下降。miR-129-5p和HMGB1互為靶向關系。見圖1,表3。

圖1 生物信息學軟件預測miR-129-5p和HMGB1靶向關系
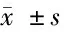
表3 細胞熒光素酶活性
2.4 miR-129-5p mimics抑制LPS條件下星形膠質細胞中HMGB1蛋白表達 LPS組細胞中HMGB1蛋白表達水平高于Control組(P<0.05);miR-129-5p+LPS組細胞中HMGB1蛋白表達水平低于miR-NC+LPS組(P<0.05)。miR-129-5p mimics抑制LPS條件下星形膠質細胞中HMGB1蛋白表達。見表4,圖2。
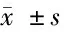
表4 miR-129-5p mimics轉染后LPS誘導的星形膠質細胞中HMGB1蛋白水平
2.5 pcDNA3.1-HMGB1逆轉miR-129-5p mimics對LPS條件下星形膠質細胞炎性介質釋放的抑制作用 miR-129-5p+HMGB1+LPS組細胞中HMGB1蛋白表達水平和細胞釋放IL-6、IL-1β、TNF-α、NO水平均高于miR-129-5p+NC+LPS組,差異有統計學意義(P<0.05)。pcDNA3.1-HMGB1逆轉miR-129-5p mimics對LPS條件下星形膠質細胞炎性介質釋放的抑制作用。見圖3,表5。

圖2 Western blot檢測miR-129-5p mimics轉染后LPS誘導的星形膠質細胞中HMGB1蛋白表達

圖3 Western blot檢測miR-129-5p mimics和pcDNA3.1-HMGB1共轉染后細胞中HMGB1蛋白表達
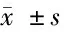
表5 miR-129-5p mimics和pcDNA3.1-HMGB1共轉染后LPS誘導的星形膠質細胞中HMGB1蛋白水平和細胞釋放IL-6、IL-1β、TNF-α、NO水平
3 討論
星形膠質細胞具有調節中樞神經系統的作用,其受到外界因素刺激以后可以釋放多種炎性因子,促進炎性反應[11]。IL-6、IL-1β、TNF-α是促炎性因子,其有調節免疫和誘導炎癥的作用,IL-6、IL-1β、TNF-α在多種神經炎癥性損傷中高表達[12]。NO是重要的免疫調節因子,其可以調控中性粒細胞、巨噬細胞活性,對中樞神經系統神經遞質以及突觸可塑性等有調控作用[13]。研究顯示,NO與阿爾茨海默病、帕金森綜合征等中樞神經系統疾病關系密切,NO可以作為促炎因子參與炎性反應的病理損傷發生,如DNA破壞、蛋白激酶硝酰化[14,15]。本實驗結果顯示,LPS刺激以后的星形膠質細胞培養液上清中的IL-6、IL-1β、TNF-α、NO含量均升高,提示LPS刺激星形膠質細胞炎性介質釋放,這為我們研究miR-129-5p在星形膠質細胞炎癥中的作用提供了基礎。
miRNA沒有開放閱讀框,也沒有編碼蛋白質的作用,在人體內的不同組織、不同細胞中均有表達,miRNA參與不同階段生理、病理過程,miRNA是一個重要的調控因子[16]。目前的研究表明,miRNA不僅與胚胎發育等正常生理過程有關,還與人類多種疾病進展關系密切[17]。miRNA和人類腫瘤、肺炎、缺血再灌注損傷等發生均有關,并且miRNA還可能是疾病治療的分子靶點[18-20]。miRNA還參與中樞神經系統疾病的發生,在缺氧復氧腦損傷、阿爾茨海默病等疾病中均發現miRNA的異常表達,miRNA還參與調控疾病的進展[21,22]。以前的研究顯示,miR-129-5p與腫瘤、椎間盤退變等有關,miR-129-5p可能是疾病治療的靶點[23,24]。研究表明,miR-129-5p參與阿爾茨海默病發生,并且上調miR-129-5p能夠抑制阿爾茨海默病大鼠神經炎癥[8]。本實驗發現,LPS刺激以后的星形膠質細胞中miR-129-5p表達水平降低,并且上調miR-129-5p后的星形膠質細胞分泌IL-6、IL-1β、TNF-α、NO減少,提示上調miR-129-5p抑制星形膠質細胞炎性介質釋放,這與以前的研究結果相符合,均說明miR-129-5p有抗神經炎癥的作用。
本次實驗還進一步探討了miR-129-5p的作用機制,發現miR-129-5p與HMGB1互為靶向關系,并且上調miR-129-5p可以抑制LPS條件下星形膠質細胞中HMGB1的表達。HMGB1是一個非組蛋白,其膿毒癥、關節炎、肺炎等炎癥疾病中發揮作用[25]。以前的研究發現,HMGB1參與神經炎癥發生,其在星形膠質細胞炎癥中高表達,并且下調其表達可以改善炎癥[10,26]。本實驗顯示,HMGB1可以逆轉上調miR-129-5p對LPS條件下星形膠質細胞炎性介質釋放的抑制作用,提示上調miR-129-5p通過靶向HMGB1發揮抗炎作用。
總而言之,miR-129-5p在星形膠質細胞炎癥中可能發揮抑制作用,上調其表達可以通過靶向抑制HMGB1減少LPS引起的星形膠質細胞炎性介質釋放,這為研究神經炎癥發生機制提供了資料,為靶向基因抑制神經炎癥發生提供了參考方向。以后會繼續研究miR-129-5p可能的其他作用機制和下游靶向調控機制。

