漢防己甲素調控Chk1基因對宮頸癌細胞增殖、凋亡及放射敏感性的影響
龔妙添 楊桂生 黃仕堯
宮頸癌(cervical cancer)是世界八大惡性腫瘤之一,在女性惡性腫瘤中發病率居第二位,僅次于乳腺癌,據統計,全球每年宮頸癌新發病例約有53萬例,死亡病例達27萬[1]。宮頸癌的發病原因已逐漸明確,該病主要是由于高危型人乳頭狀瘤病毒(human papillomavirus,HPV)的持續感染,引起人體皮膚黏膜的鱗狀上皮增殖,形成上皮內瘤[2]。根治性子宮切除術及輔助性放化療是宮頸癌的主要治療方式,可以在一定程度上提高宮頸癌患者的生存率,但多數轉移性宮頸癌患者預后較差,并且隨著放射治療劑量的累積,腫瘤對于放射的敏感性減弱,嚴重影響放療效果[3,4]。漢防己甲素(tetrandrine,Tet)是由中藥粉防己的塊根提取,又被稱為粉防己堿,是一種雙芐基異喹啉類生物堿,Tet為天然的非選擇性鈣離子通道阻滯劑,具有抗高血壓、抗炎和抗纖維化等作用[5]。已有研究表明,Tet具有抗癌作用,在結腸癌[6]、膀胱癌[7]和肝癌[8]等疾病中,Tet可以抑制癌細胞的增殖、遷移侵襲,促進其凋亡,逆轉上皮間質轉化。為研究漢防己甲素在宮頸癌中的作用,本文通過體外培養宮頸癌Hela細胞的方法,探究漢防己甲素對宮頸癌細胞的增殖、凋亡和放射敏感性的影響,并探討其作用機制,旨在為宮頸癌的治療提供新理論依據。
1 材料與方法
1.1 材料 人宮頸癌細胞株Hela購自ATCC;DMEM培養基購自Gibco;胎牛血清、青霉素、鏈霉素購自杭州四季青公司;胰蛋白酶、噻唑藍(MTT)、二甲基亞砜(DMSO)、漢防己甲素購于美國Sigma公司;Lipofectamine 2000轉染試劑購自美國Invitrogen公司;Annexin V-FITC/PI凋亡檢測試劑盒購自上海翊圣生物科技有限公司;BCA蛋白濃度測定試劑盒、SDS-PAGE試劑盒購自碧云天生物技術公司;反轉錄試劑盒、熒光定量試劑盒購自日本TaKaRa公司;PVDF膜、RIPA裂解液、ECL發光液購自北京Solarbio公司;吉姆薩(Giemsa)染液購自Applichem公司;control siRNA和Chk1 siRNA由山東維真生物科技有限公司設計合成;兔抗人Chk1多克隆抗體、兔抗人GAPDH多克隆抗體、HRP標記的山羊抗兔IgG購自Abcam公司。
1.2 方法
1.2.1 細胞培養:Hela細胞培養于DMEM培養基(含10% 胎牛血清、1% 青霉素和1% 鏈霉素)中,置于37℃、5% CO2及飽和濕度條件下的培養箱中培養,至細胞融合度達到80% 左右時加入胰蛋白酶進行細胞傳代。
1.2.2 細胞轉染:取對數生長期的細胞使用胰蛋白酶消化后重懸,以1×106個/孔接種至6孔板,按照Lipofectamine 2000說明書分別將control siRNA、Chk1 siRNA、pcDNA、pcDNA-Chk1轉染至Hela細胞,記為si-NC組、si-Chk1組、pcDNA組、pcDNA-Chk1組;選擇轉染pcDNA和pcDNA-Chk1的細胞,在培養液中加入Tet并調整終濃度為5.00 μg/ml,常規培養48 h。
1.2.3 分組:將Hela細胞隨機分為Con組、不同濃度Tet處理(0.01 μg/ml、0.10 μg/ml、1.00 μg/ml、5.00 μg/ml、10.00 μg/ml)組、Tet組。處理方法:Con組:不添加Tet;不同濃度Tet處理組:在細胞培養基中加入Tet并調整終濃度分別為0.01 μg/ml、0.10 μg/ml、1.00 μg/ml、5.00 μg/ml、10.00 μg/ml;Tet組:以含Tet終濃度為5.00 μg/ml的培養基培養細胞。每組6個復孔,重復3次。
1.3 qRT-PCR檢測 收集Tet(5.00 μg/ml)處理的Hela細胞,研磨充分后加入Trizol試劑提取總RNA,微量核酸測定儀檢測RNA純度和濃度。使用逆轉錄試劑盒將RNA反轉錄成cDNA,采用TaKaRa 熒光定量試劑盒,按照使用說明配制反應體系,以GAPDH為內參進行PCR擴增,每個樣品重復3次,采用2-ΔΔCt法分析基因相對表達量。
1.4 Western blot檢測 加入RIPA裂解液裂解各組細胞,4℃,12 000 g離心15 min,收集蛋白上清液,BCA蛋白定量法檢測蛋白濃度。將蛋白樣品煮沸變性冷卻至室溫后,進行SDS-PAGE電泳,轉至PVDF膜后,5%脫脂奶粉室溫封閉2 h。分別加入Chk1抗體(1∶500)和GAPDH抗體(1∶1 000),4℃孵育過夜,TBST洗膜3次;加入HRP標記的山羊抗兔IgG(1∶2 000)室溫孵育2 h,TBST洗膜3次。采用ECL化學發光法檢測蛋白的表達,計算相對灰度值。每個蛋白樣品重復3次。
1.5 MTT檢測細胞增殖 在上述各組細胞培養至24 h、48 h、72 h時加入20 μl(5 g/L)的MTT溶液,37℃繼續培養4 h,棄掉培養液,每孔加入150 μl DMSO,置于搖床上室溫振蕩10 min,用酶標儀測定490 nm處的吸光度(A),計算細胞增殖抑制率,抑制率(%)=(1-實驗組A值/對照組A值)×100%。
1.6 流式細胞儀檢測細胞凋亡 在上述各組細胞培養至48 h后棄掉培養基,PBS洗滌,用無EDTA的胰酶消化細胞后,4℃、300 g離心10 min收集,加入PBS制成細胞懸液。按照Annexin V-FITC/PI細胞凋亡檢測試劑盒說明書,加入5 μl FITC標記的Annexin-V和5 μl PI輕輕混勻,室溫下避光孵育15 min,流式細胞術檢測細胞凋亡。
1.7 克隆形成實驗 取上述各組細胞經胰酶消化計數后,制成細胞懸液,按照射劑量將不同數目細胞接種于6孔板中,待細胞貼壁后每板分別以0、2、4、6、8 Gy的劑量進行照射,繼續培養至出現肉眼可見的克隆形成,倒掉培養基,PBS洗滌,甲醇固定10 min,吉姆薩染色10 min,清洗染液,晾干后計數細胞數>50個的克隆。使用GraphPad Prism 7軟件進行單擊多靶模型擬合細胞存活曲線,計算平均致死劑量(D0)、準閾劑量(Dq)、存活分數(SF2)、放射增敏比(SER)。
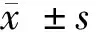
2 結果
2.1 不同濃度Tet對宮頸癌Hela細胞增殖抑制的影響 MTT法檢測結果,不同濃度Tet(0.01 μg/ml、0.10 μg/ml、1.00 μg/ml、5.00 μg/ml、10.00 μg/ml)處理后的Hela細胞,隨著培養時間的延長,細胞增殖抑制率逐漸升高,具有濃度依賴性。選取作用時間48 h,5.00 μg/ml的Tet濃度(抑制率約為50%)用作后續實驗。見表1。

表1 不同濃度漢防己甲素對Hela細胞增殖抑制的影響
2.2 Tet對宮頸癌Hela細胞凋亡的影響 流式細胞儀檢測結果,與Con組比較,Tet(5.00 μg/ml)處理后的宮頸癌Hela細胞其凋亡率顯著增加(P<0.05)。見圖1,表2。
2.3 Tet對宮頸癌Hela細胞放射敏感性的影響 以不同劑量(0、2、4、6、8Gy)X線照射各組細胞,與Con組比較,Tet組Hela細胞存活分數明顯降低(P<0.05);單擊多靶模型參數,D0和Dq分別由Con組的2.621、1.297降低為Tet組的1.458和0.460,SER放射增敏比為1.798,表明,Tet可增強Hela細胞放射敏感性。見表3。

圖1 漢防己甲素對Hela細胞凋亡的影響

表2 漢防己甲素對Hela細胞凋亡的影響

表3 單擊多靶模型參數
2.4 Tet對宮頸癌Hela細胞中Chk1基因表達的影響 qRT-PCR和western blot檢測結果,與Con組比較,Tet組宮頸癌Hela細胞中Chk1基因在mRNA和蛋白水平的表達均顯著降低(P<0.05)。見圖2,表4。

圖2 漢防己甲素對Hela細胞中Chk1基因表達的影響
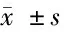
表4 漢防己甲素對Hela細胞中Chk1基因表達的影響
2.5 抑制Chk1表達對宮頸癌Hela細胞增殖、凋亡、放射敏感性的影響 轉染Chk1 siRNA至Hela細胞,與si-NC組比較,si-Chk1組的Chk1蛋白表達顯著降低,細胞的增殖抑制率與細胞凋亡率均顯著升高(P<0.05);以不同劑量(0、2、4、6、8Gy)X線照射后,與si-NC組比較,si-Chk1組Hela細胞存活分數明顯降低(P<0.05),SER放射增敏比為1.542,表明,抑制Chk1表達可增強Hela細胞放射敏感性。見圖3,表5、6。

圖3 Chk1蛋白相對表達量

組別D0 (Gy)Dq (Gy)NSF2kSERsi-NC組 2.5671.4311.7640.6580.390-si-Chk1組1.6650.7161.5370.4230.6011.542
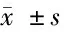
表6 抑制Chk1表達對Hela細胞增殖、凋亡的影響
2.6 過表達Chk1逆轉了Tet對宮頸癌Hela細胞增殖、凋亡和放射敏感性的影響 以Tet(5.00 μg/ml)處理Hela細胞,與Con組相比,Tet組Chk1蛋白表達量顯著降低,Hela細胞的增殖抑制率和細胞凋亡率明顯升高,Tet組Hela細胞存活分數明顯降低(P<0.05);轉染pcDNA-Chk1至Hela細胞,并經過Tet(5.00 μg/ml)處理后,與Tet+pcDNA組比較,Tet+pcDNA-Chk1組Chk1蛋白表達量顯著升高,Hela細胞的增殖抑制率與細胞凋亡率均顯著降低,Tet+pcDNA-Chk1組Hela細胞存活分數明顯升高(P<0.05)。提示,過表達Chk1逆轉了Tet對Hela細胞增殖、凋亡和放射敏感性的影響。見表7、8,圖4。

表7 單擊多靶模型參數
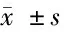
表8 過表達Chk1逆轉了漢防己甲素對Hela細胞增殖、凋亡的影響

圖4 Chk1蛋白相對表達量
3 討論
宮頸癌的發生與環境衛生、居住地域、受教育水平、HPV疫苗覆蓋率等多種因素有關[9,10]。全球85%的宮頸癌病例發生在發展中國家,在我國城市地區,與農村地區相比,宮頸癌發病率較高,死亡率較低,2013年我國宮頸癌新發病例為10萬,死亡病例為2.6萬,其發病率和死亡率隨年齡增長而增加[11]。由于宮頸癌早期癥狀不明顯,多數患者就診時已處于局部晚期,對于局部晚期宮頸癌,放療是最主要的治療手段之一,但易復發且對放化療耐受[12]。因此,探究新的宮頸癌治療藥物及其作用機制具有重要意義。
Tet是從漢防己塊根中提取的有效活性成分,越來越多的研究發現,Tet具有一定的抗腫瘤作用,例如,在肺癌中,Tet能夠抑制肺癌細胞的增殖,誘導其凋亡[13]。王君等[14]研究發現,最大非毒性劑量Tet聯合放療后可以去除放療導致的G2/M期阻滯,增加放療引起的鼻咽癌細胞的DNA斷裂及細胞凋亡。新近研究發現,Tet呈濃度和時間依賴性抑制乳腺癌細胞增殖,誘導癌細胞G1期阻滯,降低Bcl-2的蛋白水平,促進癌細胞的凋亡[15]。本研究發現,Tet能明顯抑制宮頸癌Hela細胞的增殖,且呈濃度依賴性;經過5.00 μg/ml濃度的Tet處理的Hela細胞其凋亡率明顯升高,并且Hela細胞的放射敏感性顯著增強。
細胞周期檢測點激酶1(cell cycle checkpoint kinase 1,Chk1)是細胞周期檢測點的轉導因子,Chk1在腫瘤的發生、發展過程及細胞復制的調節過程中具有重要作用,Chk1抑制劑與DNA損傷試劑聯用可以增強抗腫瘤的療效[16,17]。有研究發現,Chk1在肺癌[18]、肝癌[19]的組織或細胞系中呈高表達。Zhou等[20]研究表明,在三陰性乳腺癌中,Chk1抑制劑可影響癌細胞的增殖,增加癌細胞的放射敏感性。在宮頸癌中,沉默Chk1的表達抑制了Hela細胞的增殖,并且能夠增強Hela細胞的放射敏感性[21]。本研究發現,沉默Chk1基因后,Hela細胞中的Chk1蛋白表達量顯著降低,Hela細胞的增殖抑制率和凋亡率顯著升高,對放射照射的敏感性顯著增加,這與前人研究結果[21]一致。Tet(5.00 μg/ml)處理后Hela細胞中Chk1基因在mRNA和蛋白水平的表達均顯著降低;轉染pcDNA-Chk1至Hela細胞,并經過Tet(5.00 μg/ml)處理后,Chk1蛋白表達量顯著升高,細胞增殖抑制率與細胞凋亡率均顯著降低,經過放射照射Hela細胞存活分數明顯升高。表明過表達Chk1逆轉了Tet對Hela細胞增殖、凋亡和放射敏感性的影響。
綜上所述,Tet可抑制Hela細胞的增殖,促進細胞凋亡,增強細胞放射敏感性,其機制可能與Tet抑制Chk1基因的表達有關。本研究探討了Tet對宮頸癌細胞增殖、凋亡和放射敏感性的影響及其分子機制,這為漢防己甲素治療宮頸癌提供了新的理論依據。

