麻黃堿對LPS誘導的肺泡上皮細胞A549凋亡、炎癥和COX-2基因表達的影響
邵春芝 陳靜 王棟宇 王君
急性肺損傷(acute lung injury,ALI)是臨床上常見的危重癥,膿毒癥、創傷、電擊和吸入有害氣體等多種因素都可能導致ALI,其中膿毒癥是常見的因素[1]。研究證明,嚴重感染后,一些患者會發生某些反應,包括促炎信號通路的激活和炎性介質的過度表達,導致全身性炎性反應,最終導致嚴重休克,多器官衰竭和死亡[2,3]。越來越多的證據表明,過度炎性反應和氧化應激是ALI的主要發病機制[4,5]。因此,開發預防和(或)治療膿毒癥誘導的ALI的有效方法顯得尤為重要。肺泡上皮充當保護肺部免受吸入物質影響的屏障。有研究顯示,肺泡上皮細胞的異常凋亡與ALI密切相關[6]。文獻指出,環氧化酶-2(COX-2)是前列腺素物質合成過程中的一種限速酶,參與多種炎癥性疾病,其中包括AIL[7]。因此,有效抑制肺泡上皮細胞凋亡、炎性反應及氧化應激對ALI傷的治療至關重要。麻黃具有宣肺平喘、發汗解表等功效,常用于治療咳喘病,麻黃堿是麻黃的主要成分。研究顯示,麻黃堿能夠抑制氣道炎癥、氣道重塑以及支氣管哮喘等[8,9]。目前關于麻黃堿對膿毒癥性ALI的影響筆者所見尚未報道。本實驗探討麻黃堿對脂多糖誘導的肺泡上皮細胞凋亡、炎癥以及COX-2基因表達的影響,以期為麻黃堿用于ALI的治療提供實驗依據。
1 材料與方法
1.1 材料 人肺泡上皮細胞A549(中國科學院上海生科院細胞資源中心);鹽酸麻黃堿(中國食品藥品檢定研究院);RPMI-1640培養基(美國Gibco公司);胎牛血清(杭州四季青生物科技有限公司);胰蛋白酶(美國Abcam公司);CCK-8試劑(日本同仁化學研究所);TNF-α、IL-1β和IL-6 ELISA檢測試劑盒(深圳達科為生物技術有限公司);Trizol試劑、逆轉錄試劑盒、SYBR Green PCR Master Mix試劑盒(日本TaKaRa公司);ROS、MDA和SOD檢測試劑盒(南京建成生物工程研究所);Cleaved Caspase-3、Cleaved Caspase-9和COX-2單抗(美國Affinity Biosciences公司);辣根過氧化酶標記的IgG二抗(美國Santa Cruz公司);AnnexinⅤ-FITC/PI細胞凋亡檢測試劑盒、BCA蛋白濃度測定試劑盒(碧云天生物技術研究所);ECL化學發光試劑盒(賽默飛世爾科技有限公司)。
1.2 細胞培養 肺泡上皮細胞A549復蘇后培養在含10%胎牛血清的RPMI-1640培養液中,放置在5% CO2、飽和濕度、37℃培養箱中,觀察細胞生長狀況,每隔1 d更換1次新的培養液,細胞貼壁生長匯合至80%時進行傳代,取對數增殖期的細胞進行后續實驗。
1.3 細胞分組和處理 對數期的肺泡上皮細胞A549以1×105個/孔接種至24孔板中,于37℃培養箱中過夜培養,細胞貼壁生長融合至50%時加入10 μg/ml LPS進行干預,設10 μg/ml LPS干預的A549細胞為LPS組,10 μg/ml LPS 和800 μg/ml麻黃堿干預的A549細胞為Ephedrine組,不做任何處理的A549細胞為對照Control組,3組細胞作用24 h,收集細胞及細胞上清液,進行后續相關指標實驗檢測。
1.4 qRT-PCR檢測 在24孔板中接種肺泡上皮細胞A549,每孔接種1×106個/孔,按照1.3分組處理24 h后,以胰酶消化并收集細胞,采用Trizol法提取抽提細胞總RNA,將RNA逆轉錄合成第一鏈cDNA,采用cDNA作為模板,β-actin作為內參,在熒光定量PCR儀上進行擴增,反應結束獲得數據以2-ΔΔCt法分析基因的相對表達情況。所有引物。COX-2 F 5’-GTCTGATGATGTATGCCACAATCTG-3’;R 5’-GATGCCAGTGATAGAGGGTGTTAAA-3’。β-actin F 5’-AACCCTAAGGCCAACCGTGAAAAG-3’;R 5’-TCATGAGGTAGTCTGTCAGGT-3’。
1.5 CCK-8實驗 對數期的肺泡上皮細胞A549種植到96孔板中,種植密度為1×105個/孔,于37℃培養箱繼續培養,以1.3分組處理,在處理24、48、72 h時于每孔中避光添加10 μl MTT溶液,37℃培養箱孵育4 h,棄去細胞上清液,于每孔中添加150 μl二甲基亞砜溶液,充分混勻,振蕩反應至結晶沉淀完全溶解,放入全自動酶標儀測定每孔吸光度值(OD值),波長設置為490 nm。
1.6 流式細胞術檢測 收集對數期的肺泡上皮細胞A549,調整細胞密度為1×105個/ml,于6孔板中進行種植,每孔2 ml,以1.3分組處理,于常規培養箱連續培養24 h,棄細胞上清液,收集細胞,加入500 μl Binding Buffer重懸細胞,添加5 μl AnnexinⅤ-FITC混勻,再加入5 μl PI,混勻后室溫避光孵育10~15 min,使用流式細胞儀檢測細胞凋亡率。
1.7 ELISA檢測 肺泡上皮細胞A549分組處理后,收集細胞上清液,采用ELISA試劑盒分別檢測3組細胞上清中TNF-α、IL-1β和IL-6的含量,具體步驟嚴格按照ELISA試劑盒使用說明書進行操作。
1.8 SOD活力和MDA含量檢測 肺泡上皮細胞A549分組處理后,收集細胞上清液,采用硫代巴比妥酸法測定MDA的含量,采用黃嘌呤氧化酶法測定SOD的活力,具體方法見MDA和SOD檢測試劑盒使用說明書。
1.9 ROS水平檢測 收集處理后的3組肺泡上皮細胞A549,與5 μmol/L的DCFH-DA工作液混勻,放置在37℃培養箱孵育10 min,參照ROS檢測試劑盒說明測定ROS水平。
1.10 Western blot實驗 使用RIPA細胞裂解液抽提細胞中的總蛋白,經BCA法對蛋白濃度進行定量,向蛋白樣品中加入5×上樣緩沖液,金屬浴致蛋白質變性。制備SDS-PAGE凝膠,電泳分離蛋白,隨后轉移到PVDF膜上,放置在5%脫脂奶粉中室溫封阻1 h,孵育相應一抗(Cleaved Caspase-3一抗1∶500稀釋,Cleaved Caspase-9一抗1∶500稀釋,COX-2一抗1∶800稀釋),4℃過夜,次日加入二抗(1∶2 00稀釋),室溫孵育2 h,加入ECL發光試劑進行顯色,于暗室中曝光、采集蛋白條帶圖像,以β-actin作內參,分析目的蛋白灰度值,計算蛋白相對表達量。
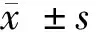
2 結果
2.1 麻黃堿對LPS誘導的A549細胞增殖能力的影響 與Control組相比,LPS組肺泡上皮細胞A549在24、48和72 h時增殖能力均明顯降低(P<0.05);與LPS組相比,Ephedrine組A549細胞在各時間點增殖能力均明顯升高(P<0.05)。見表1。

表1 3組肺泡上皮細胞A549在24、48和72 h時OD值比較
2.2 麻黃堿對LPS誘導的A549細胞凋亡能力的影響 與Control組相比,LPS組肺泡上皮細胞A549凋亡率明顯升高(P<0.05);與LPS組相比,Ephedrine組A549細胞凋亡率明顯降低(P<0.05)。見表2,圖1。

表2 3組肺泡上皮細胞凋亡率比較

圖1 流式細胞術檢測各組肺泡上皮細胞A549的凋亡率
2.3 麻黃堿對LPS誘導的凋亡相關蛋白表達的影響 與Control組相比,LPS組肺泡上皮細胞A549中Cleaved Caspase-3和Cleaved Caspase-9的表達明顯上調(P<0.05);與LPS組相比,Ephedrine組A549細胞中Cleaved Caspase-3和Cleaved Caspase-9的表達明顯下調(P<0.05)。見表3,圖2。

表3 3組肺泡上皮細胞中Cleaved Caspase-3和Cleaved Caspase-9表達比較

圖2 Western blot檢測凋亡相關蛋白Cleaved Caspase-3和Cleaved Caspase-9的表達
2.4 麻黃堿對LPS誘導的炎性因子分泌的影響 與Control組相比,LPS組肺泡上皮細胞A549上清液中TNF-α、IL-1β和IL-6的含量明顯增多(P<0.05);與LPS組相比,Ephedrine組A549細胞上清液中TNF-α、IL-1β和IL-6含量明顯減少(P<0.05)。見表4。

表4 3組肺泡上皮細胞上清中TNF-α、IL-1β和IL-6的含量比較
2.5 麻黃堿對LPS誘導的氧化應激的影響 與Control組相比,LPS組肺泡上皮細胞A549中MDA含量增多(P<0.05),ROS水平升高(P<0.05),SOD活性降低(P<0.05);與LPS組相比,Ephedrine組A549細胞中MDA含量減少(P<0.05),ROS水平降低(P<0.05),SOD活性升高(P<0.05)。見表5。

表5 3組肺泡上皮細胞中MDA含量、ROS水平和SOD活性比較
2.6 麻黃堿對LPS誘導的COX-2表達的影響 與Control組相比,LPS組肺泡上皮細胞A549中COX-2 mRNA和蛋白表達均明顯升高(P<0.05);與LPS組相比,Ephedrine組A549細胞中COX-2 mRNA和蛋白表達均明顯降低(P<0.05)。見表6,圖3。

表6 3組肺泡上皮細胞中COX-2 mRNA和蛋白表達比較

圖3 Western blot檢測COX-2蛋白表達
3 討論
ALI的特征是富含蛋白質的水腫液在肺泡隔室中積聚。ALI的機制因病因而異,例如血管通透性增加,細胞因子過度生產,白細胞募集和表面活性劑功能障礙,導致間質和肺泡肺水腫、肺泡塌陷和低氧血癥[10]。上皮和內皮細胞的損傷在ALI的發展中起著重要作用。上皮的完整性和通透性通過細胞層之間的緊密連接而得以緊密保持,這允許細胞與細胞之間的通訊,但阻止吸入的有害物質的進入[11]。
LPS是革蘭陰性細菌的主要成分,是感染疾病中的主要促炎反應因子之一,可導致體內外的過度炎性反應[12]。據報道LPS是引起炎性反應的主要因素之一,LPS誘導的肺泡上皮細胞損傷模型已被廣泛用于膿毒癥相關的ALI的機制研究[13,14]。在ALI模型中,LPS顯著增加了包括TNF-α,IL-1β和IL-6在內的炎性細胞因子的產生,這已被證明與ALI的發展有關[15]。
在本研究中,根據Zhu等[16]的研究,通過用10 μg/ml的LPS刺激肺泡上皮細胞A549創建了類似的膿毒癥性ALI細胞模型,結果顯示,LPS誘導的A549細胞增殖活力明顯降低,凋亡率明顯升高,凋亡相關蛋白Cleaved Caspase-3和Cleaved Caspase-9的表達明顯上調,炎性因子TNF-α,IL-1β和IL-6的分泌增多,該發現與先前的研究[16]一致,表明成功建立了LPS誘發的ALI細胞模型。
麻黃堿是從傳統中藥麻黃的主要活性成分,具有廣泛的抗氧化和抗炎的作用[17]。本實驗根據前期實驗結果通過800 μg/ml麻黃堿干預LPS誘導的A549細胞,結果顯示,細胞增殖活力升高,凋亡率下降,Cleaved Caspase-3和Cleaved Caspase-9蛋白表達下調,TNF-α,IL-1β和IL-6的含量減少,表明麻黃堿能夠逆轉LPS誘導的A549細胞凋亡及炎性反應,對LPS誘導的A549細胞具有保護作用。
此外,本實驗結果顯示,LPS誘導的A549細胞中MDA含量增多,ROS水平增加,而SOD活性降低,而麻黃堿能夠逆轉LPS誘導的A549細胞中ROS水平、MDA含量和SOD活性。研究顯示,膿毒癥誘導的ALI中ROS水平升高,過量的ROS又可促進局部炎性反應,進而導致肺組織的進一步損傷[18]。
SOD是機體內非常重要的抗氧化酶,能夠有效清除機體內的氧自由基,增加抗氧化能力。MDA是一種過氧化產物,其含量的高低間接反應細胞損傷程度。ALI中肺組織中SOD活力降低,MDA含量上升[19]。本實驗結果與以往的研究[18,19]一致,提示麻黃堿能夠通過抑制氧化應激對LPS誘導的肺泡上皮細胞A549起保護作用。研究表明,在正常肺組織中COX-2基因的表達量較低,而在ALI的肺組織中COX-2的表達急劇上升,COX-2基因參與ALI發病過程[20]。有研究顯示,在ALI中,抑制COX-2的表達可有效減輕肺組織的炎性反應[21]。
本實驗發現,LPS能夠上調A549細胞中COX-2的表達,麻黃堿能夠下調LPS誘導的COX-2的表達。這提示麻黃素對LPS處理的A549細胞炎性反應的抑制作用可能通過下調COX-2的表達來實現,然而該推測仍需后續進行驗證。
綜上所述,麻黃堿能夠抑制LPS誘導的肺泡上皮細胞A549凋亡、炎性反應及氧化應激,并下調COX-2基因的表達,為麻黃堿用于ALI的臨床治療提供實驗依據。

