剪切波彈性成像彈性模量值與乳腺癌臨床病理及分子分型的關系
劉品紅,王珊珊,于 龍
乳腺癌是一種發病率較高的受雌性激素影響的高異質性惡性腫瘤疾病,可嚴重危害女性生命健康[1]。乳腺癌的分子分型可受多種混雜因素影響,有臨床研究證實,不同分子分型乳腺癌的治療方法及預后也存在差異[2-3]。因此,及早準確鑒別乳腺癌的分子分型對提高患者生存質量具有重要意義。由于乳腺癌病灶組織的硬度值較良性組織更大,超聲彈性成像技術則能通過檢測病灶組織彈性變化來鑒別良惡性乳腺病變,故臨床多采用超聲彈性成像技術區分乳腺腫瘤類型。國內外研究認為,實時剪切波彈性成像(SWE) 技術可定量測定腫瘤病灶的彈性模量值,并鑒別腫瘤性質[4-5]。但目前關于SWE彈性模量值與乳腺癌臨床病理的關系,及其在不同分子分型乳腺癌病灶中的差異研究尚少。基于此,本研究采用SWE技術分析彈性模量值與乳腺癌不同分子分型及臨床病理的關系,結果報告如下。
1 資料與方法
1.1一般資料 選取2018年10月—2020年12月在我院接受治療的93例女性乳腺癌(112個病灶)為研究對象。年齡26~47(36.73±10.82)歲;病程1.5~5.0(3.26±1.73)年;病灶側別:左側67例,右側20例,雙側6例;病灶直徑1.12~2.60(1.86±0.74)cm。①納入標準:均經手術病理證實為乳腺癌,且術前均接受SWE檢查;術前未接受乳腺癌相關治療;患者均自愿簽署知情同意書。②排除標準:已接受手術、輔助放化療的乳腺癌患者;存在嚴重心腦血管、肝腎系統疾病者;免疫組織化學資料不完整者。
1.2檢查方法 患者取仰臥位,暴露雙側乳房及腋窩,術前采用二維超聲(AixPlorer,SuperSonic Imagine)檢查乳腺病灶,探頭頻率4~15 MHz,分析腫瘤病灶大小、形狀及血流情況的圖像特征;切換至SWE模式,設定感興趣區,覆蓋整個病灶邊界,注意避免壓迫乳腺組織,患者屏氣后,靜置探頭3 s,將獲得的圖像保存至超聲儀內。按此法獲得各病灶彈性圖像3幀,將測量框置于病灶最硬處,定量測定乳腺癌病灶硬度,記錄代表腫塊硬度的彈性模量平均值(Emean)、最大值(Emax)。所有操作均由同一位具有3年以上相關操作經驗的醫師完成。
1.3病理分級和免疫組織化學 取乳腺癌患者術后組織病理標本,石蠟包埋,連續切片,層厚4 μm,根據WHO乳腺腫瘤分類標準進行組織學分級[6]。全自動免疫組織化學法或原位雜交染色法測定孕激素受體(PR)、雌激素受體(ER)、細胞增殖抗原標記物(Ki-67)和人類表皮生長因子受體-2(HER-2)的表達情況。HER-2表達根據美國臨床腫瘤學會/美國病理醫師學院發布的檢測指南[7]評價為陰性或陽性,Ki-67蛋白陽性表達為細胞核內棕黃色顆粒>15%,若≤14%則為陰性表達。
1.4分子分型標準 根據《中國抗癌協會乳腺癌診治指南與規范(2019年版)》[8]將乳腺癌病灶分為Luminal A型、Luminal B型、三陰性乳腺癌(TNBC)和HER-2過表達型。
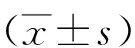
2 結果
2.1病理類型與分子分型 本研究112個病灶中,根據病理類型分為浸潤性導管癌87個(77.68%)、浸潤性小葉癌9個(8.04%)、導管內癌7個(6.25%)、黏液腺癌6個(5.36%)、其他3個(2.68%);根據分子分型分為Luminal A型47個(41.96%)、Luminal B型36個(32.14%)、HER-2過表達型21個(18.75%)、TNBC 8個(7.14%)。其中病理類型以浸潤性導管癌最多,占比77.68%;分子分型以Luminal A型病灶最多,占比41.96%。
2.2不同分子分型乳腺癌病灶的Emax、Emean值比較 Luminal A型、Luminal B型、TNBC和HER-2過表達型病灶的Emax、Emean值比較差異有統計學意義(P<0.01);TNBC和HER-2過表達型病灶的Emax、Emean值均高于Luminal A型(P<0.05);但與Luminal B型比較差異無統計學意義(P>0.05)。見表1。

表1 不同分子分型乳腺癌病灶的Emax、Emean值比較
2.3不同臨床病理特征乳腺癌病灶的Emax、Emean值比較 不同組織學分級、腫瘤直徑及HER-2表達乳腺癌病灶的Emax、Emean值比較差異均有統計學意義(P<0.05,P<0.01)。不同病理類型、PR、ER、Ki-67表達乳腺癌病灶的Emax、Emean值比較差異無統計學意義(P>0.05)。見表2。

表2 不同臨床病理特征乳腺癌病灶的Emax、Emean值比較
2.4Pearson相關性分析 Emax、Emean值與分子分型、組織學分級、腫瘤直徑、HER-2表達均呈顯著正相關(P<0.05,P<0.01)。見表3。

表3 Emax、Emean值與乳腺癌不同分子分型及臨床病理的Pearson相關性分析
3 討論
乳腺癌是一種具有多樣化影像學特征的乳腺惡性腫瘤,有研究指出,病灶硬度與其惡性程度存在密切相關性[9]。同時,因乳腺癌腫瘤組織分子表達不同,且病理學特征亦有差異,故需根據不同分子分型給予對應的治療方法,方能達到改善患者預后的效果[10]。專家共識指出,免疫組織化學檢查是判斷乳腺癌分子分型的公認標準,但由于該檢查為侵入性操作,具有一定的局限性。SWE是一種脈沖聲波下的觸診技術,能夠通過定量分析系統收集到的彈性模量值,客觀判斷組織的硬度變化,已被廣泛應用于甲狀腺、乳腺腫瘤的臨床診斷[11-12]。
國內有研究報道,乳腺癌病灶中Luminal A型占比為47.19%[13]。本研究結果顯示,112個乳腺癌病灶中有87個為浸潤性導管癌,占比77.68%;而分子分型中Luminal A型病灶占比41.96%,與上述研究結果相似。乳腺癌進展期周圍結締組織不斷增生,腫瘤內血管持續生長,可使腫瘤體積變大,且硬度也隨之增強。既往研究也曾發現,與HER-2和Ki-67陽性組比較,上述因子陰性組的Emax值明顯降低[14-15]。而本研究結果顯示,與Luminal A型比較,TNBC和HER-2過表達型病灶的Emax、Emean值均有明顯升高,提示Emax、Emean值與乳腺癌的分子分型存在一定關聯。而Pearson相關性分析結果也進一步證實了Emax、Emean值與乳腺癌的分子分型呈顯著正相關。考慮原因為HER-2過表達型乳腺癌生長速度快且局部侵襲度高,病理表現為微血管密度高及淋巴細胞浸潤,故而該類型乳腺癌病灶硬度也較Luminal A型高;TNBC病灶多為浸潤性導管癌,且直徑較大,組織學分級較高,惡性化程度更高,硬度也更大[16]。且上述2種分子分型的乳腺癌極易復發、轉移,該類患者的預后較差,為臨床診治增加了難度。
有研究指出,預后較差的分子分型與Emax值具有密切相關性[15]。本研究結果也發現,高組織學分級乳腺癌病灶的Emax、Emean值高于低組織學分級;Pearson相關性分析結果表明,SWE彈性模量值與組織學分級呈正相關。乳腺癌組織學分級標準包括核分裂計數,提示高組織學分級病灶內的細胞排列更緊密,亦有更高的硬度。表明Emax、Emean值能夠有效地判斷乳腺癌惡性程度,從而彌補常規超聲的不足。國內外研究也表明,腫瘤大小與硬度有關,且腫瘤大小可影響Emax值[14,17],而本研究結果也顯示,腫瘤直徑較大(>1.5 cm)病灶的Emax、Emean值高于腫瘤直徑較小者,且呈顯著正相關。考慮原因為當病灶直徑較大時,其周圍增生的結締組織也更多,加之直徑較大腫瘤內部有更多的微血管形成及間質水腫,故可影響彈性模量值。國內研究指出,ER陰性表達情況下,HER-2陽性患者SWE的楊氏模量值明顯更高,且其多模態超聲圖像也存在差異[18]。而本研究也發現,Emax、Emean值與HER-2陽性表達有關。可能是因為HER-2陽性表達會引起細胞外基質中蛋白質積聚,而細胞外基質可通過膠原交聯調節自身結構,并增加腫塊硬度,這種調節機制還可促進腫瘤細胞的遷移。有研究指出,Ki-67的表達與乳腺癌淋巴結轉移及患者的生存率有關,Ki-67表達水平越高,乳腺癌病灶惡性度越大,易發生侵襲,還可促進微血管增殖[19-21]。但本研究結果則表明,Ki-67表達與Emax、Emean值無明顯相關性,考慮原因可能與樣本納入標準及檢測方法的不同有關;此外,還可能由于導管內的病灶直徑較大,SWE的測量也存在偏差,加之部分最硬處測量點難以準確選擇,也可能產生測量偏差。如進行SWE時探頭加壓明顯,也會影響彈性模量值的測量準確性,使之產生偽像。因此,操作時需調整量程,減少由測量點選擇引發的誤差;并避免對乳腺組織加壓,保證患者屏住呼吸,以確保測量的準確性,減少誤診、漏診率[22-23]。
綜上所述,Emax、Emean值與分子分型、組織學分級、腫瘤直徑及HER-2表達呈顯著正相關,臨床可將Emax、Emean值作為判斷乳腺癌病情的有效指標。但本研究尚存不足之處,如研究樣本較小,未深入分析Emax、Emean值對高侵襲度分子分型乳腺癌的預測價值等,還需進一步的大樣本研究檢驗。

