顱腦單體素MR波譜診斷足月新生兒高膽紅素血癥及急性膽紅素腦病
賴 偉,徐鳳丹,黎倩儀,范 淼,梁潤球,吳婷婷,李登輝,李 寧,劉建新*
[1.東莞市兒童醫院(東莞市第八人民醫院)放射科,2.新生兒重癥監護室,廣東 東莞 523325;3.廣東醫科大學兒科學教研室,廣東 東莞 523808;4.中山大學附屬第一醫院放射科,廣東 廣州 510080]
新生兒高膽紅素血癥(neonatal hyperbilirubinemia, NHB)發病率高、預后良好,但若病情進展快或處理不及時可致急性膽紅素腦病(acute bilirubin encephalopathy, ABE),甚至遺留神經系統癥狀。既往研究[1-2]發現血清總膽紅素(total bilirubin, TBIL)峰值與蒼白球T1WI信號強度呈弱正相關,與蒼白球/殼核T1WI信號比值呈強正相關。目前研究多針對多體素MR波譜(MR spectroscopy, MRS)參數與NHB的相關性,而對單體素MRS的相關報道較少。谷氨酰胺、谷氨酸(glutamine and glutamate, Glx)及肌醇(myo-inositol, MI)等代謝物于短TE單體素MRS中顯示較佳。本研究采用顱腦單體素MRS結合LCModel軟件分析NHB新生兒蒼白球區代謝物,觀察單體素MRS診斷NHB及ABE的價值。
1 資料與方法
1.1 研究對象 收集2017年6月—2020年5月91例于東莞市兒童醫院因各種疾病而接受MRS掃描的足月新生兒,男57例,女34例,日齡1~28天,平均(9.58±5.23)天;排除罹患缺血缺氧性腦病、低血糖腦病、新生兒感染、神經系統畸形或MRS圖像質量較差者。檢查前監護人均簽署知情同意書。
1.2 儀器與方法 檢查前經胃管注入水合氯醛(0.5 ml/kg體質量)和苯巴比妥(5~8 mg/kg體質量)鎮靜。采用GE Brivo 355 1.5T MR掃描儀,8通道頭頸聯合線圈,使患兒仰臥、頭先進,采集顱窩底至顱頂水平TIW1和MRS圖像。參數:軸位自旋回波(spin echo, SE)T1W,TE 20 ms,TR 822 ms,層厚4 mm;MRS,采用單體素1H點分辨自旋回波波譜序列,TE 35 ms,TR 1 500 ms。參照軸位T1WI,于MRS圖像上左側蒼白球區設置體素為15 mm×15 mm×15 mm的ROI(圖1)。
圖1 顱腦單體素MRS圖 于左側蒼白球區設置體素為15 mm×15 mm×15 mm的ROI(方框)
1.3 數據后處理 導出單體素MRS數據,采用LCModel 6.3軟件進行后處理。分析蒼白球區代謝物肌酸(creatine, Cr)、N-乙酰天門冬氨酸(N-acetyl aspartate, NAA)、膽堿(choline, Cho)、Glx及MI,計算其絕對濃度及NAA/Cr、Cho/Cr、Glx/Cr和MI/Cr。
1.4 統計學分析 采用SPSS 22.0統計分析軟件。以±s表示符合正態分布的計量資料,以單因素方差分析比較NAA/Cr、Cho/Cr、Glx/Cr和MI/Cr的差異;以LSD-t檢驗行組間兩兩比較;以Pearson法行相關性分析,0≤|r|<0.2為無明顯相關,0.2≤|r|<0.4弱正相關,0.4≤|r|<0.6為中度正相關,0.6≤|r|<0.8為強正相關[3]。繪制受試者工作特征(receiver operating characteristic, ROC)曲線,采用DeLong法評估曲線下面積(area under the curve, AUC),觀察各代謝物診斷NHB及ABE的效能。P<0.05為差異有統計學意義。
2 結果
最終納入70例患兒,男45例,女25例,日齡1~28天,平均(9.54±4.96)天。按血清TBIL峰值[4]分為正常對照組(B0組,含7例非NHB患兒,TBIL<205.2 μmol/L)、輕度NHB組(B1組,205.2 μmol/L≤TBIL<256.5 μmol/L,n=6)、中度NHB組(B2組,256.5 μmol/L≤TBIL<342 μmol/L,n=22)、重度NHB組(B3組,342 μmol/L≤TBIL<427 μmol/L,n=22)和極重度NHB組(B4組,TBIL≥427 μmol/L,n=13);按有無ABE分為ABE組(n=16)與無ABE組(n=54)。
2.1 單體素MRS表現 B0、B1、B2、B3及B4組Cr峰、NAA峰及Cho峰均正常;其中B0組Glx峰較平緩,MI峰較低,余4組Glx峰和MI峰均升高(圖2)。Cho/Cr、Glx/Cr和MI/Cr總體差異均有統計學意義(P均<0.05),而NAA/Cr和日齡總體差異均無統計學意義(P均>0.05,表1)。B3與B1、B2組間Cho/Cr差異均有統計學意義(P均<0.05);B0與B1、B2、B3、B4組間,B1與B3、B4組間,B2與B3、B4組間Glx/Cr差異均有統計學意義(P均<0.05);B0與B3、B4組間,B2與B3、B4組間MI/Cr差異均有統計學意義(P均<0.05)。NHB嚴重程度與Glx/Cr呈強正相關(r=0.60,P<0.001),與MI/Cr呈弱正相關(r=0.33,P<0.01),而與Cho/Cr無明顯相關(r=0.17,P=0.16),見圖3。
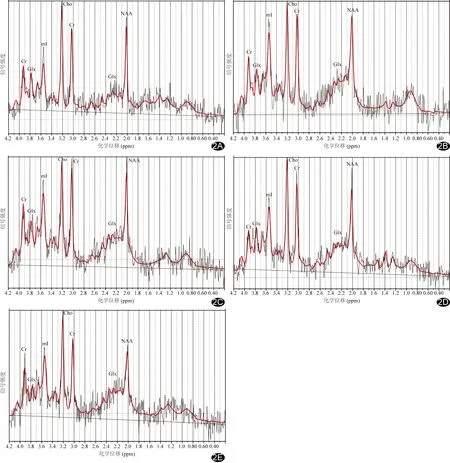
圖2 B0、B1、B2、B3及B4組單體素MRS擬合圖 A.B0組,NAA/Cr=0.92,Cho/Cr=0.41,Glx/Cr=1.34,MI/Cr=0.98;B.B1組,NAA/Cr=0.93,Cho/Cr=0.36,Glx/Cr=1.75,MI/Cr=1.41;C.B2組,NAA/Cr=0.85,Cho/Cr=0.35,Glx/Cr=1.88,MI/Cr=1.24;D.B3組,NAA/Cr=0.83,Cho/Cr=0.40,Glx/Cr=1.92,MI/Cr=1.24;E.B4組,NAA/Cr=0.86,Cho/Cr=0.49,Glx/Cr=2.17,MI/Cr=1.34

圖3 Cho/Cr、Glx/Cr和MI/Cr與NHB嚴重程度的Pearson相關性分析 A.Glx/Cr與NHB嚴重程度呈強正相關;B.MI/Cr與NHB嚴重程度呈弱正相關;C.Cho/Cr與NHB嚴重程度無明顯相關
表1 各NHB組間NAA/Cr、Cho/Cr、Glx/Cr、MI/Cr和日齡比較±s
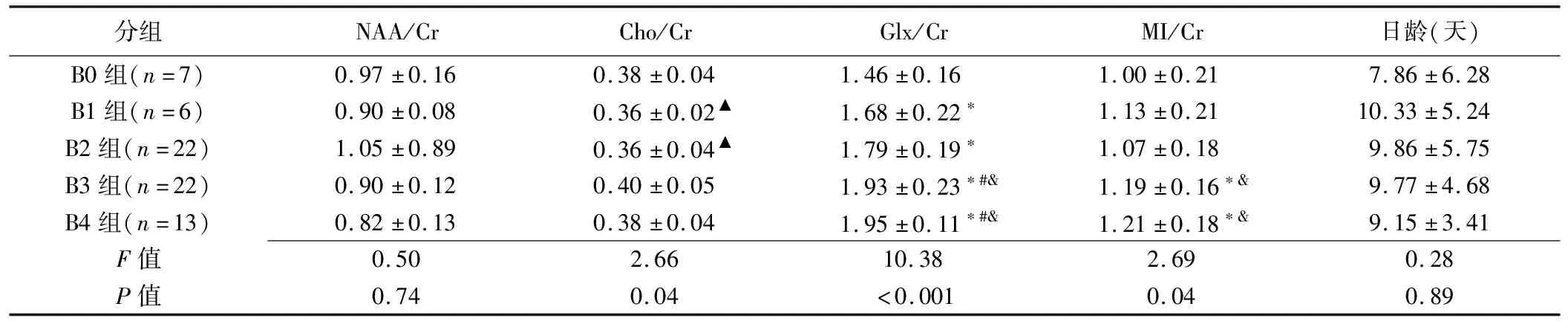
表1 各NHB組間NAA/Cr、Cho/Cr、Glx/Cr、MI/Cr和日齡比較±s
分組NAA/CrCho/CrGlx/CrMI/Cr日齡(天)B0組(n=7)0.97±0.160.38±0.041.46±0.16 1.00±0.21 7.86±6.28B1組(n=6)0.90±0.080.36±0.02▲1.68±0.22?1.13±0.2110.33±5.24B2組(n=22)1.05±0.890.36±0.04▲1.79±0.19?1.07±0.189.86±5.75B3組(n=22)0.90±0.120.40±0.051.93±0.23?#&1.19±0.16?&9.77±4.68B4組(n=13)0.82±0.130.38±0.041.95±0.11?#&1.21±0.18?&9.15±3.41F值0.502.6610.382.690.28P值0.740.04<0.0010.040.89
注:*:與B0組相比,P<0.05;#:與B1組相比,P<0.05;&:與B2組相比,P<0.05;▲:與B3組相比,P<0.05
2.2 Glx/Cr與MI/Cr診斷NHB 將B1、B2、B3和B4整合為≥B1群組(B1+B2+B3+B4)、≥B2群組(B2+B3+B4)、≥B3群組(B3+B4)及B4組,Glx/Cr診斷≥B1群組和≥B2群組NHB的AUC均大于MI/Cr(P均<0.05),Glx/Cr與 MI/Cr診斷≥B3群組和B4組NHB的AUC差異無統計學意義(P均>0.05,表2、圖4)。
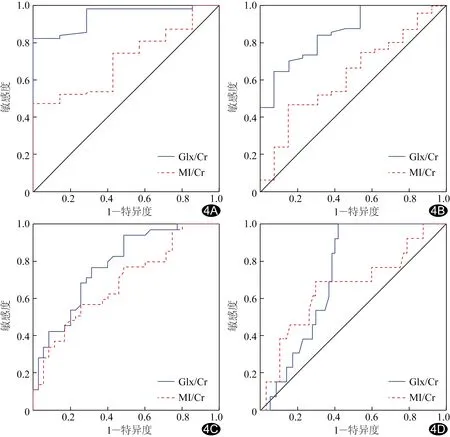
圖4 Glx/Cr和MI/Cr診斷各群組NHB的ROC A.≥B1群組;B.≥B2群組;C.≥B3群組;D.B4組
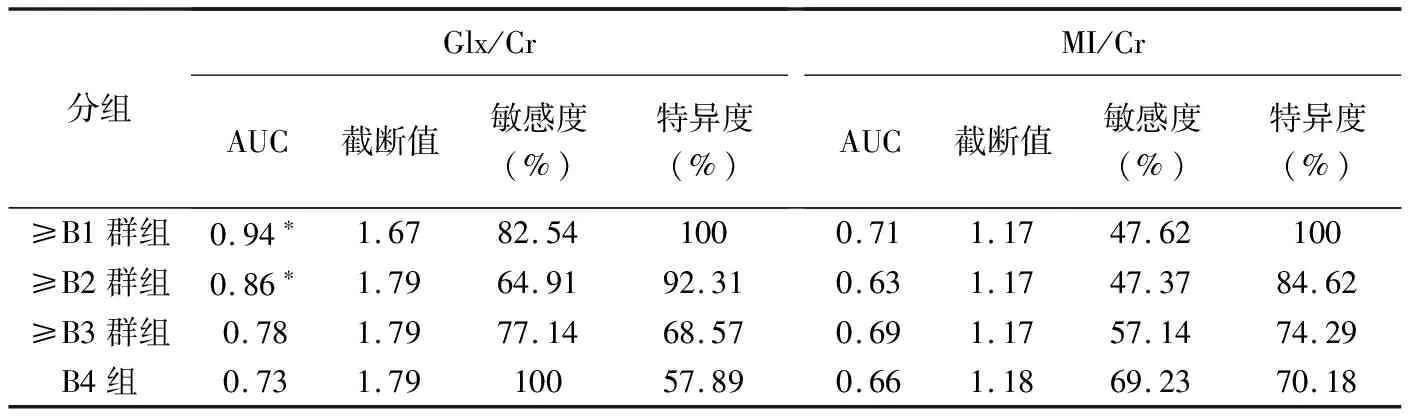
表2 不同群組間Glx/Cr和MI/Cr診斷NHB對比
2.3 Glx/Cr與MI/Cr診斷ABE對比 無ABE組與ABE組間Glx/Cr差異有統計學意義(P<0.05),而MI/Cr及日齡差異均無統計學意義(P均>0.05,表3)。Glx/Cr以1.79為截斷值時,診斷ABE的AUC為0.70,敏感度87.50%,特異度為57.41%。
表3 無ABE組與ABE組間Glx/Cr、MI/Cr和日齡比較(±s)
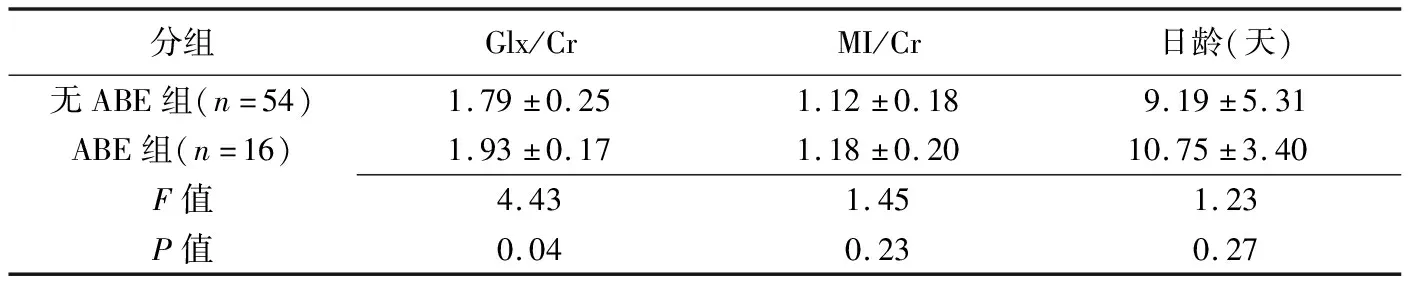
表3 無ABE組與ABE組間Glx/Cr、MI/Cr和日齡比較(±s)
分組Glx/CrMI/Cr日齡(天)無ABE組(n=54)1.79±0.251.12±0.189.19±5.31ABE組(n=16)1.93±0.171.18±0.2010.75±3.40F值4.431.451.23P值0.040.230.27
3 討論
新生兒出生后,體內高氧環境使紅細胞存活時間減少,分解成為大量膽紅素而超出肝臟的處理能力,導致NHB。膽紅素的神經毒性(bilirubin neurotoxicity, BNTx)可使神經過度興奮,干擾神經元突觸間的信息傳遞[5-6],常累及以蒼白球為主的神經核團。NHB大多可逆,但若治療不及時或病情過重,可進展為ABE或核黃疸。單體素MRS信號強度高于多體素MRS,檢測腦代謝物更具優勢。LCModel是定量1H MRS的“金標準”[7],但少見將其用于NHB及ABE的相關報道。
NAA可反映神經元活性及完整性,并隨髓鞘逐漸成熟而不斷升高。Cho可反映細胞膜轉運和磷脂代謝的能力。本研究發現不同程度NHB組間NAA/Cr差異無統計學意義,而B3與B1、B2組間Cho/Cr差異均有統計學意義,即NAA/Cr不能用于診斷NHB,且Cho/Cr診斷效能不佳,與既往研究[1,8-9]結果相符;分析原因,可能在于BNTx致神經元損傷使NAA降低,但同時正常髓鞘化使NAA升高,或未致ABE的NHB患兒表現為神經細胞水腫、凋亡但尚未壞死[10-11],而NHB早期BNTx致髓鞘化延遲而細胞膜尚未破裂亦可能是ABE可逆的原因之一。
MI主要發揮調節滲透壓和營養細胞等作用。Glx是抑制性神經遞質γ-氨基丁酸(γ-aminobutyric acid, GABA)的前體,具有興奮性毒性[7,12]。本研究發現B0與B3、B4組間及B2與B3、B4組間MI/Cr差異均有統計學意義,B0與B1、B2、B3、B4組間,B1與B3、B4組間,B2與B3、B4組間Glx/Cr差異均有統計學意義,且 NHB嚴重程度與MI/Cr呈弱正相關、與Glx/Cr強正相關,與既往研究[1,8-10]結果相符;可能原因在于血清間接膽紅素(indirect bilirubin, IBIL)促進釋放促炎性細胞因子、形成高滲狀態并增加血腦屏障通透性,使IBIL進入腦組織,導致髓鞘化不良[10];蒼白球中谷氨酸受體過度激活、興奮性毒性升高可致膽紅素誘導的神經元損傷,且膽紅素可影響包括谷氨酸轉運蛋白在內的興奮性氨基酸轉運蛋白,延長谷氨酸在突觸間隙中的暴露時間,繼而激活谷氨酸受體,亦可減少線粒體氧化磷酸化,導致線粒體衰竭、Ca2+內流增加,最終致腦細胞水腫、變性、壞死。但也有學者[1]認為MI/Cr與NHB嚴重程度無明顯相關,可能與樣本量、MRS掃描方法及ROI選擇等因素有關。本研究發現≥B1群組和≥B2群組Glx/Cr診斷NHB的AUC均大于MI/Cr,無ABE組和ABE組間Glx/Cr差異有統計學意義、而MI/Cr差異無統計學意義,即Glx/Cr診斷NHB及ABE的效能高于MI/Cr;Glx/Cr≥1.79可提示NHB患兒存在ABE風險,與文獻[1]結果相符。部分處于較低TBIL水平(中度NHB)的患兒亦能發生ABE,提示除TBIL水平之外存在其他影響因素,如低蛋白血癥和與膽紅素競爭結合白蛋白的藥物如布洛芬等[13-15]。
本研究的主要局限性:①樣本量不足,導致組間病例分布差異較大;②未涉及早產兒;③部分極重度患兒因病情緊急,MR檢查前曾接受換血治療;④不同技師放置ROI位置有所不同。
綜上所述,單體素MRS可通過定量分析各代謝物診斷足月新生兒NHB,尤以Glx/Cr的診斷效能最高;Glx/Cr≥1.79提示存在ABE風險。

