散發性前庭神經鞘瘤差異表達基因的鑒定及免疫細胞浸潤分析
劉宇超 黃巧 尹時華
廣西醫科大學第二附屬醫院耳鼻咽喉頭頸外科(南寧530000)
前庭神經鞘瘤(vestibular schwannoma,VS),亦稱聽神經瘤,占顱內良性腫瘤的8-10%,約占橋小腦角腫瘤的80-90%[1]。大多數VS是散發性和單側的,而雙側腫瘤通常與2型神經纖維瘤病(NF2)相關[2]。其中NF2基因編碼的腫瘤抑制蛋白merlin功能喪失是神經鞘瘤發病的重要步驟。而且NF2的雙等位體突變也在部分散發性VS中被發現[3,4]。盡管這些腫瘤在組織學上是良性的,但它們會導致耳聾、耳鳴和面癱,如果發展到很大的規模,會導致腦干受壓甚至死亡[5]。目前,手術治療仍然是較大腫瘤的無可爭議的推薦治療方法,而中小型腫瘤的治療可以通過反復的MRI觀察、手術或放射治療。另外,靶向藥物治療被認為是既控制腫瘤生長,又可避免手術可能造成的面神經功能損傷等不良預后的治療手段[6]。然而與神經纖維化2型相關VS已經存在靶向血管內皮生長因子的單抗型血管生成抑制劑不同,散發性VS至今沒有合適的藥物治療,這與散發性VS的生長速度和大小上表現出很大的變異性有關[7,8]。
幾十年的研究已經在許多方面對VS的生長機制進行了探討。例如神經鞘瘤發生的“四次打擊-三個步驟”的遺傳機制,即首先發生一個生殖系基因SMARCB1突變,然后伴隨著包含第二個SMARCB1等位基因和一個NF2基因突變的22號染色體的一部分損失,最后剩余的野生型NF2基因也發生突變,從而導致疾病的發生[9,10]。另外,MEK/JUK等基因參與的merlin蛋白磷酸化失活[11]、miR-21/miR-7等microRNA表達模式異常[12,13]等表觀遺傳的改變也被學者們證明與VS的發生發展相關。除此之外,近年的研究發現免疫細胞的浸潤與散發性VS生長和血管生成顯著相關[14,15],提示在惡性腫瘤的生長和侵襲中發揮關鍵作用的浸潤免疫細胞[16,17]可能在散發性VS的生長機制中也充當重要角色。然而之前的免疫細胞在VS中的研究存在著相對狹隘的思路及技術缺陷,所以本研究將基于生物信息學方法通過分析Gene Expression Omnibus(GEO)數據庫中散發性VS的芯片表達數據,通過鑒定差異表達基因(differentially expressed genes,DEGs)以及利用科學的CIBERSORT方法[18]初步了解樣本中浸潤免疫細胞的情況,為散發性VS的分子機制研究和藥物靶點的篩選提供新思路。
1 材料與方法
1.1 數據下載
從GEO數據庫下載散發性VS相關數據集GSE141801、GSE108524和GSE39645,僅篩選出散發性VS及正常的神經組織樣本用于后續分析。
1.2 差異表達基因的鑒定
首先對GSE141801芯片數據進行標準化處理,然后使用limma R包篩選DEGs,篩選標準為adj.Pvalue小于0.05及|log2FC|大于1,并繪制火山圖和熱圖。隨后用clusterProfiler包對DEGs進行基因本體論(Gene ontology,GO)功能注釋和京都百科全書基因與基因組(Kyoto Encyclopedia of Genes and Genomes,KEGG)途徑分析,其中GO分析包括生物過程(biological process,BP)、細胞成分(cellular component,CC)和分子功能(molecular function,MF)三個功能組。篩選標準為調整后的P值小于0.05。
1.3 免疫細胞浸潤分析
為增加免疫細胞浸潤分析可用樣本的數量,提高結果的準確性,將GSE141801、GSE108524和GSE39645進行合并,使用limma R包對數據進行批次矯正,并用聚類分析判斷矯正效果。隨后應用CIBERSORT得到每個樣本的22種免疫細胞的含量矩陣,篩選出P值小于0.05的樣本。隨后用pheatmap包繪制熱圖;用vioplot包繪制小提琴圖;用corrplot包繪制免疫細胞相關性熱圖;最后進行主成分分析,并用ggplot包可視化。所有分析均在R軟件(版本3.6.3)上完成。
2 結果
2.1 樣本信息
經過篩選,共得到46例腫瘤組織及19例正常神經組織的樣本數據,其中GSE141801貢獻36例散發性VS組織和7例正常神經組織,GSE108524貢獻10例散發性VS組織和4例正常神經組織,GSE39645貢獻8例正常神經組織。
2.2 差異表達基因的篩選與鑒定
經過計算,共找到DEGs 1828個,其中上調基因939個,下調基因889個,火山圖見圖1A,熱圖如圖1B所示,可以看出DEGs在散發性VS與正常組織間的表達具有顯著差異。
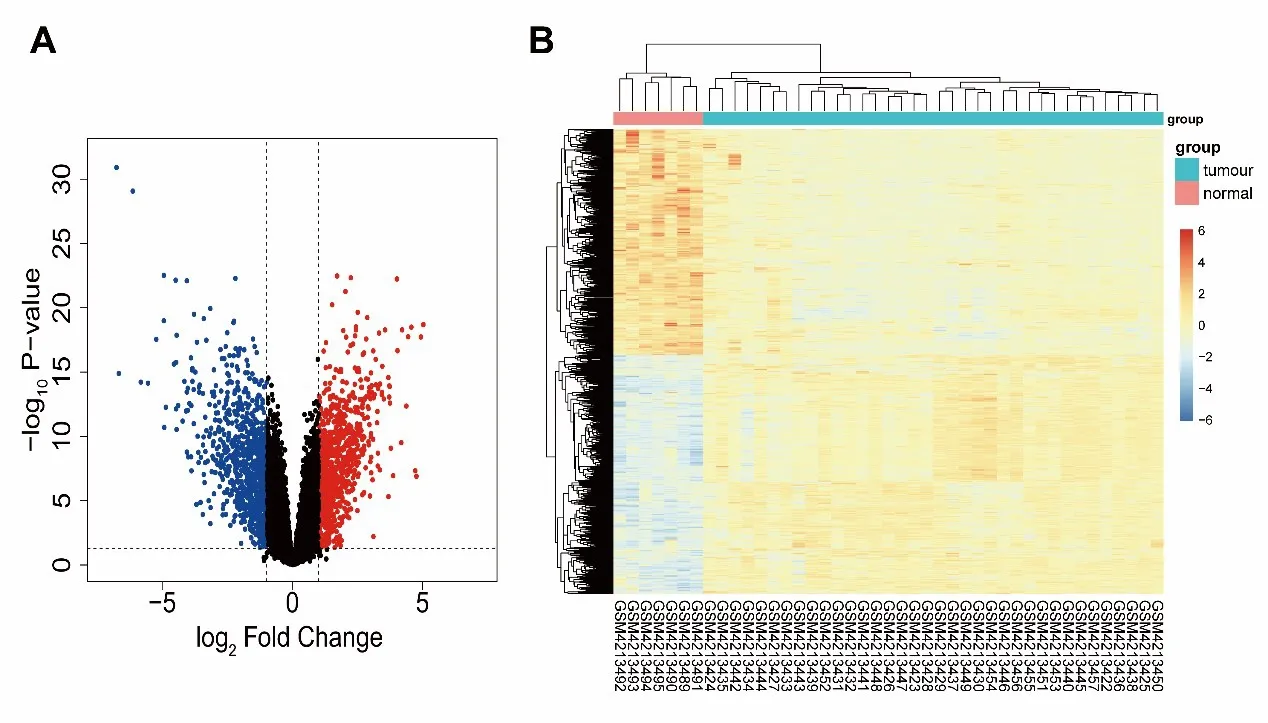
圖1 DEGs的火山圖和熱圖A為差異基因的火山圖,紅色代表上調的基因,藍色代表下調的基因。B為差異基因的熱圖,橫軸代表每個樣本,縱軸代表差異基因,紅色代表高表達,藍色代表低表達。Fig.1 The volcano plot and heat map of DEGs.A is the volcano plot of the DEGs.Red represents up-regulated genes and blue represents down-regulated genes.B is the heat map of DEGs,the horizontal axis represents each sample,the vertical axis represents the differentially expressed genes,the red represents the high expression,and the blue represents the low expression.
GO功能注釋結果顯示(圖2A)DEGs在BP中主要富集于細胞激活、T細胞活化、細胞粘附的正向調節、白血球細胞?細胞粘附以及白細胞、淋巴細胞和單核細胞增生與調控;在CC中主要富集于膠原蛋白?包含細胞外基質、細胞連接和胞質囊腔;在MF中主要富集于受體配體活動、細胞粘附分子結合和細胞因子受體結合。KEGG通路分析結果顯示(圖2B)DEGs主要富集在細胞因子?細胞因子受體的相互作用、MAPK信號通路、Ras信號通路和細胞粘附分子等通路。


圖2 DEGs的GO分析(A)和KEGG通路分析(B)。圓圈大小代表基因富集的數目,圓圈越大表示富集的基因越多;顏色代表富集的程度,顏色越紅,代表富集程度越高。Fig.2 GO functional annotation(A)and KEGG pathway analysis(B)of the obtained differential genes.The circle size represents the number of gene enrichment.The larger the circle is,the more genes are enriched.The color represents the degree of enrichment,and the redder the color,the higher the degree of enrichment.
2.3 免疫細胞浸潤分析結果
經過計算及篩選,最后得到7例腫瘤組織樣本和8例正常神經組織樣本的免疫細胞含量矩陣。在隨后的分析中,熱圖(圖3)顯示M2型巨噬細胞及激活的肥大細胞在樣本中含量較高。小提琴圖(圖4)顯示與正常神經組織相比,散發性VS中的M2型巨噬細胞、活化的肥大細胞、未活化的CD4+記憶性T細胞以及嗜酸性粒細胞的比例顯著增多(P<0.05);而CD8+T細胞、幼稚CD4+T細胞、調節性T細胞以及中性粒細胞的比例顯著減少(P<0.05)。22種免疫細胞的相關性熱圖(圖5)顯示構成比相關系數較大的免疫細胞包括嗜酸性粒細胞和活化的肥大細胞(0.76),幼稚CD4+T細胞和中性粒細胞(0.83),活化的CD4+記憶性 T細胞和CD8+T細胞(0.81),中性粒細胞與M2型巨噬細胞(-0.7),調節性T細胞與M2型巨噬細胞(-0.7),未活化的CD4+記憶性T細胞與調節性T細胞(-0.76)。最后二維主成分分析結果顯示22種免疫細胞的含量能很好的區分散發性VS和正常神經組織(圖6)。

圖3 免疫細胞浸潤的熱圖。橫軸代表樣本,藍色部分為正常組織,紅色部分為腫瘤組織;縱軸代表22個免疫細胞。顏色代表免疫細胞的含量,顏色越紅表示該免疫細胞含量越多。Fig.3 Heat map of immune cell infiltration.The horizontal axis represents the sample;The vertical axis represents 22 immune cells.The color represents the amount of immune cells,and the redder the color,the more immune cells there are.

圖4 散發性vs及正常組織中免疫細胞占比小提琴圖。橫軸為22個免疫細胞,藍色代表正常神經組織,紅色代表散發性前庭神經鞘瘤組織,縱軸為細胞占比。Fig.4 The violin plot of the proportion of immune cells in sporadicⅤS and normal tissue.There are 22 immune cells on the horizontal axis,the blue column represents normal nerve tissue,and the red column represents sporadic vestibular schwannoma tissue.The vertical axis is the proportion of cells.

圖5 22種免疫細胞浸潤的相關性熱圖。紅色表示正相關,藍色表示負相關,顏色越深,相關性越強;橫坐標和縱坐標均表示22種免疫細胞。Fig.5 Heat map of immune cell infiltration.Red means positive correlation,blue means negative correlation,the darker the color,the stronger the correlation;The X-axis and Y-axis represent 22 types of immune cells.

圖6 二維主成分分析聚類圖。。綠色圓點表示腫瘤樣本,紅色圓點表示正常樣本。Fig.6 Two-dimensional principal component analysis cluster diagram.Green dots represent tumor samples and red dots represent normal samples.
3 討論
由于散發性VS生長過程中復雜的變異性,讓其藥物開發充滿挑戰。雖然近年針對NF2基因和其編碼的merlin蛋白等靶標的機制研究有一定進展,但距離精確控制聽神經瘤生長仍很遙遠。在這項研究中,我們基于GEO數據庫的挖掘對DEGs進行鑒定發現散發性VS在T細胞活化、白血球細胞?細胞粘附以及白細胞、淋巴細胞和單核細胞增生與調控等免疫細胞相關功能中顯著富集,KEGG分析也顯示DEGs在細胞因子和細胞因子受體相關信號通路顯著富集。細胞因子往往通過炎癥反應、自由基和信號通路直接或間接影響腫瘤細胞,在腫瘤發生和發展的不同免疫階段、抗原處理和遞呈中表現出不同的作用[19],而細胞因子又往往是免疫細胞的產物,因此免疫細胞具有成為散發性VS藥物治療靶點的潛力。
在惡性腫瘤中,腫瘤微環境中的各種免疫細胞的浸潤比例與臨床結果密切相關并影響腫瘤對治療的反應已在許多研究中被證實[17,20],盡管VS是良性腫瘤,但近年多項研究證實了炎癥反應和免疫細胞的狀態與散發性VS的生長及血管生成密切相關[14,15,21,22]。說明控制VS中的免疫細胞狀態及炎癥或許能成為治療VS的手段之一。然而這些研究多依賴于流式細胞儀和免疫組化對細胞表面標記物的識別來檢測單個免疫細胞,會導致一定程度的細胞丟失和結果偏倚。而基于最先進的去卷積算法的CIBERSORT軟件能更精確地解決不同浸潤免疫細胞亞群在樣本中的浸潤情況,在細胞異質性研究中具有顯著優勢[23,24]。
于是我們利用CIBERSORT方法,比較了散發性VS與正常神經組織間22個免疫細胞亞群的變化,發現兩組間的免疫細胞具有顯著差異。其中M2型巨噬細胞是浸潤最多的免疫細胞。與M1型巨噬細胞通過分泌白介素12,白介素16和干擾素-γ等促炎細胞因子來激活炎癥反應,參與宿主固有免疫,抑制腫瘤生長不同[25,26],M2型巨噬細胞主要分泌白介素10和轉化生長因子-β等細胞因子來抑制炎癥,抑制T細胞增殖和分化,并促進腫瘤細胞增殖和腫瘤基質的血管生成[27,28]。CD163是M2型巨噬細胞的特異性標志物,Vries等人通過免疫熒光染色發現所有VS樣本均顯示一定程度的CD163免疫陽性并且CD163在快速生長腫瘤中的表達明顯高于緩慢生長腫瘤,同時在高表達CD163的腫瘤中,微血管密度的程度顯著增高[15]。這些發現都說明M2型巨噬細胞浸潤可能是VS的進行性生長的重要因素,可以成為潛在的藥物治療靶點。激活的肥大細胞是另一個顯著增加的免疫細胞,一般情況下腫瘤微環境中的肥大細胞具有抗腫瘤的特性。一旦激活和脫顆粒,它們會變得高度促炎,并積極招募先天免疫系統的細胞,以協調抗腫瘤免疫反應[29],同時肥大細胞通過釋放血管內皮生長因子等經典促血管生成因子和糜蛋白酶等非經典促血管生成因子,積極參與血管生成[30],所以肥大細胞也可能成為散發性VS的有效治療靶點。除此之外,未活化的CD4+記憶性T細胞在散發性VS中也顯著增多,其作為T細胞的一個亞群,可進一步分化,并能輔助CD8+T細胞發生腫瘤排斥反應,抑制對自身和外來抗原的有害免疫反應,甚至阻斷CD8+T細胞的活化和殺傷NK細胞[31,32],我們推測未活化的CD4+記憶性T細胞可能也在散發性VS的發生發展中起著關鍵作用。
另外值得注意的是,顯著減少的免疫細胞主要集中在CD8+T細胞、幼稚CD4+T細胞以及調節性T細胞等T細胞亞型,而近期的研究表明T細胞衰竭與許多慢性疾病的預后不良有關[33],提示T細胞的缺失參與了免疫系統逃避機制,結合我們的研究結果,提示T細胞衰竭或許也參與了散發性VS的腫瘤免疫逃避,從而促進了腫瘤的生長。
此外,我們還發現某些免疫細胞間具有顯著相關性,這可能為后續免疫細胞在VS的研究提供思路。更重要的是我們通過主成分分析證明免疫細胞的變化作為散發性VS的一個內在特征可以表現出個體差異,具有重要的臨床意義。
總之,我們通過生物信息學的方法,對散發性VS的芯片數據進行了分析,發現差異表達基因主要富集于免疫相關通路及生物學過程,同時我們首次揭示了散發性VS中22種免疫細胞的浸潤情況,發現M2型巨噬細胞、肥大細胞、未活化的CD4+記憶性T細胞、CD8+T細胞、幼稚CD4+T細胞和調節性T細胞等免疫細胞可能參與了散發性VS的發生發展,這些發現為免疫細胞在散發性VS的分子機制研究提供了理論依據,也為靶向藥物的開發提供了新的視角。

