關注外界條件對氧化性強弱的影響
馬潔

摘 要:通過具體實例認識到物質氧化性、還原性的強弱受外界條件影響,并非一成不變。分析高考典型試題,試從高考題的功能價值引導平時的學習實踐,概念學習要注重真實情境、發展學科思維、形成學科觀念。
關鍵詞:氧化還原反應;影響因素
一、問題的提出
事實1:制“消毒液”的原理是將氯氣通入燒堿溶液,反應如下:
Cl2+2OH-=Cl-+ClO-+H2O
事實2:“消毒液”與“潔廁靈”不能混用,否則產生有毒的氯氣,反應如下:
Cl-+ClO-+2H+=Cl2↑+H2O
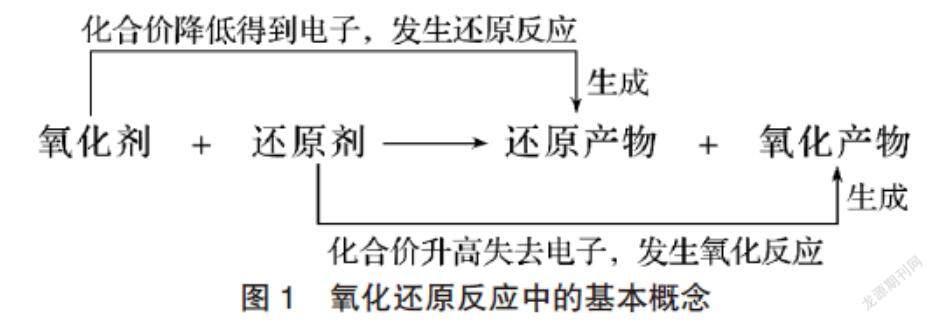
氧化還原反應是高中化學課程中的核心概念,高三學生通過對氧化還原本質的不斷深入認識,已經能夠清晰氧化還原反應中的各組概念(圖1),并建立起氧化還原反應的認識模型。然而,面對上述兩個反應事實,他們仍然十分困惑,根據氧化還原反應中的強弱規律,即氧化性:氧化劑>氧化產物;還原性:還原劑>還原產物。事實1中,氧化性:Cl2>ClO-;事實2中,氧化性:ClO->Cl2。
為何在以上兩個反應中,Cl2與ClO-的氧化性強弱出現了反轉?可見,物質氧化性、還原性的強弱受外界條件影響,并非一成不變。那么影響氧化還原反應發生的因素有哪些,高考題中又是如何考查的?
二、影響氧化性還原產物的因素
(一)溶液酸堿性
對比上述兩個反應條件,不難發現溶液酸堿性不同。酸性環境中,Cl2的氧化性大于ClO-,而堿性環境中,ClO-的氧化性大于Cl2。又如:KMnO4是一種常見的氧化劑,它在酸性、中性及堿性溶液中表現出強弱不同的氧化性,還原產物也因此各不相同。酸性環境中,MnO4-是很強的氧化劑,可以氧化Fe2+、Cl-、I-、SO等離子,還原產物為Mn2+。
2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O
在中性、弱堿性溶液中,MnO氧化能力下降,反應時被還原為MnO2。
2MnO4-+3SO32-+H2O=2MnO2↓+3SO42-+2OH-
在弱堿性溶液中,MnO被還原為MnO42-。
2MnO4-+SO32-+2OH-=2MnO42-+SO42-+2H2O
例1(2012江蘇卷第16題節選)生產中溶液需保持弱堿性,在酸性溶液中Ca(NO2)2會發生分解,產物之一是NO,其反應的離子方程式為 。
(2012江蘇卷第18題節選)H2O2與KMnO4反應的離子方程式如下:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑。若不加稀硫酸酸化,MnO4-被還原為MnO2,其離子方程式為? ? 。
分析:以上兩空均是信息給予型方程式書寫,前者題給信息是酸性溶液中,NO2-發生歧化,不穩定。根據還原產物是NO,可推知氧化產物應為NO3-,可得:3NO2-+2H+=NO3-+2NO↑+H2O。后者已知MnO4-被還原為MnO2,且題中示范了H2O2的氧化產物為O2,可得:2MnO4-+3H2O2=2MnO2↓+3O2↑+2OH-+2H2O。
例2(2010 江蘇卷第 18 題節選):正極材料為LiCoO2的鋰離子電池被廣泛用作便攜式電源。但鈷的資源匱乏限制了其進一步發展。
(1)橄欖石型LiFePO4是一種潛在的鋰離子電池正極材料,它可以通過(NH4)2Fe(SO4)2、H3PO4與LiOH溶液發生共沉淀反應,所得沉淀經80℃真空干燥、高溫成型而值得。共沉淀反應投料時,不將(NH4)2Fe(SO4)2和LiOH溶液直接混合的原因是? ? 。
分析:本題考查Fe2+在不同介質中還原性的強弱。有實驗事實為證:在空氣中,向含有Fe2+的溶液中滴加NaOH溶液,生成白色絮狀沉淀,迅速變為灰褐色,最終變為紅褐色。這一實驗現象說明Fe2+在堿性環境中還原性更強。此處可回答Fe2+在堿性條件下更易被氧化。
上述例1中的兩個方程式書寫難度均不大,它們基于真實情境,取材源于教材、但又不同于教材,這個不同就是由于溶液酸堿性不同。而例2大多數同學都很困惑,認為題給信息太少,難以作答。實際上,大部分教師在講Fe2+的性質時,只講到Fe2+易被氧化,不會細究Fe2+在不同酸堿性條件下還原性的差異。當我們審視高考題的功能價值,會認識到高考題指導教師在平時教學時不僅不能把知識“教死了”,還要帶領學生的建立起“變化觀”,這是化學的主要學科思想。
(二)反應物濃度
氧化還原反應中,有一些反應的產物相當程度的與反應物濃度有關,如硝酸參與的反應。由于硝酸濃度的不同,引起了還原產物的不同,硝酸常被還原為NO2、NO、N2O、NH3等。當然,硝酸的還原產物,除與硝酸的濃度有關,還與還原劑的能力、中間產物(HNO2、NO2)的催化作用有關。
例 3(2019 江蘇卷第 16 題節選):N2O、NO和NO2等氮氧化物是空氣污染物,含有氮氧化物的尾氣需處理后才能排放。
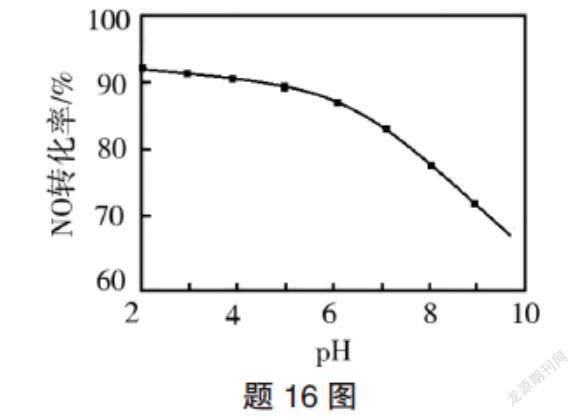
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾氣,可提高尾氣中NO的去除率。其他條件相同,NO轉化為NO的轉化率隨NaClO溶液初始pH(用稀鹽酸調節)的變化如圖所示。
①在酸性NaClO溶液中,HClO氧化NO生成Cl-和NO,其離子方程式為 。
②NaClO溶液的初始pH越小,NO轉化率越高。其原因是 。
分析:該小題討論NaClO溶液通過氧化吸收尾氣NO的問題,考查學生對陌生情境下氧化還原反應的分析及應用能力。根據題給信息,在酸性NaClO溶液中,HClO氧化NO生成Cl-和NO,根據原子守恒、電荷守恒、得失電子守恒,配平離子方程式為3HClO+2NO+H2O=3Cl-+2NO+5H+。
第二問結合題給信息“NaClO溶液的初始pH越小,NO轉化率越高”,首先分析出該題所指NO轉化率并非平衡轉化率,若為平衡轉化率,pH越小,H+濃度越大,平衡應逆向移動,NO轉化率越低。接著就從影響反應速率因素的角度分析,NaClO溶液pH越小,HClO越大,氧化NO能力越強,反應速率越快。
解答此題不僅要求學生能正確選擇從影響反應速率因素的角度回答,而且認識物質的性質要具備一定的變化觀念。
(三)反應溫度
同一氧化還原反應,產物也會因反應的環境溫度高低而不同。如鹵素單質中的Cl2和Br2與強堿反應,低溫或常溫下主要生成鹵化物和次鹵酸鹽,而溫度較高時則生成鹵化物和鹵酸鹽。即:
Cl2+2OH-=Cl-+ClO-+H2O
3Cl2+6OH-5Cl-+ClO+3H2O
例 4(2018 江蘇卷第 19 題節選):以Cl2、NaOH、(NH2)2CO(尿素)和SO2為原料可制備N2H4·H2O(水合肼)和無水Na2SO3,其主要實驗流程如下:
已知:①Cl2+2OH-=ClO-+Cl-+H2O是放熱反應。
②N2H4·H2O沸點約118℃,具有強還原性,能與NaClO劇烈反應生成N2。
制備NaClO溶液時,若溫度超過40℃,Cl2與NaOH溶液反應生成NaClO3和NaCl,其離子方程式為 。實驗中控制溫度除用冰水浴外,還需采取的措施是 。
分析:該小題考查對實驗原理的理解、實驗條件的控制。題中給出了“若溫度超過40℃,Cl2與NaOH溶液反應生成NaClO3和NaCl”的信息,注意反應條件為“△”,可寫出該反應的離子方程式:3Cl2+6OH-5Cl-+ClO+3H2O。
回答該小題后一空考查如何控制反應溫度的操作。首先要明確實驗目的是制備NaClO溶液,為減少雜質NaClO3的生成,就得控制實驗溫度不超過40℃,可從兩方面考慮:一是給反應體系降溫,二是減緩反應放熱的速率。因此,具有可操作性的控制溫度的措施除了除用冰水浴給反應體系降溫外,還可以通過緩慢通入Cl2降低反應速率,以減少反應的熱量,從而達到減少副產品NaClO3生成的目的。
學生回答第二空有困難的原因可能是依據關鍵信息分析解決問題能力薄弱,或控制氣體參加反應的實驗條件的方法類知識缺失,但說到底,還是尚未形成“化學反應是有條件的”的觀念。
三、解題感悟
以上試題列舉了三種常見的影響“氧化還原反應”的因素是溶液酸堿性、濃度、溫度。另外:催化劑的影響、反應物的用量均可能造成影響。“氧化還原反應”的學習貫穿于整個中學化學,具有階段性、層次性和漸進性的特點,能力的培養、觀念的形成不是一蹴而就的。但不管在哪個學習階段,都要積極主動地參與探究活動,深刻理解核心概念和原理,不斷提高頭腦中知識的系統性和概括性水平,逐步領悟并形成化學學科的主要思想。只要真正理解了化學的學科思想,在高三的復習過程中立足知識基礎、增強答題體驗、加強模塊融合,定能從容應答各類試題。
參考文獻
[1]江蘇省教育考試院.2019年高考(江蘇卷)試題分析[M].南京:江蘇人民出版社,2019:175.
[2]江蘇省教育考試院.2018年高考(江蘇卷)試題分析[M].南京:江蘇鳳凰教育出版社,2018:166.
[3]王磊,胡久華.高中化學新課程必修課教與學化學[M].北京:北京大學出版社,2006:75.

