分析2021年八省聯考化學試卷的實驗題及應對新高考備考策略
童文艷
摘 要:作為高三教學的一線教師,深入研究2021年八省聯考試卷,對這八個省份的試卷中的化學實驗與全國卷進行對比,找出異同,明確實驗選擇題和實驗大題考查的知識點,對2021年高考備考指明方向,對高三復習提出有效的備考策略。
關鍵詞:八省聯考;化學卷;實驗題;備考策略
2021年1月份進行了八省(廣東省、湖北省、湖南省、遼寧省、江蘇省、福建省、重慶、河北省)聯考,相當于小高考。在化學試卷中實驗部分,選擇題考查儀器的識別、化學實驗的本操作、裝置的作用、物質的分離提純、物質的檢驗和表格形式考查實驗方案的設計與評價,非選擇題以探究物質的性質、結構、組成與含量及其制備為目的考查反應原理、實驗操作、有關計算及實驗方案的設計與評價,綜合考查學生科學探究與創新意識、科學態度與社會責任的核心素養。現通過對2021年八省聯考化學實驗題的試卷分析來探討實驗題的高考備考策略。
一、2021年八省聯考實驗選擇題的試卷分析
(一)2021年八省聯考試卷與全國卷對比
1.相同的地方:基礎型實驗題與近三年的全國高考題相比,考題的呈現方式相近。近三年的全國I卷理綜化學題中的實驗題考查的主要是常見實驗儀器的使用和操作要點、常見實驗要求如除雜、分離、收集、檢驗等的分析能力,考查學生對課本中出現的化學實驗的熟悉和掌握程度。側重考查學生的化學基本素養。
2.不同的地方:(1)在試卷中的比重不同。近三年的全國I卷理綜化學題中都只有1道實驗類選擇題;新高考卷中則有3道。而八套省聯考試題中實驗類選擇題的題數為1至2題。(2)考查的知識點有所不同。近三年的全國I卷理綜化學題中,2018年考察的是生產和純化乙酸乙酯過程中涉及的操作和裝置;2019年考察的是實驗室制取溴苯中涉及的實驗操作和現象分析;2020年考察的是氣體的除雜方法。
(二)2021年八省聯考實驗選擇題的試題類型及其特點:
Ⅰ—化學實驗常見儀器與基本方法
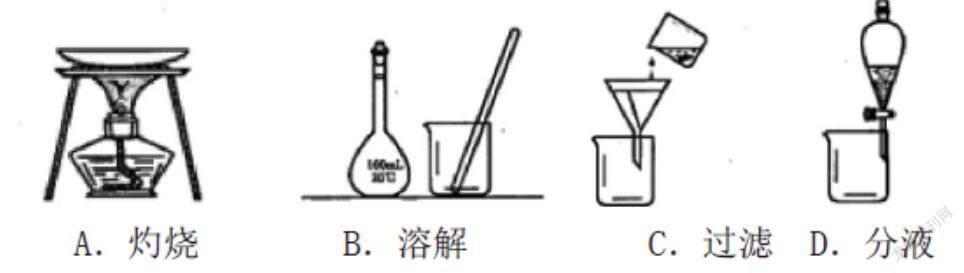
(廣東省)提取海帶中I2的實驗中,所選擇的裝置或儀器(夾持裝置已略去)正確的是( )
答案:D
[考點]本題考查課本實驗--海帶提碘,考查了灼燒、溶解、過濾、分液等常見操作的儀器選用和組裝。難度容易,注意玻璃棒的使用。
Ⅱ—物質的分離、提純與檢驗
(重慶)下列實驗設計正確的是( )
A.用乙醇萃取碘水中的碘
B.用氫氧化鈉溶液除去乙酸乙酯中的乙酸
C.向乙醇和乙酸中分別加入鈉,比較其官能團的活潑性
D.向蔗糖和稀硫酸共熱后的溶液中加入少量銀氨溶液,檢驗生成的葡萄糖
答案:C
[考點]本題考查了常見有機物如乙醇、乙酸、乙酸乙酯、葡萄糖的性質,考查了萃取、除雜、官能團檢驗等常見實驗操作的運用。注意除雜試劑對保留物質的影響,注意連續實驗中先進行的實驗對后進行的實驗的干擾。
Ⅲ—物質的制備和性質
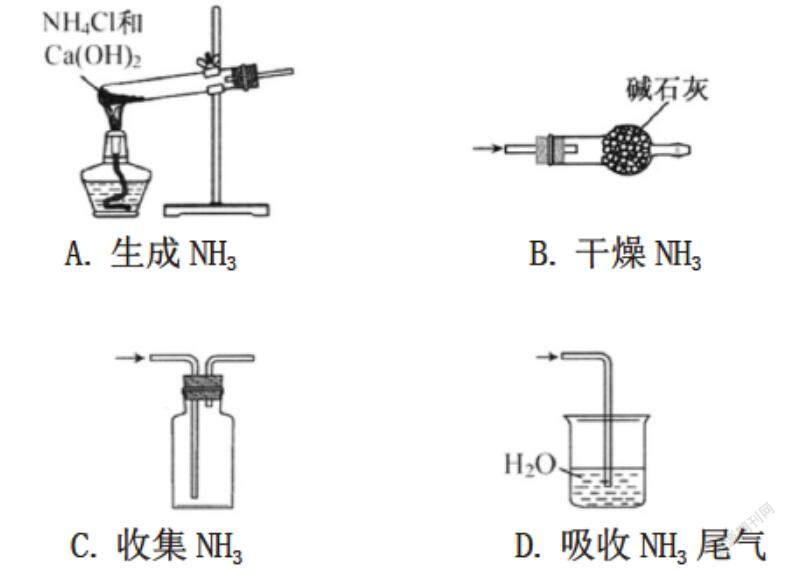
(江蘇省)實驗室制取NH3時,下列裝置能達到相應實驗目的的是( )
答案:B
題析:本題考察實驗室制取氨氣的相關裝置,側重考察了發生裝置、除雜干燥裝置、收集裝置、尾氣處理裝置等重要環節。熟悉掌握氨氣的制備和性質是解題關鍵。
Ⅳ—綜合實驗(實驗方案的設計與評價)
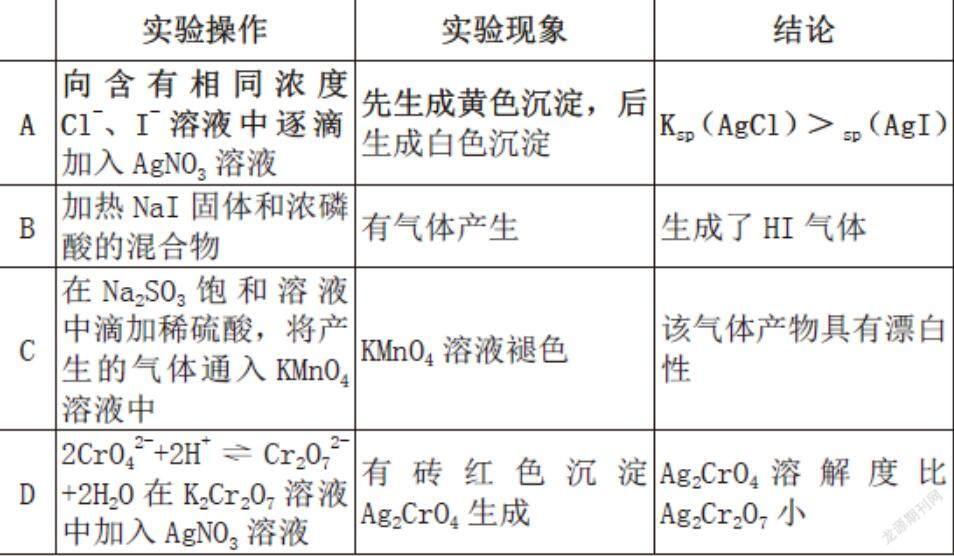
(河北省)下列實驗中,實驗現象與結論不匹配的是( )
答案:C
[考點]本題考查的是元素化合物的性質和沉淀溶解平衡的運用等知識點。
二、2021年八省聯考實驗大題的試卷分析
(一)相同的地方:2021年八省聯考實驗大題在考點的設置上,與2020年三套全國卷,或其他新高考地區的實驗大題考點設置一樣,高頻考點,則集中于以下考點:實驗儀器的名稱和使用;實驗原理方程式的書寫;實驗現象描述;實驗操作表達及實驗目的考查;凡物質制備必會定量分析,通過滴定操作進行純度計算;離子的檢驗。
以上考點涉及的關鍵能力的要求,則與2017版課標的化學學科要求的核心素養是高度吻合的,包括科學探究與創新意識、變化觀念與平衡思想、證據推理與模型認知等核心素養。
同時在命題背景或素材的選擇上,八省聯考中有7個省份均選擇了物質制備型實驗,原理探究性實驗較少,這一點與2020年全國卷、新高考地區實驗大題的命題背景的比例也是吻合的。
(二)不同的地方:八省聯考的省份顯然更注重考生的計算能力的考查,計算考點的設置明顯比2020年各省份命題的頻率要高。
三、實驗題的高考備考策略
(一)實驗選擇題的高考備考策略
1.回歸教材,落實好課本實驗與基本操作。
2.認真分析教材中每一個實驗如實驗目的、實驗原理、實驗過程、實驗結論等。
3.夯實元素化合物基礎知識:熟記物質的性質及轉化、氣體制備等相關方程式。
4.夯實實驗基礎。知識:儀器的名稱與用途、實驗儀器的選擇與連接、混合物的提純、操作的方法及目的、氣體制備和典型有機物制備的各個環節。
(二)實驗大題的高考備考策略
實驗大題主要以化工流程或實驗裝置圖或有機信息為載體,考查實驗條件控制、探究性實驗方案的設計,物質的性質驗證、定量測定實驗的分析等,預計2021年廣東高考仍然會延續這些方面的考查。
[備考策略]
1.回歸教材,對于課本的每一個實驗都要弄清原理、相關的儀器裝置,注重操作細節,對于每個實驗,都要做到:①怎么做?②為什么要這樣做? ③如果不這樣做,會引起什么后果?④還能怎么做?對實驗中所涉及的重要化學方程式和重要實驗現象均應做到熟練。
如:必修1P6的實驗1-2:取[實驗1-1]得到的鹽約0.5h放入試管中,向試管中加入約2mL水配成溶液,先滴入幾滴稀鹽酸使溶液酸化,然后向試管中滴入幾滴BaCl2(氯化鋇)溶液。觀察現象。
[這個實驗必須明確:①怎么樣檢驗SO42-?②用到什么的試劑?稀鹽酸與BaCl2溶液,③為什么要先加稀鹽酸再加BaCl2溶液?稀鹽酸是用來排除其-它離子的干擾。③為什么不用Ba(NO3)2溶液?如果用了會怎么樣?]
2.在復習備考過程中我們可以通過微專題的形式進行復習,可以分為實驗儀器和操作、儀器的連接及作用、離子的檢驗、陌生反應方程式書寫、定量計算等。通過微專題的復習可以很大程度上改變學生盲目復習、苦戰題海、理論無法聯系實際等現狀,“微專題”在專題復習的基礎上更加細化知識,將重點、疑點和難點以“小專題,大訓練”方式突出主干知識。
3.多訓練定量型實驗探究題。定量實驗會涉及定量計算,一般用關系式法,根據化學方程式將某中間物質作為“中介”,找出已知物質和所求物質之間的量的關系。
如:(江蘇實驗題節選)(3)通過下列方法測定產品純度:準確稱取0.5000gCuSO4·5H2O樣品,加適量水溶解,轉移至碘量瓶中,加過量KI溶液并用稀H2SO4酸化,以淀粉溶液為指示劑,用0.1000mol·L-1Na2S2O3標準溶液滴定至終點,消耗Na2S2O3的溶液19.80mL。測定過程中發生下列反應:2Cu2++4I-=2CuI↓+I2、2S2O32-+I2=S4O62-+2I-。計算CuSO4·5H2O樣品的純度(寫出計算過程):____________________________。
[解答]根據關系式CuSO4·5H2O~Na2S2O3,樣品中CuSO4·5H2O物質的量為0.1000mol·L-1×0.0198L=0.00198mol,則CuSO4·5H2O樣品的純度的純度
4.強化讀題審題能力訓練,善于從題目中獲得有用的解題信息。
如:[節選]S2Cl2是一種重要的化工產品。常溫時是一種有毒并有惡臭的金黃色液體,熔點-76℃,沸點138℃,受熱或遇水分解放熱,放出腐蝕性煙氣,易與水反應,300℃以上完全分解。進一步氯化可得SCl2,SCl2是櫻桃紅色液體,易揮發,熔點-122℃,沸點59℃。SCl2與S2Cl2相似,有毒并有惡臭,但更不穩定。實驗室可利用硫與少量氯氣在110~140℃反應制得S2Cl2粗品。
(1)為了提高S2Cl2的純度,實驗的關鍵是控制好溫度和________。
(2)若將S2Cl2放入少量水中會同時產生沉淀和兩種氣體。某同學設計了如下實驗方案,測定所得混合氣體中某一成分X的體積分數:
①W溶液可以是________(填標號)。
a.H2O2溶液 b.氯水
c.酸性KMnO4溶液 d.FeCl3溶液
題干中“進一步氯化可得SCl2”可明確告訴我們:想獲得純凈的S2Cl2,必須控制Cl2的量。“若將S2Cl2放入少量水中會同時產生沉淀和兩種氣體”轉化為化學用語是“2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑”,接著題干信息再次暗示需要將SO2轉SO42-,通過沉淀法測定SO2的含量。
(3)據高考評分標準與我們學生平時考試出現的典型錯誤:引導學生正確審題、規范答題,避免非智力因素失分。加強化學用語規范書寫訓練不該丟掉的分數堅決不丟。套入一些答題模板,提高答題分數。
結束語
化學是一門以實驗為基礎的學科,學生要做好這部分的題目,必須有分析與推測和探究與創新的能力。老師們要認真研究新課程下高考化學實驗試題的特點,從試題中去領略試題的考查意圖和試題命題的方向,從而在教學中有目的地培養學生的實驗創新意識和實驗探究能力,真正做到有的放矢,就能大大提高實驗備考復習效率。只有學生理解掌握了實驗原理,熟悉實驗儀器的性能特點,才可能在高考中做到既能抓住實驗基礎分,又能靈活應對創新實驗題。
參考文獻
[1]李連友.高考化學實驗試題的分析及對高中化學實驗教學的啟示[D].內蒙古師范大學,2012.
[2]劉梅.2013年高考化學實驗題分析和啟示[J].浙江教育技術,2014,000(003):P26-28.
[3]商曉芹.高考化學實驗試題對教學的啟示[J].高中數理化,2012,000(006):51-53.

