牡蠣酶解超濾組分對TM4小鼠睪丸支持細胞的氧化損傷保護作用
張雪妍,秦小明, 2,林海生, 2,曹文紅, 2,鄭惠娜, 2,高加龍, 2,章超樺, 2
(1. 廣東海洋大學食品科技學院,廣東 湛江 524088; 2. 廣東省水產品加工與安全重點實驗室/廣東普通高等學校水產品深加工重點實驗室/國家貝類加工技術研發分中心 (湛江) /南海生物資源開發與利用協同創新中心,廣東 湛江 524088)
近年來男性不育癥的發病率呈逐年升高趨勢,調查顯示全球8%~12%育齡夫婦患有不育癥[1],其中歸因于男性伴侶的占近50%[2]。生殖系統疾病[3]、環境污染[4-5]、內分泌失調[6]和藥物[7]引起的生殖損傷均可導致男性不育。睪丸的生殖激素改變[6]、細胞凋亡[8]、氧化損傷[9]和組織結構異常可能是男性生殖功能障礙的機制。睪丸支持細胞作為睪丸生精的“營養細胞”,為生殖細胞發育、存活和成熟提供微環境,其所形成的血睪屏障可有效保護生殖細胞免受有毒物質的破壞。因此,體外研究睪丸支持細胞對物質的敏感性可能是間接衡量這些物質在精子形成中發揮作用的有效途徑。雷公藤 (Tripterygium wilfordii Hook. f.) 中藥制劑在臨床上長期用于治療炎癥及免疫系統疾病,而雷公藤甲素 (TP,C20H24O6) 作為雷公藤的藥理和毒性作用的主要有效成分[10],其副作用中發生率最高的是生殖毒性[11]。TP攝入過多會導致睪丸萎縮、激素合成代謝紊亂及精子活力下降等[11-12]。研究表明,TP可降低TM4小鼠睪丸支持細胞存活率、增加細胞活性氧 (ROS)蓄積并誘導細胞凋亡途徑的激活[13]。因此,TP的生殖毒性極大限制了其臨床應用。
香港牡蠣 (Crassostrea hongkongensis),俗稱生蠔,因其肉質鮮美,富含蛋白質、糖原、氨基酸、脂肪酸和無機鹽等[14],被冠以“海洋牛奶”的美稱[15]。牡蠣已被我國衛生部批準為藥食兩用材料[16]。牡蠣肉提取物具有抗氧化[17]、增強機體免疫[18]、抗疲勞[19]、抗皮膚光老化[20]、降血壓[21]、降血糖[22]、醒酒護肝[23]和生殖保健[24]等多種生物活性。研究表明,小分子牡蠣多肽可提高小鼠血清性激素水平及其精子質量[25]。Li等[26]發現近江牡蠣 (Ostrea rivularis) 多糖可抑制過氧化氫 (H2O2) 誘導的TM4細胞氧化應激水平,改善環磷酰胺所致小鼠睪丸組織損傷,提高精子存活率并減少精子畸形。可見牡蠣肉提取物具有改善雄性生殖功能的潛能,但其有效成分、作用機理尚不明確。本研究以香港牡蠣為原料,以TM4小鼠 (Mus musculus) 睪丸支持細胞株為研究對象,探究牡蠣酶解超濾組分對TP誘導的TM4小鼠睪丸支持細胞氧化損傷的保護作用,在細胞水平上探討牡蠣酶解超濾組分對TP抗生育作用的減毒效果,以期為研發以牡蠣為原料的改善男性生殖健康的保健功能食品提供理論基礎。
1 材料與方法
1.1 材料與試劑
新鮮香港牡蠣購于湛江海鮮批發市場,動物蛋白酶 (酶活力 3×104U·g?1) 購于廣西南寧龐博生物有限公司,DMED/F12培養基購自Gibco公司,馬血清、青/鏈霉素雙抗購自HyClone公司,噻唑蘭(MTT) 購自 Genview 公司,TP (純度>98%) 購自美倫生物技術有限公司,還原型谷胱甘肽 (GSH) 測定試劑盒和丙二醇 (MDA) 測定試劑盒購自南京建成生物工程研究所,ROS檢測試劑盒和BCA蛋白濃度測定試劑盒均購自碧云天生物研究所,小鼠睪丸支持細胞株 (TM4) 購于廣州賽庫生物技術有限公司。
1.2 儀器與設備
XX42PMINI超濾裝置 (美國 Milipore 公司);Lynx6000高速落地離心機 (美國Thermo公司);R-1005旋轉蒸發儀 (鄭州長城科工貿有限公司);1200型半制備高效液相色譜儀 (美國Agilent公司);7500cx電感耦合等離子體質譜 (ICP-MS,美國Agilent公司);HHT4-LX-C50L型立式壓力蒸汽滅菌器 (北京中西遠大科技有限公司);CKX41型倒置顯微鏡 (日本Olympus公司);SW-CJ-2FD型超凈工作臺 (蘇州凈化有限公司);Forma 370型二氧化碳 (CO2) 恒溫箱 Multiskan FC型酶標儀 (美國Thermo公司);5810R型高速臺式冷凍離心機 (德國 Eppendorf公司)。
1.3 實驗方法
1.3.1 牡蠣酶解產物超濾組分的制備 取新鮮牡蠣肉,經洗凈、瀝干,然后按料水質量體積比1∶3 (g·mL?1) 加入預冷的蒸餾水,高速勻漿,按照酶活和底物 1 000∶1 (U·g?1) 的比例加入動物蛋白酶[27],酶解液沸水浴滅活10 min,冷卻至室溫,最后以 12 000 r·min?1離心 20 min 取上清液,并對其進行超濾分級,利用超濾裝置及3、5、10 ku超濾膜對酶解液進行分級處理,進口壓力控制在60 psi,得到<3、3~5、5~10和>10 ku 4個超濾組分,收集各個組分,冷凍干燥備用。
1.3.2 牡蠣酶解產物超濾組分的分子量分布測定 參考Li等[28]的測定方法,通過高效凝膠過濾色譜法測定牡蠣酶解超濾組分的分子量分布。使用蛋白分析色譜柱 Waters Protein-pak 60A (WAT085250),流動相濃度為 0.05 mol·L?1、pH 8.3的 Tris-HCl緩沖液。將洗脫速度控制在 0.7 mL·min?1,設置柱溫 25 ℃;檢測波長 214 nm,每次進樣 20 μL。
1.3.3 牡蠣酶解產物超濾組分的微量金屬元素測定 銅 (Cu)、鋅 (Zn)、錳 (Mn)、硒 (Se) 微量金屬元素按照GB/T 5009.268—2016,采用微波消解-電感耦合等離子體質譜法進行測定。
1.3.4 TM4細胞的培養 TM4細胞在 D-MEM/F-12培養基 (體積分數92.5%) 中培養,該培養基補充有體積分數5%馬血清和體積分數2.5%優質胎牛血清,37 ℃細胞培養箱中培養 [體積分數5%CO2,濕度95%]。當細胞融合至80%~90%時,用胰酶消化,按照1∶3的比例進行傳代培養,選擇對數生長期的細胞進行實驗。
1.3.5 牡蠣酶解超濾組分對 TM4細胞生長的影響 將 TM4細胞濃度稀釋至 1×104個·mL?1[29],按每孔200 μL接種至96孔板,待細胞生長到融合狀態,小心吸出培養基,每孔加入20 μL含不同質量濃度 (0、50、100、250、500、1 000 μg·mL?1) 的牡蠣酶解超濾組分 (<3、3~5、5~10和>10 ku),每組設置6個平行,并分別培養12和24 h。培養結束后,用磷酸緩沖液 PBS配置 5 g·L?1噻唑藍(MTT) 溶液,每孔加入 20 μL MTT 溶液,并將培養板溫育4 h。小心吸走上清液,向每孔中加入100 μL DMSO,然后搖動 10 min。用酶標儀測量上清液的吸光度值 (測定波長570 nm)。以不加牡蠣酶解超濾組分為空白對照組,按式 (1) 計算細胞存活率 (%)。

式中:R為細胞存活率;A0為空白對照組上清液的吸光度;A1為實驗組上清液的吸光度。
1.3.6 TP對 TM4細胞生長的影響 同 1.3.5的方法,將牡蠣酶解超濾組分換成不同濃度的TP (0、125、250、500、1 000 nmol·L?1)[13]。以不加 TP為空白對照,按式 (1) 計算細胞存活率。
1.3.7 牡蠣酶解超濾組分對TP誘導TM4細胞毒性的保護作用 將 TM4細胞濃度稀釋至 1×104個·mL?1,按每孔 200 μL 接種至 96孔板,待細胞生長至融合狀態時,棄掉舊培養基,設置空白對照組(加入同等體積培養液);TP 模型組 (500 nmol·L?1);牡蠣酶解超濾組分+TP實驗組 (加入不同質量濃度的牡蠣酶解超濾組分),質量濃度分別為50、100、250、500 μg·mL?1;細胞孵育 6 h/12 h 后小心吸出培養液,除空白對照組外均加入含TP的無血清培養液,TP終濃度為 500 nmol·L?1,于 37 ℃、含5% CO2孵育培養箱中培養24 h,采用MTT法測定吸光度值,計算牡蠣酶解超濾組分對TP所致TM4細胞存活率的變化量,每組設定6個復孔。
1.3.8 牡蠣酶解超濾組分對TP誘導TM4細胞的氧化應激損傷的生化檢測 將 TM4細胞濃度稀釋至 1.5×104個·mL?1,按每個 5 mL體積接種至60 mm培養皿中,待細胞生長至融合狀態時,進行分組。實驗組加入不同質量濃度的牡蠣酶解超濾組分,質量濃度分別為 50、100、250 μg·mL?1;空白對照組和TP模型組加入不含樣品的培養基,細胞孵育12 h后小心吸出培養液,除空白對照組外均加入含TP的無血清培養液,TP終濃度為500 nmol·L?1,于 37 ℃、含 5% CO2孵育培養箱中培養24 h。細胞經過不同樣品和TP處理后,收集細胞進行各指標的測定[30]。分別用試劑盒提供的方法測定細胞內GSH和MDA含量。通過BCA蛋白測定試劑盒確定相應的樣品蛋白質含量。
1.3.9 活性氧試劑盒檢測 ROS的生成 將<3 ku超濾組分在不同濃度下提前與TM4細胞培養6 h后,TP (500 nmol·L?1) 作用 TM4細胞造模 3 h[29]。細胞培養達到測定時間,按試劑盒說明將DCFHDA工作液采用無血清培養基稀釋,使其終濃度為10 μmol·L?1。去除含樣品的培養基,每孔加入DCFH-DA 稀釋液 500 μL,避光孵育 45 min。采用無血清培養基洗滌細胞5次,2 min?次?1。細胞采用倒置熒光顯微鏡拍照并保存,同時采用多功能酶標儀檢測細胞熒光值。
1.3.10 數據統計分析 采用 Excel 2016、Origin 2018、SPSS 19.0軟件對數據進行分析處理,用LSD多重比較和t檢驗進行差異顯著性分析 (α=0.05)。
2 結果與分析
2.1 牡蠣酶解超濾組分分子量分布
超濾作為一種初步分離手段,具有操作便利、節省材料、保留樣品活性等優點。分子量分布測定可有效評價超濾分級的分離效果。>10 ku超濾組分中>10 ku的成分占67.96%,<3 ku超濾組分中<3 ku的小分子物質占57.48%,各個超濾組分中,隨著分子量的降低,<3 ku的小分子物質占比不斷升高,>10 ku的大分子物質占比不斷降低 (表1),表明通過超濾分級將大分子物質和小分子物質進行了有效分離。而在牡蠣酶解產物中,3~5 ku和5~10 ku 2個分子量區間的物質占比較低,因此分離難度較大。
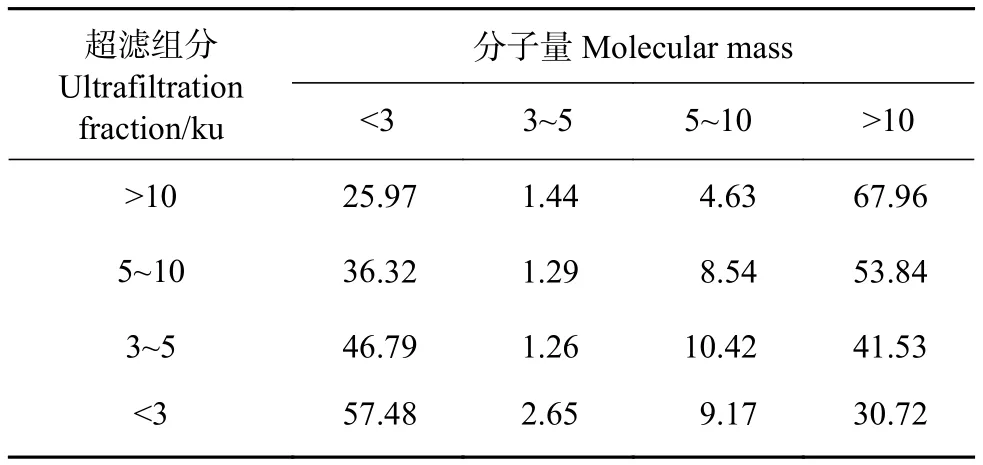
表1 超濾膜分級后不同分子量區間的成分占各超濾組分的比值Table 1 Ratio of different molecular mass ingredients to each ultrafiltration fraction after ultrafiltration membrane classification%
本研究選取的原料、酶解工藝和超濾分級方法均參照筆者課題組前期研究[27],前期研究對牡蠣酶解產物及其超濾組分的基本成分分析發現,牡蠣酶解粉中蛋白質 (41.26%) 和糖類 (50.07%) 為主要組成成分,而經過超濾分級,<3 ku超濾組分的蛋白質比例達72.3%[27],結合分子量分布結果,說明<3 ku超濾組分中的主要成分為小分子肽和游離氨基酸。
2.2 牡蠣酶解產物超濾組分的微量金屬元素含量
各個牡蠣酶解超濾組分富含Cu、Zn、Mn、Se等微量金屬元素 (表2)。其中,Zn是影響男性生育的重要營養物質,精漿和前列腺中均具有高濃度的Zn。精液中適量的Zn對精子產生與維持精子正常形態、數量、功能均至關重要[31]。此外,睪丸的發育和類固醇生成都離不開Zn的參與,在性腺功能低下、少精癥、弱精癥和無精子癥患者體內常見Zn缺乏。牡蠣中Zn含量高于其他食物,質量分數一般為 61.33~616.98 mg·kg–1[32],而<3、3~5和5~10 ku超濾組分中Zn質量分數分別高達3 019、2 998和 3 128 mg·kg–1。<3、3~5和 5~10 ku超濾組分中Cu、Zn、Mn的質量分數均高于>10 ku超濾組分,說明小分子物質與金屬元素的結合效率更高,更易富集金屬元素。本研究也發現,牡蠣中的Zn可與牡蠣肉中的蛋白質和氨基酸結合,而牡蠣肉中占比較高的谷氨酸 (Glu)、亮氨酸 (Leu)、精氨酸 (Arg) 和天冬氨酸 (Asp) 表現出很強的金屬結合親和力[33]。
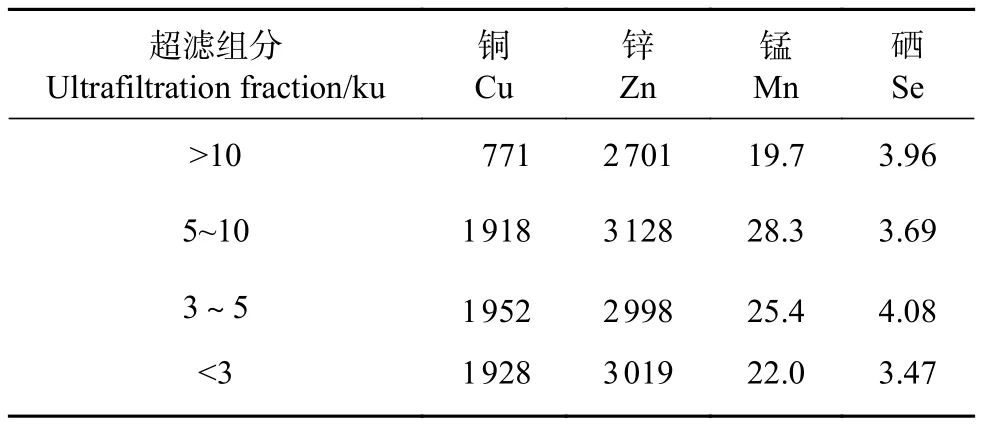
表2 牡蠣超濾組分微量金屬元素質量分數Table 2 Mass fractions of trace metal elements in oyster ultrafiltration fractionsmg·kg–1
2.3 牡蠣酶解超濾組分對TM4細胞生長的影響
為確保本研究中牡蠣酶解超濾組分在質量濃度范圍內對TM4細胞存活率不存在抑制作用,將細胞與各質量濃度的牡蠣酶解超濾組分 (<3、3~5、5~10和>10 ku) 孵育 12和 24 h,通過 MTT 法測定細胞存活率。結果顯示,分別作用12和24 h后,在 1 000 μg·mL?1質量濃度范圍內,與空白對照組相比,TM4細胞存活率均有不同程度的增加 (P<0.05,圖1),說明各牡蠣酶解超濾組分對TM4細胞均無細胞毒性作用。

圖1 牡蠣酶解超濾組分作用于TM4細胞12 h (a) 和24 h (b) 后的細胞存活率與空白對照組相比,*. 顯著差異 (P<0.05);**. 極顯著差異 (P<0.01)。Figure 1 Cell viability of oyster hydrolyzed ultrafiltration fractions after treatment on TM4 cells for 12 h (a) and 24 h (b)Compared with the control group, *. Significant difference (P<0.05); **. Very significant difference (P<0.01).
2.4 TP對TM4細胞生長的抑制作用
已有研究表明TP具有較強的生殖毒性作用,而睪丸支持細胞作為維持睪丸微環境、組成血睪屏障的主要功能細胞,對有毒物質和藥物十分敏感[13]。用不同濃度 (125、250、500和 1 000 nmol·L?1)TP處理TM4細胞24 h,隨著TP濃度增加,TM4細胞存活率呈劑量依賴性降低,與空白對照組相比,各濃度TP對TM4細胞存活率的影響均差異顯著 (P<0.05,圖2)。Wang等[13]研究也表明,TP以劑量依賴和時間依賴性的方式顯著抑制TM4細胞的生長,24 h 的 50% 抑制濃度 (IC50) 為 (669.5±269.45) nmol·L?1。根據本實驗結果及前人[13,29-30]的研究方法,選取 500 nmol·L?1為后續造模損傷濃度。
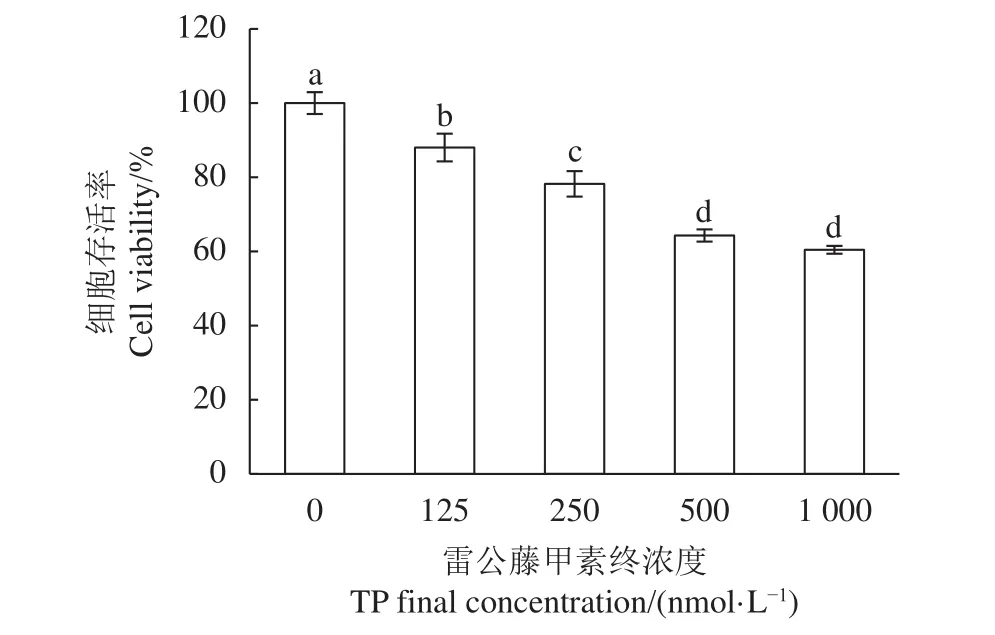
圖2 雷公藤甲素對TM4細胞的毒性作用上標不同字母表示具有顯著性差異 (P<0.05);圖3—圖5同此。Figure 2 Cytotoxic effect of TP on TM4 cellsDifferent superscript letters indicate significant difference (P<0.05).The same case in Figure 3?Figure 5.
2.5 牡蠣酶解超濾組分對TP誘導TM4細胞毒性的保護作用
牡蠣酶解超濾組分分別預處理TM4細胞6和12 h,TP (500 nmol·L?1) 作用 TM4細胞 24 h 進行毒性損傷,與TP模型組相比,牡蠣酶解超濾組分各劑量組的細胞存活率均顯著提高 (P<0.05,圖3),說明各牡蠣酶解超濾組分對TP損傷后TM4細胞的活力均具有保護作用,且呈現較好的劑量依賴性。其中,<3 ku 超濾組分在 250 μg·mL?1質量濃度范圍內各個劑量組的細胞存活率均具有顯著性差異 (圖 3-b);在 250和 500 μg·mL?1作用下,<3、3~5和5~10 ku超濾組分的細胞存活率顯著高于>10 ku超濾組分 (P<0.05),且與空白對照組無顯著性差異(P>0.05),說明<3、3~5和 5~10 ku 3個超濾組分對TP損傷TM4細胞活力具有很好的保護效果,且效果優于>10 ku超濾組分。研究表明小分子物質更容易被機體利用和吸收,且具有更高的生物利用率和生物活性[34],結合本研究結果,說明小分子物質對TP損傷的TM4細胞活力具有更好的保護效果。
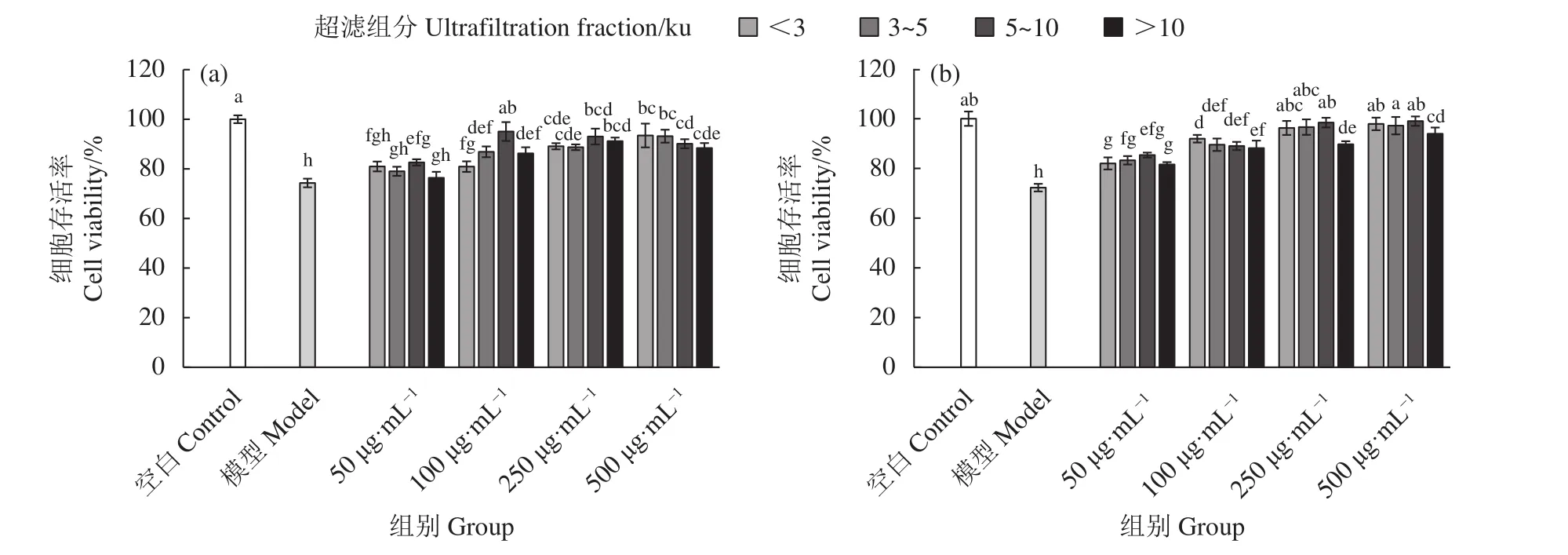
圖3 牡蠣超濾組分對雷公藤甲素誘導TM4細胞毒性的保護作用 (預處理時間:a. 6 h;b. 12 h)Figure 3 Protective effect of oyster ultrafiltration fractions on TP-induced TM4 cytotoxicity (Pretreatment time: a. 6 h; b. 12 h)
研究表明Zn具有保護睪丸組織毒性損傷的作用,可抑制鎘、乙醇等生殖毒性物質對生殖細胞的影響[35-36]。本研究中牡蠣酶解超濾組分中富含Zn,且<3、3~5和5~10 ku超濾組分的Zn含量高于>10 ku超濾組分,結合細胞存活率實驗結果,推測牡蠣酶解超濾組分在改善TP誘導的TM4細胞凋亡過程中Zn可能起到了一定的協同作用。
2.6 牡蠣酶解超濾組分對TP誘導TM4細胞氧化應激損傷的生化檢測
GSH作為一種低分子清除劑,可有效減少機體的氧化損傷,是衡量機體抗氧化能力的重要指標。TP顯著降低TM4細胞內GSH含量,且具有劑量依賴性 (P<0.05,圖4-a),說明TP作用于TM4細胞會降低其細胞內抗氧化能力。
各牡蠣酶解超濾組分對TM4細胞的保護效果見圖5。與TP模型組相比,不同質量濃度 (50、100、250 μg·mL?1) 的<3 ku 超濾組分均可顯著提高TM4細胞內GSH含量,顯著抑制TP對TM4細胞的氧化損傷且呈現劑量依賴性 (P<0.05);此外,<3 ku 超濾組分 250 μg·mL?1劑量組的 GSH 含量均顯著高于其他超濾組分的各個劑量組 (P<0.05)。
自由基作用于脂質發生過氧化反應,生成的終產物則為MDA,其水平反映了機體脂質過氧化的強度和速率,間接反映了組織過氧化損傷程度,還可影響細胞線粒體呼吸鏈復合物及線粒體內關鍵酶活性,同時加劇細胞膜損傷,具有細胞毒性。與空白對照組相比,TP可顯著誘導TM4細胞中MDA含量的升高,且呈現劑量依賴性 (P<0.05,圖4-b),說明TP作用于TM4細胞會顯著增加細胞的脂質過氧化程度。
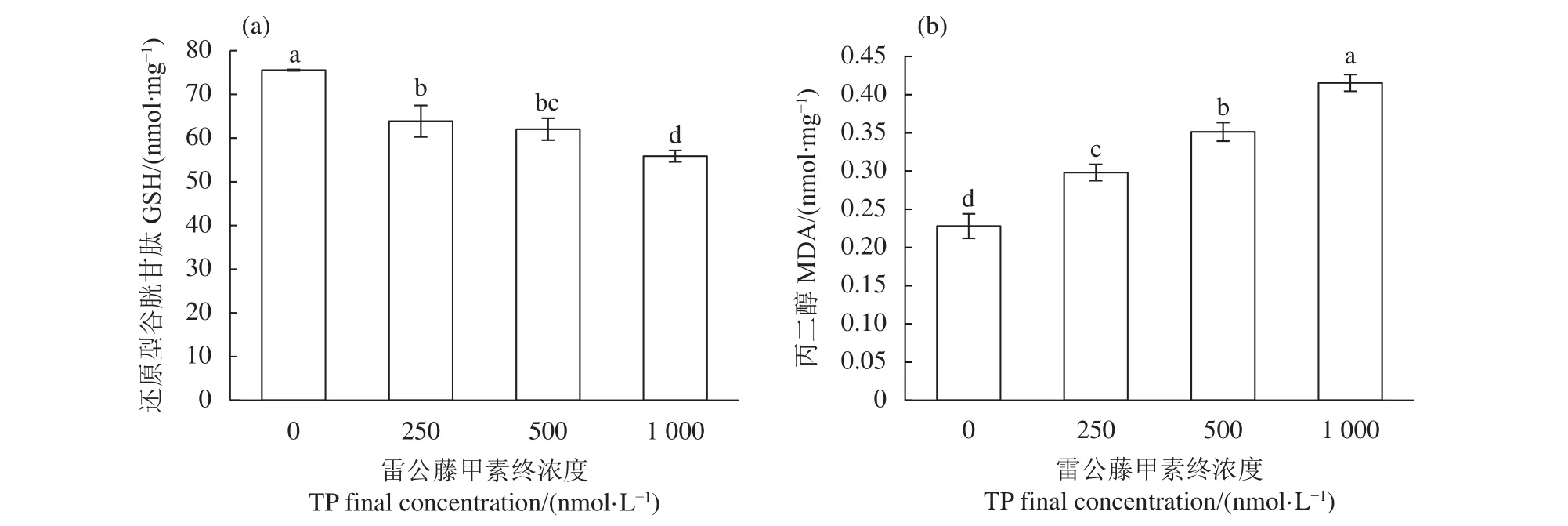
圖4 雷公藤甲素對TM4細胞內還原型谷胱甘肽和丙二醇含量的影響Figure 4 Effect of TP on GSH and MDA content in TM4 cells
與TP模型組相比,不同質量濃度的各牡蠣超濾組分均不同程度地抑制TP對TM4細胞的脂質過氧化損傷 (圖 5-b)。其中,<3 ku 和 5~10 ku 超濾組分在 100 μg·mL?1作用濃度下,抑制細胞內脂質過氧化效果最顯著 (P<0.05),且與空白對照組無顯著性差異,而在 50和 250 μg·mL?1質量濃度下,<3 ku超濾組分抑制效果優于 5~10 ku (P<0.05)。
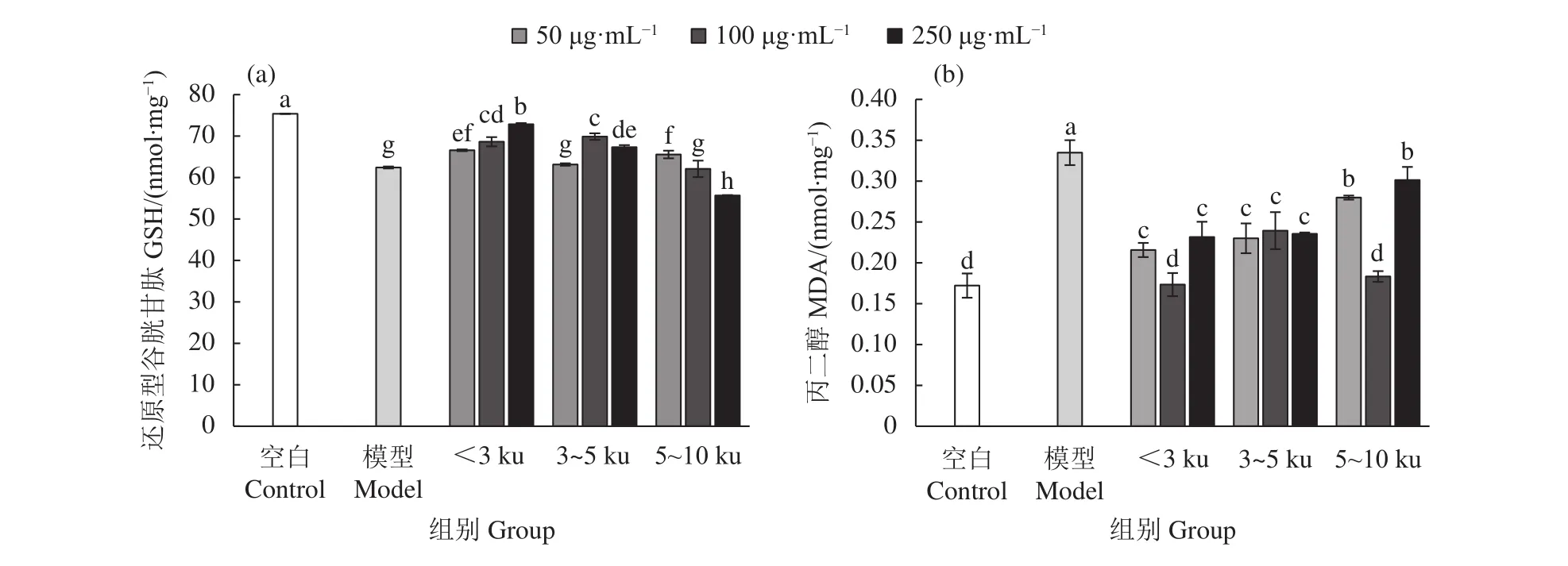
圖5 牡蠣超濾組分對雷公藤甲素誘導TM4細胞內還原型谷胱甘肽和丙二醇含量的影響Figure 5 Effect of oyster ultrafiltration fractions on GSH and MDA content in TM4 cells induced by TP
綜上,<3 ku超濾組分在各超濾組分中對TM4細胞抗氧化損傷的活性最強。劉姝等[37]和林海生[38]研究也表明,牡蠣酶解液中抗氧化活性物質主要集中于<3 ku的小分子活性肽,而相關研究也表明TP主要通過誘導TM4細胞氧化應激導致細胞凋亡[29],因此<3 ku超濾組分中對TP起主要拮抗作用的可能是具有抗氧化活性的小分子活性肽。
2.7 牡蠣酶解超濾組分對TP誘導TM4細胞內活性氧水平的影響
活性氧 (Reactive oxygen species, ROS) 是指化學性質活潑的具有含氧基團的化合物。有研究表明,TP對睪丸支持細胞的毒性作用機制與ROS的過量產生和抗氧化防御系統的失活有關[30]。ROS的過度積累或持續存在會導致線粒體功能障礙,釋放細胞色素C進入細胞質,從而導致細胞凋亡。TP可通過增加氧化應激水平產生毒性作用。活性氧水平與細胞分化以及精子發生的生理過程密切相關,而活性氧水平的異常升高會導致生精細胞凋亡,影響正常的生精過程[39]。根據細胞內GSH和MDA含量測定結果,對<3 ku超濾組分提前預處理 TM4細胞 6 h 后,TP (500 nmol·L?1) 作用 TM4細胞造模3 h,如DCFH-DA檢測所證實,在TP暴露下細胞內ROS水平顯著增加,但經<3 ku超濾組分預處理的各個劑量組,與TP模型組相比,可顯著抑制TP誘導的ROS積累 (圖6和圖7)。本實驗結果表明,<3 ku超濾組分可抑制過量ROS的生成,為其減少睪丸組織的氧化損傷提供實驗依據。

圖6 DCFH-DA探針法檢測TM4睪丸支持細胞內活性氧 (200×)Figure 6 Intracellular ROS in TM4 Sertoli cells indicated as green fluorescence by DCFH-DA
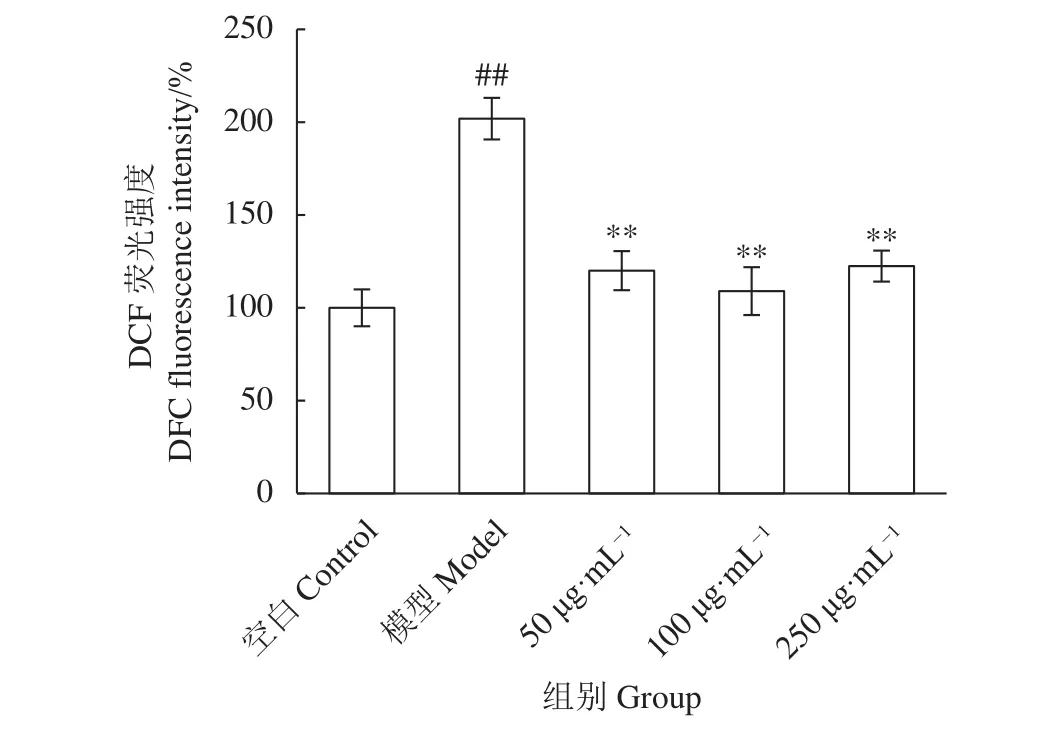
圖7 <3 ku牡蠣超濾組分對雷公藤甲素誘導TM4細胞內活性氧水平的影響與模型組相比,*. 顯著差異 (P<0.05);**. 極顯著差異 (P<0.01);與空白對照組相比,#. 顯著差異 (P<0.05);##. 極顯著差異 (P<0.01)。Figure 7 Effect of <3 ku ultrafiltration fractions from oyster on TP-induced reactive oxygen species in TM4 cellsCompared with the model group, *. Significant difference (P<0.05);**. Very significant difference (P<0.01). Compared with the control group, #. Significant difference (P<0.05);##. Very significant difference (P<0.01).
3 結論
本研究通過TP損傷TM4細胞構建生殖細胞損傷模型,探究了牡蠣酶解超濾組分對TP誘導的氧化損傷的保護作用。結果表明,<3 ku超濾組分可有效抵抗TP對TM4小鼠睪丸支持細胞的毒性損傷,提高細胞存活率,減少細胞內ROS的產生和脂質過氧化,增強TM4細胞的抗氧化能力。本研究也提示小分子量的牡蠣酶解產物可用于抗生殖毒性損傷的保健食品利用和開發。在此基礎上,還有待通過動物模型來驗證<3 ku超濾組分對TP誘導的生殖損傷的保護作用及相關機制。

