自組裝形成的透明質酸-銅-槲皮素配位聚合物納米粒子對乳腺癌的協同治療作用
岳瀚勛,余嫻,趙軒,雍琴
(1.重慶醫科大學附屬第二醫院I期臨床試驗研究室,重慶 400010;2.中國平煤神馬醫療集團總醫院,河南 平頂山 467000)
目前,乳腺癌已取代肺癌成為女性發病率最高的惡性腫瘤[1]。隨著對乳腺癌研究的深入,越來越多的治療手段被應用于臨床,如化療、免疫治療、靶向治療等[2]。但三陰性乳腺癌(triple-negative breast cancer,TNBC)作為乳腺癌中一種特殊類型,其治療仍主要為含鉑兩藥聯合化療[3]。盡管聯合化療已明顯提高療效和降低不良反應,但由于藥物本身毒性大和治療缺乏靶向性,導致其不良反應仍較多且難以耐受[4-6]。克服這些問題的有效方法之一就是選擇毒性低的藥物并將其封裝于具有靶向作用的納米載體中形成納米藥物。槲皮素是一種黃酮類天然化合物,廣泛存在于日常飲食中,具有顯著抗腫瘤作用和良好的安全性[7]。但槲皮素有口服生物利用度低、水溶性差、代謝迅速及易被酶降解等缺點,限制了其臨床應用。對槲皮素進行改性是解決上述問題的有效方法,包括形成金屬配合物[8]。銅離子是一種能與槲皮素發生配位作用的副族金屬,研究[9]表明,槲皮素-銅配合物具有明確的抗腫瘤作用。此外,銅離子也可通過觸發類芬頓反應將腫瘤微環境中過量產生的低毒性過氧化氫(H2O2)轉化成更具細胞毒性的羥基自由基(·OH)來達到協同抗腫瘤作用[10]。低分子量透明質酸作為一種高效的腫瘤靶向遞送載體,其優越性主要體現在具有良好的生物相容性、生物可降解性和特殊的CD44受體結合能力[11]。在生理條件或適當pH環境下通過透明質酸分子中糖醛酸的羧基充分解離,然后與銅離子形成離子對,可使槲皮素-銅配合物靶向高表達CD44受體的腫瘤細胞。本研究擬將槲皮素作為化學治療劑和自載材料,銅離子作為連接點和類芬頓反應試劑,透明質酸作為靶向遞送載體,利用上述材料自組裝形成配位聚合物納米粒的方法開發一種具有多功能的透明質酸-銅-槲皮素配位聚合物納米粒(hyaluronic acid-cu-quercetin coordination polymer nanoparticles,HCQ NP)并闡明其體外抗三陰人乳腺癌的作用。
1 材料與方法
1.1 實驗材料
槲皮素(Sigma-Aldrich公司),氯化銅(梯希愛(上海)化成工業發展有限公司),透明質酸(Lifecore Co.(Chaska,MN)),Tris-Hcl 8.8(上海碧云天生物技術有限公司),二甲基亞砜(DMSO,重慶塞米克),亞甲藍(上海碧云天生物技術有限公司),CCK-8細胞計數試劑(MCE公司),RPMI-1640培養基、胎牛血清、胰酶細胞消化液(重慶塞米克),三陰人乳腺癌細胞株MDA-MB-231來自于重慶市生物化學與分子藥理學重點實驗室。人正常肝組織細胞LO2細胞來自于廈門大學。
1.2 方法
1.2.1 HCQ NP的合成及表征 HCQ NP的合成采用自組裝方法,具體如下:吸取1 mL透明質酸溶液(10 mg/mL)和150 μL氯化銅溶液(5 mg/mL)于反應瓶中,并將其置于磁力攪拌器上以500 rpm攪拌反應4 min;然后吸取150 μL Tris-Hcl 8.8溶液加入反應瓶中反應4 min,以促進透明質酸與銅離子充分反應;吸取125 μL 槲皮素溶液(20 mg/mL)逐滴加入到反應瓶中反應4 h;最后將上述反應液透析24 h并于室溫下保存備用。將HCQ NP樣品和經過硝化和干燥處理的樣品分別進行透射電鏡、動態光散射、電感耦合等離子體質譜(inductively coupled plasma massspectrometry,ICP-MS)和紅外光譜(fourier transform infrared spectrometer,FT-IR)檢測,測定HCQ NP的形態、粒徑、樣品中銅離子的含量及納米粒的結構。
1.2.2 HCQ NP生成羥基自由基能力的檢測 采用亞甲藍光度法。設置HCQ NP組(HCQ);HCQ NP+1nM H2O2組[HCQ+H2O2(1nM)];HCQ NP+2nM H2O2組[HCQ+H2O2(2nM)];HCQ NP+4nM H2O2組[HCQ+H2O2(4nM)],亞甲藍溶液組(methylene blue,MB)為空白對照。將上述各組與亞甲藍溶液放置于37 ℃避光條件下孵育30 min;使用紫外可見分光光度計依次測量各組亞甲藍在波長666 nm處的吸光度。
1.2.3 HCQ NP的抗乳腺癌作用檢測 采用CCK-8法。設置5 μL HCQ NPs組(HCQ)和5 μL HCQ NP +50μM H2O2組(HCQ+H2O2);10 μL HCQ NPs組(HCQ)和10 μL HCQ NP +50 μM H2O2組(HCQ+H2O2);15 μL HCQ NPs組(HCQ)和15 μL HCQ NP +50 μM H2O2組(HCQ+H2O2);20 μL HCQ NPs組(HCQ)和20 μL HCQ NP +50μM H2O2組(HCQ+H2O2),PBS組為空白對照組;MDA-MB-231細胞接種于96孔板(3×103/孔)中,加入正常培養基貼壁24 h后,吸出原有培養基,各組分別加入正常培養基(含89%RPMI-1640,10%胎牛血清,1%雙抗)及各組相應處理因素;置于5% CO2、37 ℃條件下的孵箱中培養48 h;將各組培養基棄去,加入含有10% CCK-8試劑的培養基,培養3 h后用酶標儀在450 nm下檢測各組吸光度。
1.2.4 HCQ NP的生物相容性檢測 采用CCK-8法。設置5 μL HCQ NPs組(HCQ);10 μL HCQ NPs組(HCQ);15 μL HCQ NPs組(HCQ);20 μL HCQ NPs組(HCQ),PBS組為空白對照組;LO2細胞接種于96孔板(3×103/孔)中,加入正常培養基貼壁24 h后,吸出原有培養基,各組分別加入正常培養基(含89% RPMI-1640,10%胎牛血清,1%雙抗)及各組相應處理因素;置于5% CO2、37 ℃條件下的孵箱中培養48 h;將各組培養基棄去,加入含有10%CCK-8試劑的培養基,培養3 h后用酶標儀在450 nm下檢測各組吸光度。
1.3 統計學分析
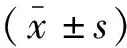
2 結果
2.1 HCQ NP的表征
透射電鏡觀察顯示,HCQ NP的形狀類似球形,大小均一。通過動態光散射檢測的粒徑結果比透射電鏡的大的主要原因是動態光散射檢測的是納米粒的水合粒徑。HCQ NP經硝化處理后通過ICP-MS測得銅離子濃度為6.663 mg/L,根據硝化處理時的稀釋比例計算得合成的HCQ NP 樣品中銅離子濃度為133.262 mg/L。將經干燥處理后得到的 HCQ NP粉末進行紅外檢測,通過對比發現HCQ NP的紅外吸收光譜上存在槲皮素及透明質酸的特征吸收峰,但有部分偏移,槲皮素中羰基(C=O)的振動頻率位于1 661 cm-1,制備成納米粒后C=O向低波數方向發生位移,表明槲皮素羰基參與了配位作用。相比于槲皮素振動頻率位于1 308 cm-1的C-OH(C-3位),納米粒中消失,表明該結構也參與了與銅離子的配位[12]。見圖1、圖2及表1。

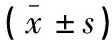
表1 HCQ NP的粒徑和zeta電位徑

2.2 HCQ NP生成羥基自由基的能力
檢測HCQ NP生成羥基自由基能力,結果顯示相對于對照組和HCQ NP組,HCQ NP+ H2O2組更能生成羥基自由基,導致MB吸光度下降,且隨著H2O2濃度的提高,MB的吸光度也降低(P<0.05)。見圖3。

2.3 HCQ NP的協同抗腫瘤作用
HCQ組和HCQ+H2O2組對MDA-MB-231細胞增殖的抑制作用強于對照組(P<0.05),HCQ+H2O2組強于HCQ組(P<0.05),且隨著劑量的增大,抑制作用也隨之加強。見圖4。

2.4 HCQ NP的生物相容性
相對于對照組,HCQ組在不同劑量下均未對LO2細胞產生明顯的影響(P>0.05)。見圖5。

3 討論
TNBC作為乳腺癌中一種特殊類型,具有高侵襲和高轉移的特性,是目前乳腺癌中預后最差的一種亞型。由于內分泌治療和針對HER-2的靶向治療對TNBC無效,至今對TNBC仍缺乏令人滿意的綜合治療方案[13]。槲皮素作為天然化合物的代表,具有良好的安全性和廣泛的抗癌譜,能夠通過改變細胞周期進程、抑制細胞增殖、促進細胞凋亡、抑制血管生成等多種途徑發揮抗腫瘤作用[7]。研究[14]表明,槲皮素對TNBC包括其代表細胞MDA-MB-231有良好的抑制作用。化學動力學療法是一種新興的抗腫瘤療法,具有無創、高效等特點,通過芬頓或類芬頓反應,將腫瘤微環境中過量產生的H2O2轉化為更具細胞毒性的羥基自由基,從而達到抗腫瘤作用[15-18]。但由于槲皮素存在水溶性差、酶降解等問題影響臨床應用,所以需要對其進行改性。形成金屬配合物是改性方法之一[8],不僅克服了臨床應用限制問題,還引入了銅離子,從而引入了化學動力學療法,使其具有協同抗乳腺癌作用。
本實驗成功制備了HCQ NP(圖1、表1及圖2)。隨后亞甲藍吸光度實驗表明,只有在H2O2存在的情況下,HCQ NP才能產生羥基自由基,從而使亞甲藍的吸光度降低,而且H2O2濃度越高,產生羥基自由基的能力越強(圖3),提示在腫瘤微環境下(與正常組織相比,具有高濃度H2O2的特點),可望通過化學動力學療法發揮抗腫瘤作用。TNBC具有易復發的特點,所以需要聯合療法以求最大程度的殺滅癌細胞。腫瘤微環境相比于正常組織具有高濃度H2O2[19],本實驗證實(圖4)在模擬腫瘤微環境下,即HCQ+H2O2組具有更顯著的抗腫瘤作用。出現這種結果的原因是在沒有H2O2存在的情況下,HCQ NP發揮抗乳腺癌作用依靠的是槲皮素的作用;而在模擬腫瘤微環境下,即H2O2存在的情況下,HCQ NP除了具有槲皮素的抗乳腺癌作用外,還具有銅離子通過觸發類芬頓反應而發揮的化學動力學抗乳腺癌作用。此外由于納米粒通常會在肝脾等血流豐富的器官蓄積造成嚴重的不良反應[20],所以在研究中我們選擇了人正常肝組織細胞LO2來驗證HCQ NP的生物相容性,而實驗表明HCQ NP未對正常細胞產生明顯的影響(圖5),說明HCQ NP生物相容性良好。
綜上,本研究中槲皮素作為化學治療劑和自載材料、銅離子作為連接點和類芬頓反應試劑、透明質酸作為靶向遞送載體自組裝形成的HCQ NP,具有明確的化學治療與化學動力學治療協同的抗三陰乳腺癌作用,且具有良好的生物相容性。

