骨髓間充質干細胞移植對缺血性腦卒中大鼠炎癥因子的影響
王 芳, 楊 科, 朱夢霞, 黃 靚, 鄒飛燕, 王漢群
(南華大學 1.外科學總論教研室;2.診斷學教研室,湖南省衡陽市 421001)
腦血管疾病因高死亡率、重致殘率嚴重威脅現代人健康和生命,且其發病率逐年遞增,而其中80%為缺血性腦血管疾病[1],目前臨床上具有循證醫學證據的有效治療手段急性溶栓有時間窗的限制;另外抗凝或者早期使用阿司匹林可能同時加重出血風險,因此積極尋找預防和降低缺血性腦卒中的治療方法具有重大的臨床意義。近年來細胞免疫治療蓬勃發展,多種干細胞系用于治療腦血管疾病,并且取得了一定療效[2]。骨髓間充質干細胞(bone marrow mesenchymal stem cells,BMSC)因具有自我更新、多向分化、易取材、體外易培養、免疫原性低、無倫理限制等多項優點,作為腦血管疾病新型的治療方式具有良好的應用前景,可在嚴格把握治療時間窗和選擇注射方式的前提下進行治療,間充質干細胞可以通過促進神經發生、促進神經元突觸之間的聯系[3]、改善神經元周圍血管生成、分泌神經營養因子[4]、調節神經炎癥[5-6]發揮修復損傷神經元的作用。與此同時,缺血性腦卒中的炎癥機制受到越來越多的關注[7],故本實驗采用改良線栓法制備大鼠腦缺血再灌注模型,研究BMSC移植治療對缺血性腦卒中模型鼠神經功能恢復情況,以及腦組織中小膠質細胞激活及炎癥因子表達的影響。
1 材料和方法
1.1 材料與試劑
雄性健康成年SD大鼠24只,300~350 g(南華大學實驗動物部)。白細胞介素-1β(interleukin-1β,IL-1β)、腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)、白細胞介素-6(interleukin-6,IL-6)、白細胞介素-4(interleukin-4,IL-4)、白細胞介素-10(interleukin-10,IL-10)及轉化生長因子-β1(transforming growth factor-β1,TGF-β1)ELISA試劑盒購于北京索萊寶生物科技有限公司;Iba-1兔抗大鼠抗體(1∶1 000,WAKO公司),Bax、Caspase-3、Bcl-2兔抗大鼠抗體(1∶1 000,CST公司);TTC粉末購自Sigma公司。
1.2 動物分組
所有大鼠均在動物實驗室飼養,維持溫度20~25 ℃,相對濕度50%~65%,自由取水,24只8周齡左右SD雄性大鼠隨機均分為空白對照組、模型組和BMSC組。空白對照組不予任何處理;模型組造模成功后予以等量生理鹽水注射;BMSC組造模成功后尾靜脈注射2×106個BMSC移植干預。
1.3 動物模型制備及成功判定方法
參考改良線栓法[8]建立MCAO模型,注意線栓的制作,顯微鏡下觀察線栓不要有倒刺,注意插線栓的深度和角度,防止插入的位置未到或者過深損傷血管。
通過神經行為學Bederson 6級5分評分法[9]判定模型是否成功,5級0分:無功能障礙;4級1分:對側上肢不能完全伸展;3級2分:向對側推時抵抗力下降;2級3分:提尾時向對側轉圈;1級4分:自動轉圈;0級5分:無自發性活動伴意識障礙。采用雙盲的原則,由第三者進行評估,剔除有蛛網膜下腔出血、術后死亡或者評分0分或者5分大鼠,評分2~3分大鼠較為理想,保證模型納入標準無差異,實驗中的大鼠予以及時補充。
1.4 標本處理
移植后28天處死大鼠并采集標本,10%水合氯醛腹腔注射麻醉,一次性采血針插入心尖左心室,取心臟動脈血于采血管中,室溫靜置30 min,以5 000 r/min離心25 min,收集上清。采血完成后,用眼科剪剪開右心耳,開放靜脈竇,冰生理鹽水經心快速灌注300 mL,直至肝臟變白則說明灌注良好,隨后迅速斷頭取腦,一部分腦組織多聚甲醛固定,蔗糖脫水,OCT包埋,冰凍切片機切片,收片備用。另一部分大鼠腦組織用手術刀片于大腦中動脈梗死區(肉眼見顏色較周圍組織白)剪下腦組織約0.5 g,-80 ℃冰箱保存備用,余腦行TTC染色。
1.5 實時熒光定量PCR
用Trizol試劑盒提取大鼠腦組織總RNA,用cDNA反轉錄試劑盒將總RNA反轉錄成cDNA,SYBR試劑盒配置實時熒光定量PCR體系,CFX96 Detection System進行熒光定量PCR。
1.6 ELISA
實驗前0.5 h拿出試劑盒回溫,板內加入洗滌劑清洗3次,隨后加入標準品及樣品至反應孔中,封板后于37 ℃溫箱中孵育90 min,洗板4次,每孔加入100 μL生物素化抗體至反應孔中,封板后37 ℃溫箱中孵育60 min,洗板4次,每孔加入100 μL酶結合物工作液至反應孔中,封板后37 ℃溫箱中孵育30 min,洗板5次,每孔加入100 μL顯色底物至反應孔中,封板后37 ℃溫箱避光顯色15 min, 加入50 μL終止液至反應孔中,5 min內用酶標儀450 nm波長測量OD值。
1.7 免疫熒光
大鼠腦組織制成冰凍切片,0.3%PBST透化1 h,一抗孵育,洗一抗,二抗孵育,洗二抗,DAPI染細胞核,封片,用激光共聚焦顯微鏡拍攝組織結構(63×)。
1.8 免疫印跡
稱取適量大鼠腦組織,加入適量2×SDS Sample buffer(內含磷酸酶抑制劑和蛋白酶抑制劑),電動研磨器充分研磨后95 ℃加熱15 min,超聲后高速離心去除未裂解的組織碎片后取上清。BCA試劑盒進行定量,取20 μg蛋白加入上樣緩沖液上樣,80 V電壓恒定跑30 min后改為120 V跑至所需條帶到膠的中間位置,隨后290 mA恒流低溫轉膜90 min,脫脂牛奶封閉1 h,0.1%PBST清洗3次后上一抗過夜,二抗1 h,PBST清洗后顯影液顯影。
1.9 統計學處理

2 結 果
2.1 BMSC移植后神經行為學評分降低
BMSC移植前,模型組和BMSC組神經行為學評分差異無顯著性(P>0.05);模型組及BMSC組大鼠在BMSC移植后28天評分較移植前降低;移植28天后,BMSC組大鼠神經行為學評分低于模型組大鼠(P<0.05;表1),神經功能恢復較模型組好。

表1 兩組神經功能缺損評分的比較 單位:分
2.2 BMSC移植對腦組織炎癥因子水平的影響
與空白對照組比較,模型組IL-1β、TNF-α、IL-6、IL-4、IL-10及TGF-β1水平明顯升高(P<0.001),說明缺血再灌注損傷導致了炎癥因子轉錄水平增加;而與模型組比較,BMSC組IL-1β、TNF-α和IL-6水平下調,IL-4、IL-10和TGF-β1水平升高(P<0.01,圖1),說明BMSC可以通過降低促炎因子的轉錄和增加抗炎因子的轉錄來發揮抗損傷的作用。
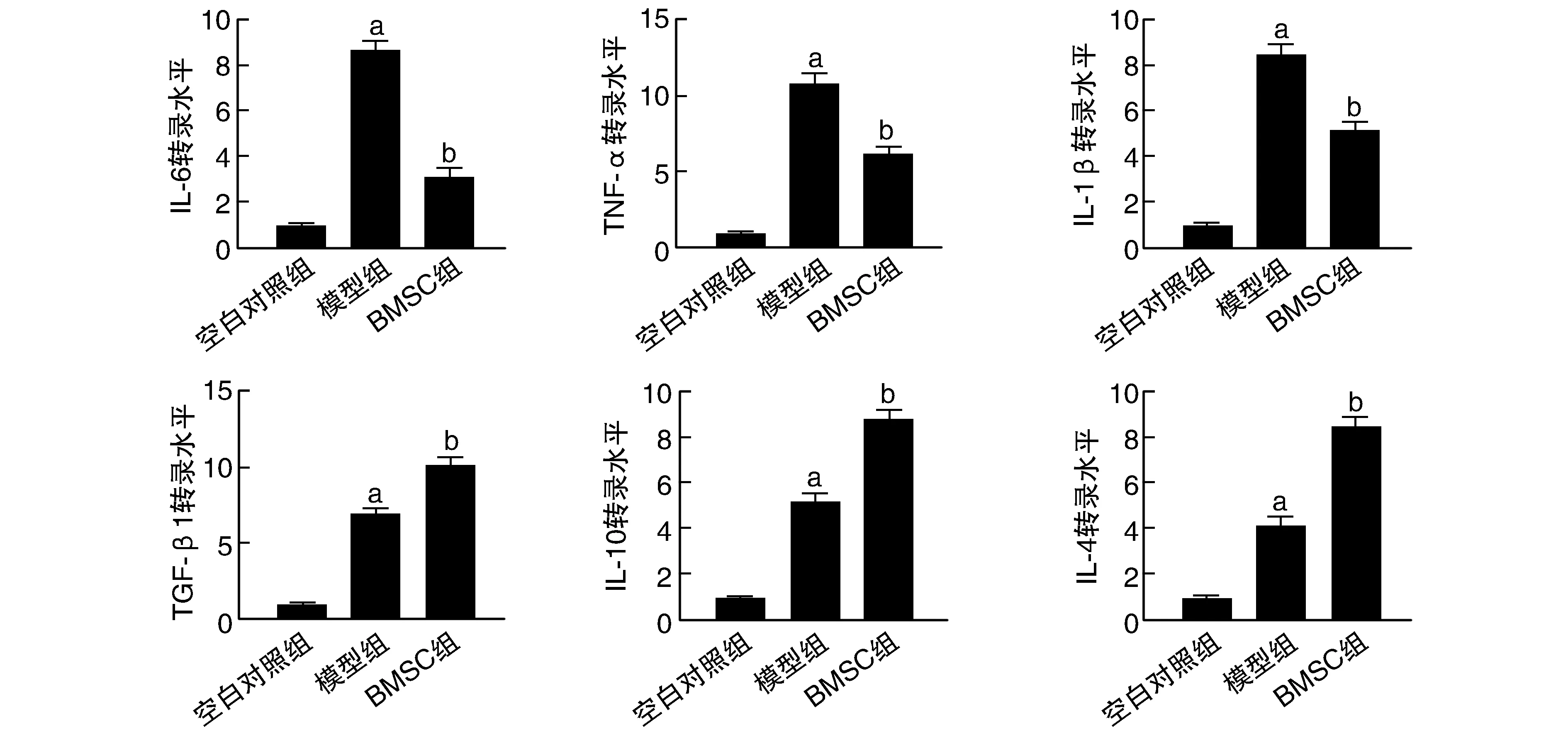
圖1 實時熒光定量PCR檢測大鼠腦組織炎癥因子的轉錄水平a為P<0.001,與空白對照組比較;b為P<0.01,與模型組比較。
2.3 BMSC移植對血清炎癥因子水平的影響
與空白對照組比較,模型組血清中IL-1β、TNF-α、IL-6、IL-4、IL-10及TGF-β1的表達明顯升高(P<0.001),說明損傷導致了炎癥因子的分泌增加;而與模型組比較,BMSC組炎癥因子IL-1β、TNF-α和IL-6水平下調,IL-4、IL-10及TGF-β1水平明顯升高(P<0.01,圖2),說明BMSC可以降低促炎因子、增加抗炎因子的分泌以發揮抗損傷的作用。
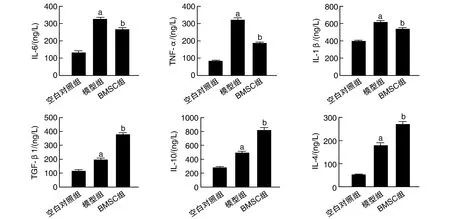
圖2 ELISA檢測大鼠血清炎癥因子的水平a為P<0.001,與空白對照組比較;b為P<0.01,與模型組比較。
2.4 BMSC移植抑制大鼠腦組織中小膠質細胞的激活
如圖3所示,IBA-1是小膠質細胞的Marker,CD68是小膠質細胞激活的Marker,與空白對照組比較,模型組腦組織中小膠質細胞數量明顯增加,胞體增大,分支回縮,CD68熒光面積增加,這些指標均指示模型組小膠質細胞激活明顯;而與模型組比較,BMSC組小膠質細胞激活下降,這與炎癥因子的釋放相吻合,說明BMSC可以抑制小膠質細胞的過度激活,從而降低炎癥因子的釋放。
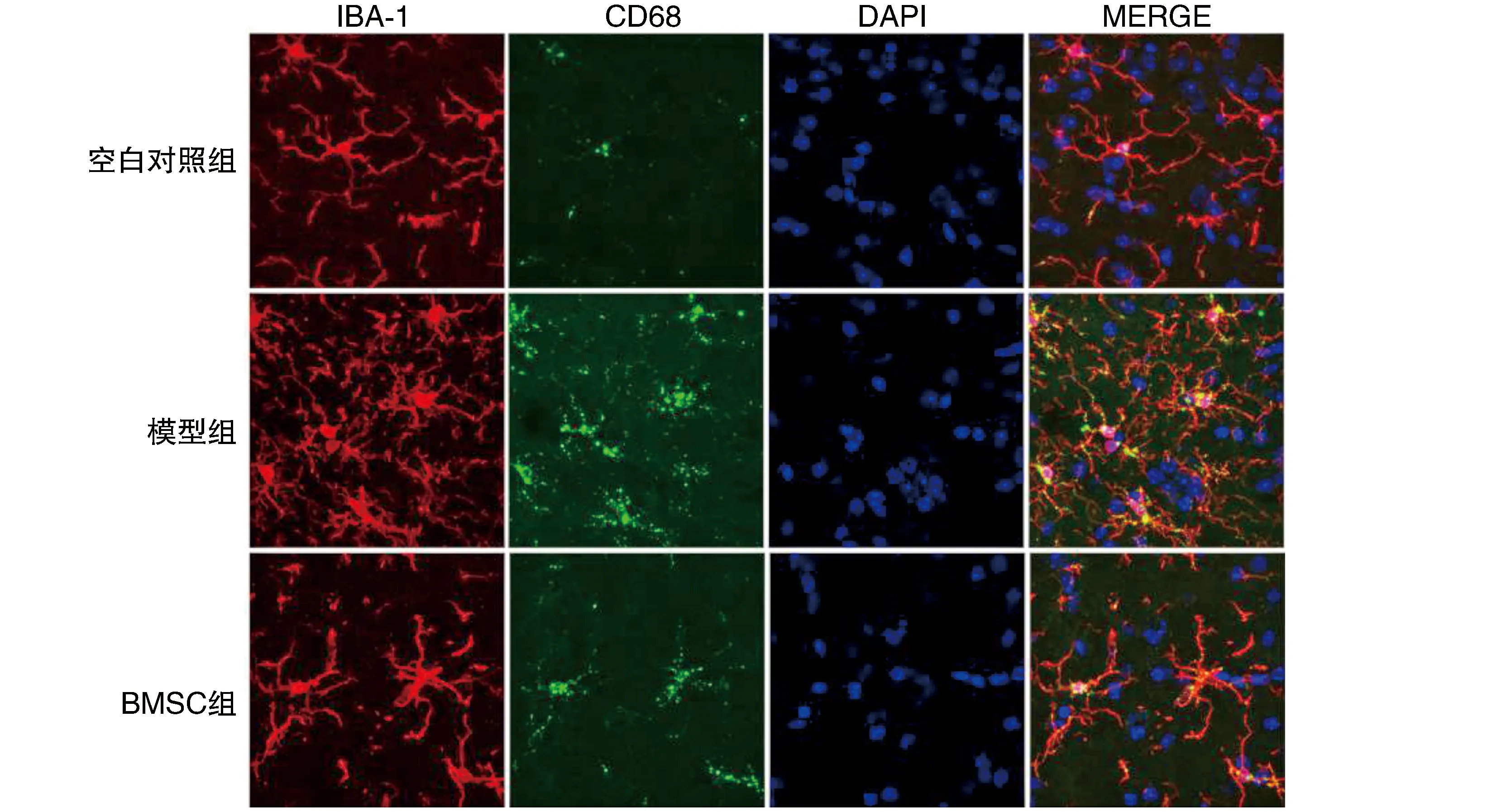
圖3 激光共聚焦檢測大鼠腦組織中小膠質細胞的激活(63×)
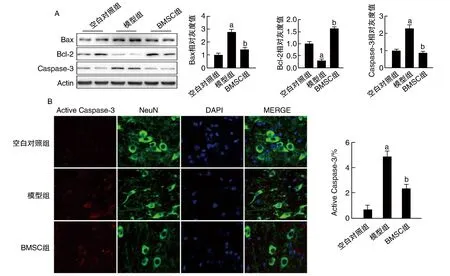
圖4. BMSC移植對腦組織凋亡的影響(63×)A為Western blot檢測腦組織凋亡蛋白Bax、Bcl-2和Caspase-3的相對表達量; B為激光共聚焦檢測細胞凋亡。a為P<0.001,與空白對照組比較;b為P<0.01,與模型組比較。
2.5 BMSC移植對腦組織凋亡的影響
如圖4所示,與空白對照組比較,模型組促凋亡因子Bax、Caspase-3的表達明顯升高,抑凋亡因子Bcl-2明顯降低,說明損傷導致了凋亡;而與模型組比較,BMSC組有效降低促凋亡因子Bax、Caspase-3的表達,抑凋亡因子Bcl-2明顯升高(P<0.01),說明BMSC可以通過抑制凋亡來發揮抗損傷的作用。
3 討 論
缺血性腦卒中是由于多種原因導致腦血管狹窄或者閉塞,腦局部相對供血不足,導致腦組織缺血壞死,使患者產生多種臨床癥狀,如偏癱、失語、記憶力下降等,給國家及家庭帶來了極大的社會及經濟負擔,目前已有研究表明干細胞移植能改善患者的腦神經功能恢復[10],具體機制并不十分明確,相關研究認為與干細胞分化為神經元樣細胞[11],干細胞誘導缺血區新生血管的增加[12],釋放多種神經營養因子[13],中和神經毒素,支持內皮細胞的損傷修復[14],調節免疫炎癥相關[15]。近年來,炎癥與缺血性腦損傷的關系受到越來越多的關注,炎癥反應是把雙刃劍[16],早期適當的炎癥反應能促進組織的修復[17],但后期炎癥反應所導致的瀑布效應會極大的損傷腦組織,導致腦組織功能下降,炎癥反應已經成為缺血性腦損傷病理的一部分,而間充質干細胞被認為具有免疫調節以及抗炎作用[18],其機制可能是通過分泌可溶性細胞因子或者細胞間直接接觸來發揮作用。
本實驗研究發現,MCAO模型鼠腦內小膠質細胞無論是從形態還是激活的標記物均表明過度激活,并且高表達炎癥因子,腦組織凋亡增加,而間充質干細胞經尾靜脈注射28后天相較于MCAO模型組小膠質細胞激活下降,促炎因子降低,抗炎因子升高,凋亡蛋白下降,抗凋亡蛋白升高,且神經功能評分在移植干預后評分明顯降低,均表明BMSC對缺血性腦損傷有修復作用,但本文主要研究的是相關表型,至于間充質干細胞具體是通過何種機制發揮作用還需進一步深入的研究。
大量研究表明間充質干細胞對于治療缺血性腦損傷有諸多優勢[19],如提取較為便利,免疫原性低,定向歸巢于腦損傷區,但仍然不可忽視其存在的問題[20],如間充質干細胞能跨越血腦屏障的數量較少,在損傷急性期由于血腦屏障被破壞,及時進行細胞治療療效較好,但一旦錯過時間窗,療效將大大降低;間充質干細胞在分化的過程中容易導致基因突變,導致腫瘤的易感性增加;此外間充質干細胞導致一定的免疫抑制作用,間充質干細胞的移植是否會導致繼發性感染的發生還未可知。
BMSC移植在治療缺血性腦卒中方面的作用得到越來越多的證實,然而仍需要更多的基礎實驗和臨床實驗來驗證一個更加科學有效的治療方案,另外細胞移植技術與其他治療手段聯用如促血管生成藥物或神經營養因子聯用可能會有意想不到的結果,有待進一步加以探究。

