柴樸湯對肝郁型哮喘小鼠CADM1、MAL、IL-33、TSLP表達的影響
劉 鑫, 劉姿琴, 楊蘇琴, 彭果然, 肖琳琳
(南華大學附屬第一醫院1.中醫科,2.呼吸內科, 湖南省衡陽市 421001)
支氣管哮喘發病的關鍵環節為氣道上皮細胞的損傷及修復不足。細胞黏附分子1(cell adhesion molecules,CADM1)是免疫球蛋白超家族中有細胞間連接功能的一種蛋白質[1]。CADM1在支氣管上皮細胞、肺上皮細胞中均有表達,并且能介導細胞之間的黏附[2-3]。在維持上皮細胞完整性過程中,CADM1起著不可忽視的作用。Zhang等[4]研究發現,跨細胞的CADM1相互運動可驅動突觸融合蛋白1向包膜的聚集,介導囊泡的形成,表明CADM1在胞內外的轉運由囊泡介導,而T細胞成熟相關蛋白(T-lymphocyte maturation associated protein,MAL)可參與囊泡轉運[5],從而有助于維持上皮細胞極性。氣道上皮細胞在各種損傷因素作用下,可釋放白細胞介素-33(recombinant interleukin 33,IL-33)、胸腺基質淋巴細胞生成素 (thymic stromal lymphopoietin,TSLP) ,這些細胞因子能夠作用于輔助性T細胞2(T-helper lymphocyte type 2,Th2)和固有淋巴樣2型細胞,其通過釋放Th2細胞因子, 參與哮喘的發生、發展[6]。前期研究表明,MAL在哮喘中呈下調趨勢,而柴樸湯能夠上調MAL的表達來減輕哮喘的炎癥反應[7]。本文探討柴樸湯治療肝郁哮喘小鼠的作用機制。
1 材料和方法
1.1 材料與儀器
健康雌性Balb/c小鼠(湖南天勤生物科技有限公司);卵清白蛋白(美國Sigma公司);氫氧化鋁凝膠(Thermo公司);柴樸湯中藥配方顆粒(廣東一方制藥有限公司);CADM1-抗體和MAL-抗體(美國Proteintech公司)。mRNA反轉錄試劑盒(北京康為世紀公司);霧化器(北京歐姆龍醫療器械有限公司); 熒光定量RCP儀(美國Thermo公司);動物霧化箱(有機玻璃自制);電泳儀(北京六一公司);旋渦混合器(江蘇其林貝爾公司);臺式冷凍離心機(湖南湘儀公司)。
1.2 肝郁型哮喘模型的建立
18只6周齡健康雌性Balb/c小鼠,體質量(20±2) g。將其隨機分為正常組、肝郁型哮喘組、柴樸湯組,每組6只。小鼠適應性喂養1周,肝郁型哮喘組、柴樸湯組均按文獻[8]建立肝郁型哮喘模型。將肝郁型哮喘組、柴樸湯組小鼠分別于第0天和第7天予以卵白蛋白(ovalbumin,OVA)10 μg + Al(OH)3凝膠400 μg+ 生理鹽水0.2 mL腹腔注射,正常組則予以生理鹽水0.2 mL腹腔注射。第21天肝郁型哮喘組、柴樸湯組置于密閉的有機小箱內,超聲霧化機霧化1%OVA,每天1次,每次30 min,連續霧化7天,柴樸湯組根據前期實驗結果選擇柴樸湯劑量[9],即每次霧化前半小時予以柴樸湯0.3 mL(1.5 g/kg)灌胃,正常組予以生理鹽水0.3 mL霧化。小鼠在第28天激發完成24 h后,腹腔注射10%水合氯醛0.1 mL,麻醉后腹主動脈放血處死。
1.3 HE染色
4%甲醛將肺組織固定,常規石蠟包埋及切片,HE染色,顯微鏡下觀察肺組織形態。
1.4 Western blot法檢測CADM1、MAL、IL-33、TSLP蛋白的表達
按照試劑盒說明書操作:配膠,制膠,跑膠,轉膜,將一抗稀釋至一定濃度,稀釋HRP標記的二抗,二抗孵育后吸干水分,曝光、顯影,用quantity one專業灰度分析軟件進行分析,得出平均光密度(OD值)為其蛋白表達量。
1.5 qRT-PCR法檢測CADM1、MAL、IL-33、TSLP mRNA 的表達
一步法提取肺組織總RNA,引物由上海生工合成。β-actin引物:上游:5′-ACATCCGTAAAGACCTCTATGCC-3′,下游:5′-TACTCCTGCTTGGATC CAC-3′,產物長度223 bp。CADM1引物:上游:5′-ATGTGGAAAACCTACGCTGA-3′,下游5′-TCCTTTACAAACCAGTCCGTTC-3′,產物長度150 bp。MAL引物:上游:5′-CCTTGCTGTTGCCCCTAGAACCC-3′,下游:5′-CCCCACTTTGACATCCATTCCCT-3′,產物長度147 bp。IL-33引物:上游:5′-ATTCTGGCTTACGATGTTGT-3′,下游:5′-TCCTTCAGTTTCTTTACCAAC GC-3′,產物長度126 bp。TSLP引物:上游:5′-TGCCCTTCACTCCCCGACA-3′,下游:5′-TGTGCCATTTCCTGAGTACCG-3′,產物長度113 bp。PCR擴增反應條件為預變性、變性、退火、延伸、循環,其中各因子反應條件如下:CADM1:95 ℃ 5 min,95 ℃45 s,60 ℃1 min,72 ℃1 min,35個循環;MAL:95 ℃10 min,94 ℃5 min,60 ℃45 s,72 ℃1 min,40個循環;IL-33:95 ℃30 s,95 ℃5 s,退火/延伸60 ℃20 s,擴增40個循環。 TSLP:95 ℃ 2 min,95 ℃ 15 s,60 ℃1 min,60 ℃15 s共40個循環。溶解曲線采集,60~95 ℃。
1.6 統計學分析
2 結 果
2.1 模型小鼠成功建立
造模小鼠出現易激、掙扎、慢性不可預見性刺激的持續,開始出現毛發無光澤,大便松散,活動度減少,躲避,對刺激反應減弱。在肝郁模型基礎上,予以致敏原激發后,小鼠表現出點頭呼吸、口唇發紺、腹肌收縮等表現,表明肝郁型哮喘模型建立成功。
2.2 病理改變
正常組小鼠氣道無炎性細胞浸潤,同時,管壁未見明顯增厚,管腔結構規則(圖1A)。肝郁型哮喘組氣管壁增厚明顯,支氣管內可見大量炎性細胞浸潤,管腔不規則且變得狹窄,并可見大量黏液分泌現象(圖1B)。柴樸湯組病理改變較肝郁型哮喘組明顯減輕(圖1C)。
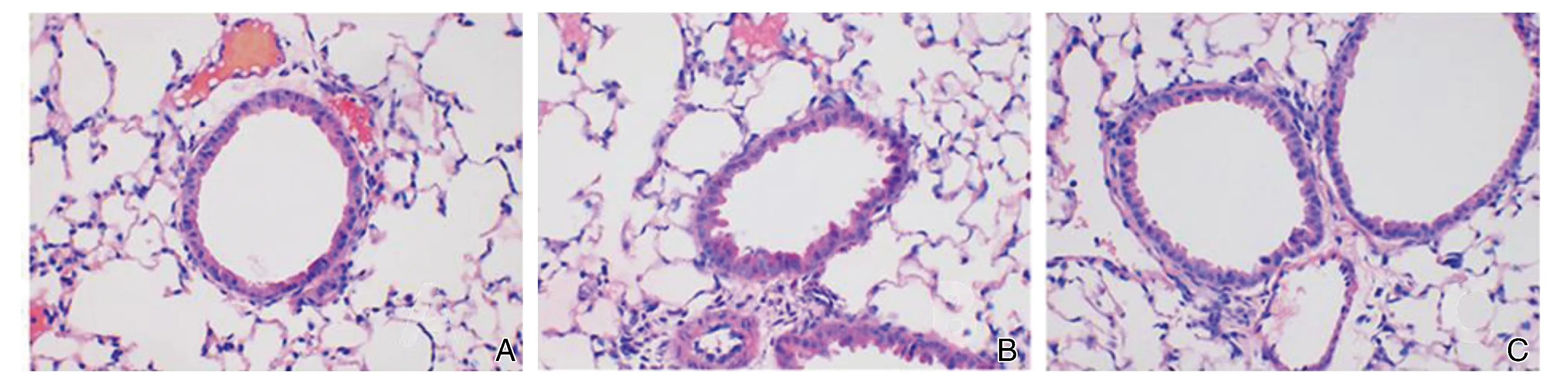
圖1 各組小鼠肺組織病理形態學改變(HE,400×)A為正常組; B為肝郁型哮喘組 ;C為柴樸湯組。
2.3 各組CADM1、MAL、IL-33、TSLP蛋白表達的比較
肝郁型哮喘組CADM1、MAL蛋白相較正常組和柴樸湯組明顯降低(P<0.05),IL-33、TSLP蛋白較正常組和柴樸湯組明顯升高(P<0.05;圖2)。
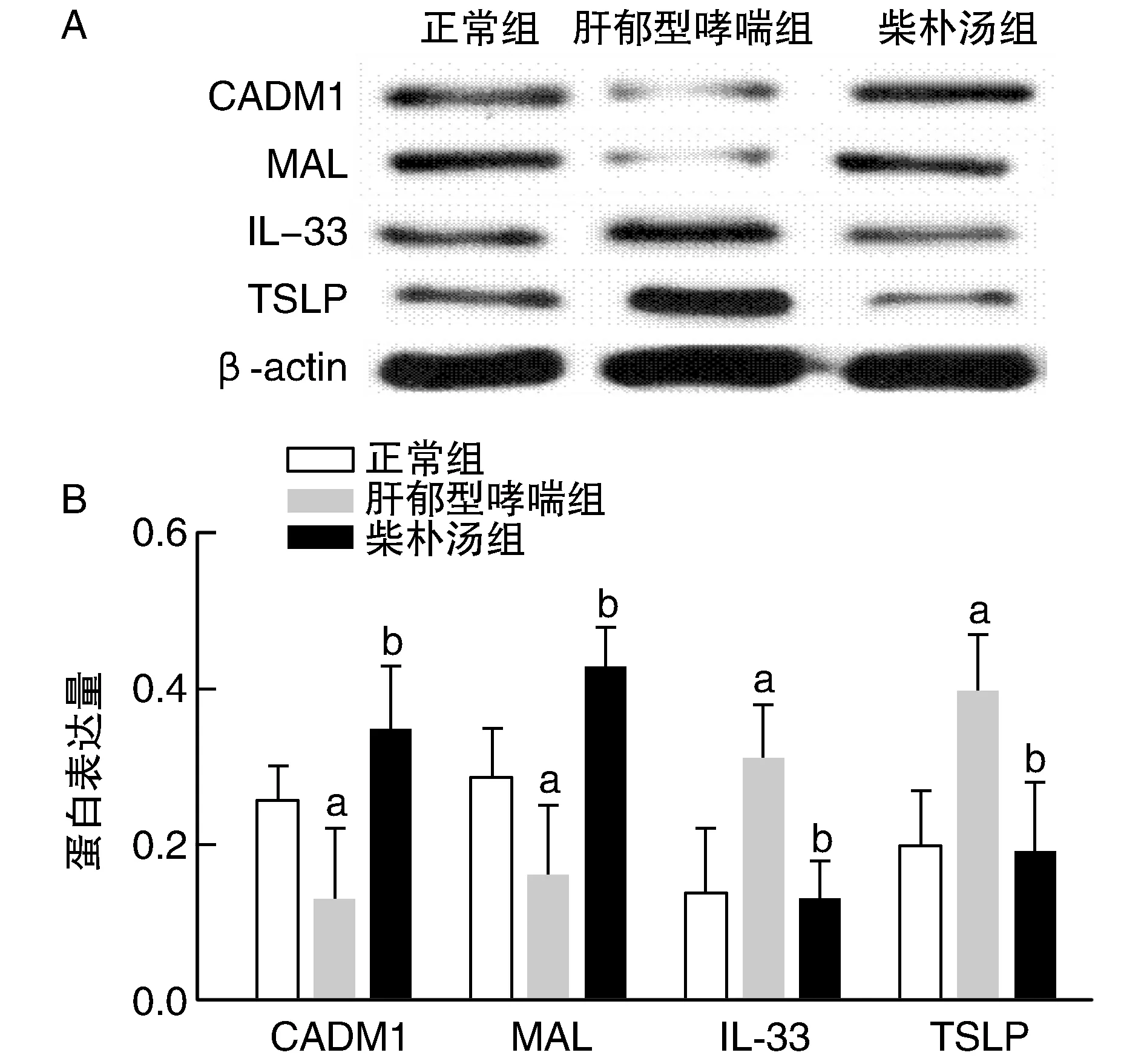
圖2 各組小鼠肺組織CADM1、MAL、IL-33、TSLP蛋白表達量A為western blot 實驗結果;B為蛋白表達柱狀圖。a為P<0.05,與對照組比較;b為P<0.05,與肝郁型哮喘組比較。
2.4 各組CADM1、MAL、IL-33、TSLP mRNA表達的比較
肝郁型哮喘組CADM1及MAL mRNA較正常組和柴樸湯組明顯降低(P<0.05),而IL-33、TSLP mRNA較正常組和柴樸湯組明顯升高(P<0.05;圖3)。
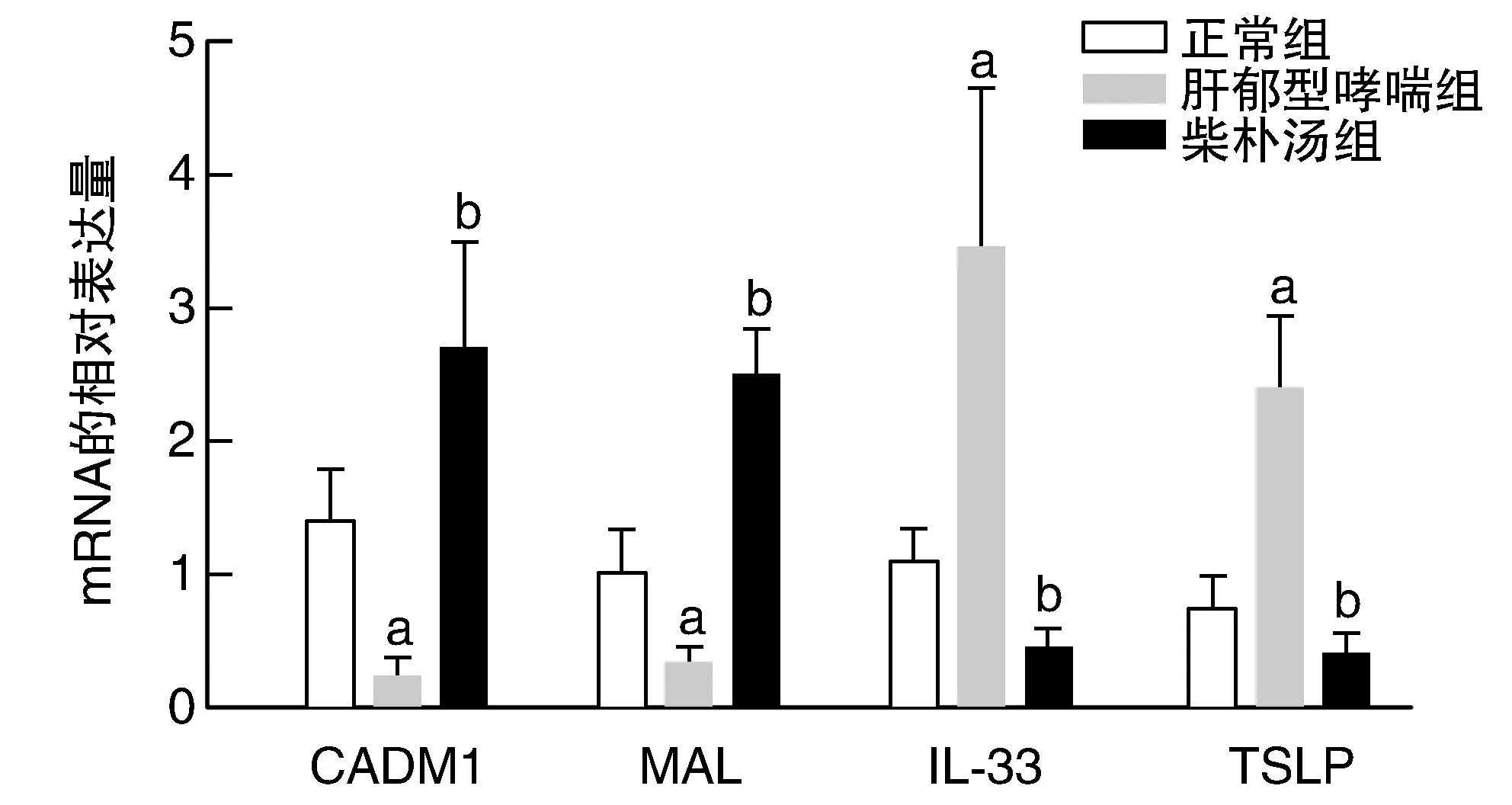
圖3 各組小鼠肺組織中CADM1、MAL、IL-33、TSLP mRNA表達量a為P<0.05,與正常組比較;b為P<0.05,與肝郁型哮喘組比較。
3 討 論
哮喘病機為氣與血、津液與痰的異常,肺脾腎三臟受累,而肝與痰的生成、氣之升降失常及瘀血的產生關系密切[10]。柴樸湯是由小柴胡及半夏厚樸湯組成,能疏肝清肺化痰,使氣機升降自如,氣血調暢而達到哮喘自平。柴樸湯通過上調MAL蛋白的表達從而抑制MAPK/ERK這一信號通路,下調支氣管上皮細胞中的TLR4和NF-kB的mRNA及其蛋白的表達來減輕炎癥反應[9,11]。
MAL蛋白是分離于T淋巴細胞分化中晚期的一種高度疏水性蛋白,主要在上皮細胞中發揮作用。肝郁證致腎上腺皮質激素釋放過度,進而抑制免疫功能。免疫功能失衡易誘發哮喘,而氣道上皮細胞在氣道免疫中起著重要作用。肝郁型哮喘組小鼠肺組織MAL蛋白及mRNA的表達量明顯低于正常組(P<0.05),表明MAL參與了肝郁型哮喘的發生。而使用柴樸湯灌胃后,MAL的表達量明顯上調。
CADM1是表達于上皮細胞中的一種跨膜糖蛋白,它能通過與相鄰細胞中表達的CADM1結合來介導細胞間的附著[12]。在以氣道上皮損傷為特征的肺部疾病中,如間質性肺疾病、肺氣腫等變應性疾病中CADM1明顯下調[13]。氣道上皮細胞的破壞能誘發氣道炎癥及重塑。本文肝郁型哮喘組小鼠CADM1表達明顯低于正常組(P<0.05),而柴樸湯組CADM1表達量明顯高于肝郁型哮喘組(P<0.05),提示哮喘與CADM1的下調有關,柴樸湯能夠疏肝解郁,化痰平喘,使用柴樸湯后CADM1的表達明顯上調。
支氣管哮喘的發病機制復雜,主要可概括為氣道免疫-炎癥機制、神經調節機制及其相互作用,而Th1與Th2細胞比例的失衡(Th1細胞的減少及Th2細胞的升高)是氣道免疫-炎癥機制的重要部分。IL-33是IL-1家族中的一員,它主要表達于上皮細胞和內皮細胞。受炎性因子影響后,IL-33的表達上調[14-15]。在哮喘的發病過程中,IL-33誘導Th2型免疫應答,并在樹突狀細胞、嗜酸性粒細胞和Th2細胞中與其ST2L結合并激活,從而加強炎癥反應。孫博文等[16]研究提示IL-33可能與支氣管哮喘的整個慢性炎癥反應有關。本文肝郁型哮喘組中IL-33明顯升高,提示IL-33參與了肝郁型哮喘發病的炎癥過程,柴樸湯通過抗炎途徑能夠有效下調IL-33的表達。
與IL-33類似,TSLP(胸腺基質淋巴細胞生成素)作為一種上皮源性的細胞因子,主要是上調Th2表達。TSLP能夠通過樹突狀細胞來調節體內天然免疫及適應性免疫,導致上皮細胞增生肥大、黏液分泌過多,加重炎癥。在肝郁型哮喘組中,TSLP的蛋白表達及mRNA表達量均明顯高于正常組,使用柴樸湯后,TSLP的表達量明顯下調,這可能與柴樸湯的抗炎作用有關。
綜上,在肝郁型哮喘小鼠中柴樸湯能上調CADM1、MAL的表達,下調IL-33、TSLP的表達。

