肺移植患者圍術期輸血的影響因素分析
王文靜 劉希曦 蘆宏凱 王琪 王璐璐 郭偉潔 曹永彤
肺移植是治療特發性肺纖維化、慢性阻塞性肺疾病等多種終末期肺病的唯一有效方法[1-2]。術中和術后失血不可避免,研究表明,輸血與供者特異性抗體(DSA)增加、急性排斥反應(AMR)、術后存活率降低等顯著相關[3-7]。近年來肺移植術中無輸血成功案例逐漸增多[8],實施無輸血手術有利于控制異體血輸注風險,降低綜合治療成本。因此,本文回顧肺移植手術患者的基本情況、合并癥、手術情況、實驗室檢查以及圍術期輸血情況,明確肺移植患者圍術期輸血的危險因素,為指導臨床優化輸血管理提供依據。
材料與方法
1 研究對象 2017年7月~2020年7月于本院行肺移植術患者263例,去除2例病例不完整和1例年齡低于16歲的患者,納入分析的患者共260例,其中男性221例,女性39例,中位年齡61歲(17~76歲)。分組:根據患者圍術期是否輸注異體血將患者分為無輸血組(46例)和輸血組(214例)。
2 研究方法
2.1 臨床資料 患者基本信息:性別、年齡、吸煙史、BMI、病程、美國麻醉協會分級(ASA)圍術期使用ECMO。合并癥:肺動脈高壓、冠心病、高血壓、糖尿病、肺結核。手術情況:手術類型(單雙肺)、手術時長、術中出血量、供肺冷缺血時間。實驗室檢查:術前和術后第一次血紅蛋白(Hb)、紅細胞比容(Hct)、血小板計數(PLT)、凝血酶原時間(PT)、凝血酶原活動度(PTA)、纖維蛋白原(Fib)、活化部分凝血活酶時間(APTT)、D二聚體(D-D)、纖維蛋白降解物(FDP)。患者圍術期輸注血制品種類包括:懸浮紅細胞、懸浮少白細胞紅細胞、輻照懸浮(少白細胞)紅細胞和洗滌紅細胞,以200 mL全血制備的紅細胞為1 U計算;新鮮冰凍血漿和普通冰凍血漿,以200 mL全血制備的血漿為1 U計算。
2.2 相關說明:本院實驗室相應指標的正常參考范圍如下:H b(男:1 3 0~1 7 5 g/L;女:1 1 5~1 5 0 g/L);Hct(男:4 0.0 0%~5 0.0 0%;女:35.00%~45.00%);PLT(125~350)×109/L;PT(11.0~15.0s);PTA(80%~120%);Fib(2.00~4.00 g/L);APTT(28.0~43.5 s);D-D(0~0.5 mg/L);FDP(<5.00 μg/mL)。根據各指標的正常參考范圍設定分類界限:其中,Hb降低指:男性Hb<130 g/L,女性Hb<115 g/L;Hct降低指:女性Hct<35.00%,男性Hct<45.00%。
3 統計學處理 應用SPSS25.0統計軟件進行數據處理及統計學分析,計數資料采用計數和百分比表示,組間比較采用Pearson卡方檢驗,P<0.05判斷差異有統計學意義。將單因素分析中P<0.1的指標納入二元Logistic回歸分析,獲得肺移植患者圍術期輸血的獨立影響因素。作圖采用Graphpad Prism 8.0軟件。
結 果
1 兩組患者臨床資料和實驗室檢查比較 對納入研究的變量進行統計分析,兩組之間在病程>7年、ASAⅣ級、雙肺移植、供體冷缺血時間>340 min、肺移植手術時長>250 min、出血量>400 mL、術前Hb降低、術前Hct降低、術前PT>15 s、術后第一次PT>15 s、術后第一次PTA<80%、術后第一次APTT>43.5 s方面的差異具有統計學意義(P<0.05),見表1、表2。
2 肺移植患者圍術期輸血的Logistic回歸分析 將表1和表2中P<0.1的指標納入二元Logistic回歸分析,結果顯示,病程>7年、圍術期使用ECMO、術中出血量>400 mL、雙肺移植、術后第一次APTT>43.5 s是肺移植患者圍術期輸血的獨立危險因素。見圖1。

圖1 肺移植患者圍術期輸血的獨立影響因素分析
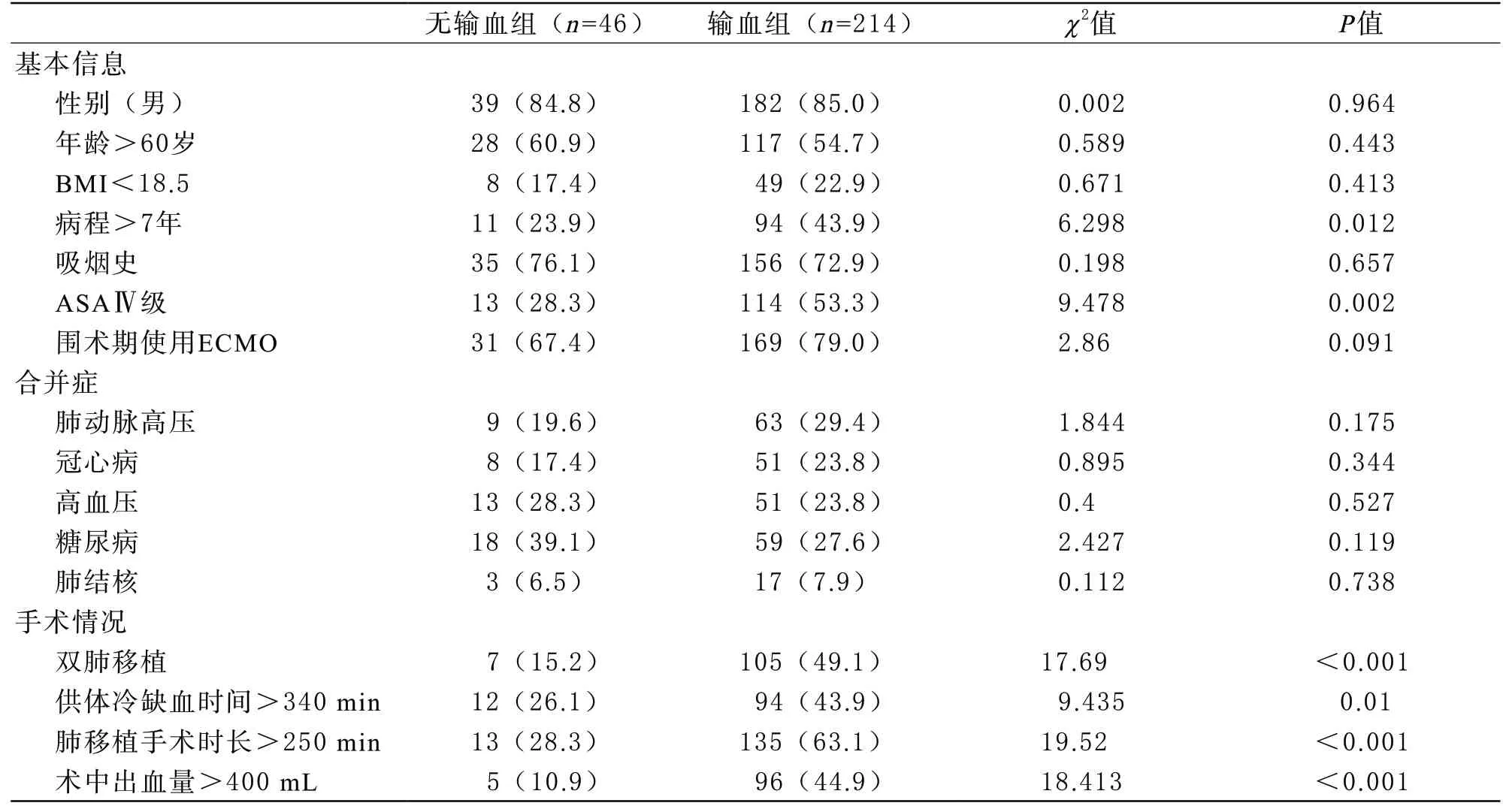
表1 兩組患者臨床資料單因素比較(n,%)

表2 兩組患者實驗室檢查結果單因素比較(n,%)
討 論
肺移植術常發生凝血功能障礙、出血、滲血及各種并發癥,輸血是必要的治療措施。然而輸血治療的同時,也會帶來血液傳播疾病、移植肺感染、再灌注肺損傷、原發性移植物失功(primarygraftdysfunction,PGD)和輸血相關循環超負荷等嚴重不良反應[9-11]。ONG等[12-13]統計了311名雙肺移植患者手術前后24 h紅細胞、新鮮冰凍血漿、血小板輸注量,ICU停留時間,1年死亡率,發現肺移植患者輸注大量血小板(>1個單位)與ICU住院時間(ICU停留時間平均8天)和術后一年死亡率呈正相關,引起輸血相關性肺損傷,加速PGD的進展。HUDDLESTON等人[14]研究發現,術中和術后24 h內無輸血肺移植患者1年生存率和5年生存率分別為93.4%、78.7%,輸注紅細胞、未輸注重組活化凝血因子Ⅶ的患者87.6%、63.2%,輸血顯著降低患者術后生存率。
本研究分析顯示,術后第一次APTT>43.5 s是患者圍術期輸血的獨立危險因素,無輸血組APTT延長比例明顯低于輸血組。本院APTT正常參考范圍是28s~43.5 s,超過上限標志著凝血功能異常,當超過上限的1.5倍時,達到輸血臨界指標。術中、術后的出血、用藥所致的凝血功能異常會使APTT延長。ECMO循環支持和肝素抗凝藥物的應用,也會導致凝血因子水平降低。當使用循環支持設備時,管路涂層中和患者體內的肝素降低凝血因子含量,運轉中的設備加劇紅細胞和血小板破壞,進一步削弱凝血功能,延長APTT。因此術中應密切監測APTT,改善患者凝血功能,可減少輸血風險[15]。歐洲胸心外科協會(EACTS)和胸心麻醉學協會(EACTA)血液管理指南推薦[16],使用凝血酶原復合物包括Ⅱ、Ⅶ、Ⅸ、Ⅹ凝血因子,可用于治療凝血因子缺乏引起的出血。術后應持續監測患者胸腔引流量,排除創面滲出的血液,及時補充血漿。
雙肺移植的輸血風險高于單肺移植,是患者圍術期輸血的又一獨立危險因素。無輸血組雙肺移植(15.2%)比例明顯低于輸血組(49.1%)。雙肺移植患者雖然術后長期存活率、功能改善方面優于單肺移植[17-18],但也存在手術時間和供肺冷缺血時間較長,出血量較大的風險,需輸血治療。
本研究顯示,術中出血量>400 mL的患者圍術期輸血風險更高。由于手術難度大,如患者胸膜粘連嚴重,以致病肺剝離更加困難,雙肺序貫移植較單肺移植花費更長時間,出血和輸血風險更高[19]。2017年歐洲麻醉協會[20-21]創傷后出血和凝血障礙的指南建議,縮短發生創傷與控制出血之間的時間間隔,創傷后3 h內給予靜脈注射氨甲環酸,首次滴注1 g不少于10 min,隨后緩慢滴注1 g不短于8 h,可有效降低出血量和輸血量。
有ECMO循環支持的患者輸血風險高于無ECMO患者。輸血組有79%患者需要ECMO支持,明顯高于無輸血組(67.4%)。ECMO作為一種循環支持方式,越來越多的用于術前患者等待肺移植的過渡、肺移植術中、術后的循環支持以及PGD的治療,以保證機體正常供氧。然而ECMO轉流后管路、泵體加劇了血液中紅細胞、血小板、纖維蛋白原凝血因子的損失;肝素的應用、凝血系統的激活、血小板和凝血因子的消耗,也會造成患者體內出血傾向,增加術中和術后輸血治療風險。SEF等[22]研究發現,不同體外循環支持方式的患者輸注大于10 U紅細胞的比例差異明顯,其中ECMO組為40%,非體外循環組為5.4%。因此臨床需要根據患者具體情況進行評估,確定引入ECMO支持的恰當時機。
病程>7年是圍術期輸血的獨立危險因素,無輸血組(23.9%)比例明顯低于輸血組(43.9%)。由于慢阻肺、間質性肺病、囊性纖維化、肺癌等慢性原發病的存在,會使患者長期處于炎癥性貧血狀態[23-25],促炎細胞因子引起鐵代謝異常、腸道鐵吸收抑制、EPO分泌不足和紅細胞生成減慢造成的貧血。
本研究局限于無輸血組樣本量不夠大,僅收集了單中心近三年的病例;受限于檢查條件的不足,部分患者缺少術前CT影響資料,對評估剝離病肺時間和預測出血和輸血量有一定影響。
綜上所述,肺移植術前應充分評估患者基本情況,通過對病程、圍術期使用ECMO、術中出血量、單/雙肺移植等因素的分析和評估,有助于臨床預測和合理備血。
利益沖突 所有作者均聲明不存在利益沖突

