高血糖對紅細胞理化性質及免疫功能影響的研究進展*
張紫薇 周曉芳 郭建榮
據資料顯示,2017年全球范圍內18歲以上成年人的糖尿病患病率為8.4%,預計到2045年將上升至9.9%,其中發病率在65歲~70歲時達到頂峰,而中國人口結構老齡化的問題日益加重,臨床上合并糖尿病的患者勢必增多[1]。紅細胞作為人體內占比最大的血細胞,承擔著運輸O2、增強吞噬功能、免疫黏附及抗感染的職責,而紅細胞的變形性是保障其功能正常發揮的重要條件。研究顯示,紅細胞變形性會隨疾病嚴重程度的增加而降低,“不良”代謝狀態下的糖尿病患者的紅細胞變形能力明顯減弱[2],這預示著糖尿病患者體內高血糖水平會影響紅細胞的功能,進而加重患者體內的微循環障礙。
1 高血糖對紅細胞理化性質的改變
1.1 糖化血紅蛋白:糖化血紅蛋白(haemoglobin A1c,HbA1c)是葡萄糖和血紅蛋白間通過非酶促糖基化作用發生的不可逆反應的產物,它取決于血糖水平、糖尿病病程和紅細胞壽命[3]。目前臨床上多采用2010年由世界衛生組織提出的HbA1c≥6.5%作為糖尿病的診斷標準,血糖和HbA1c間的顯著正相關現已被廣泛接受[4],當平均血糖升高2 mmol/L時,HbA1c升高1%。2型糖尿病患者胰島β細胞分泌功能與HbA1c水平及病程呈負相關,相對于病程,患者胰島β細胞分泌功能受HbA1c水平的影響更大[5]。隨著血糖的升高,高血糖癥會導致血紅蛋白和葡萄糖間的非酶蛋白糖基化增加,從而增加HbA1c水平。另一方面,高血糖癥會使紅細胞壽命縮短,從而減少血紅蛋白和葡萄糖間糖基化的反應時間,導致HbA1c產生減少。因此,紅細胞壽命縮短這一因素可能導致最終的HbA1c水平低于預測值,進而影響病情的診治[6]。
1.2 能量代謝:糖酵解是紅細胞內ATP生成的唯一代謝途徑,受到己糖激酶、磷酸果糖激酶、丙酮酸激酶催化反應的嚴格控制,且這些步驟具有不可逆性[7]。2型糖尿病患者紅細胞中主要的糖酵解酶活性發生了顯著變化,其中己糖激酶活性顯著增加,使得細胞內6-磷酸葡萄糖濃度升高,但磷酸果糖激酶活性顯著降低導致糖酵解過程受到抑制[8-9],影響ATP的合成,損害2型糖尿病患者的紅細胞變形能力。同時,2型糖尿病患者紅細胞中的乳酸脫氫酶活性隨著動力學性質的改變而增加,有助于將丙酮酸轉化為乳酸,從而導致乳酸性酸中毒,這也是糖尿病的突出臨床表現之一[10]。另外,由于體內血氧張力降低而導致的紅細胞釋放ATP能力受損、腺嘌呤和鳥嘌呤核苷酸去磷酸化的增加均表明2型糖尿病患者體內能量代謝障礙較為嚴重[11-12]。
1.3 紅細胞形態:與正常紅細胞相比,糖尿病患者的紅細胞有凹陷深度、直徑、高度和變形指數等形態的變化,軸比、剛度、粘著力、聚集和剛度指數均增加[13]。糖尿病患者的紅細胞具有細長的外形以及更光滑的細胞膜,其胞膜延伸形成的突起可圍繞纖維蛋白自發扭曲[14]。見圖1。
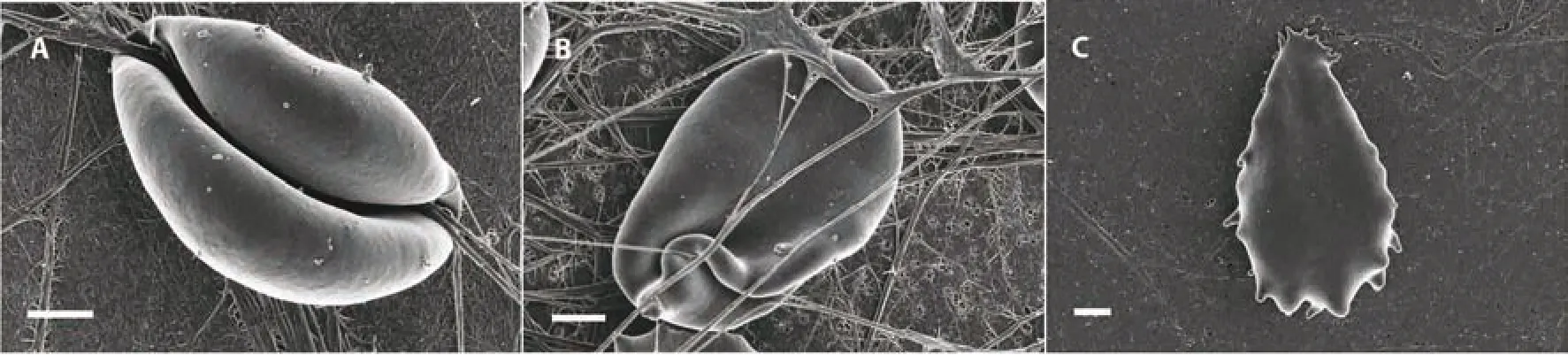
圖1 掃描電子顯微鏡下糖尿病患者的紅細胞形態[14]
1.4 磷脂酰絲氨酸:由于氧化應激抑制了細胞膜的運動,導致高血糖狀態下紅細胞膜磷脂的不對稱,膜脂質過氧化、流動性減弱、表面磷脂酰絲氨酸外翻增多,最終易被單核-巨噬細胞系統清除。細胞表面的磷脂酰絲氨酸外露,通常被認為是參與吞噬作用(“eat-me”信號)的第一步。相對于老化而言,糖基化顯著增強了紅細胞膜磷脂酰絲氨酸的外翻作用[15]。
1.5 CD47:紅細胞膜蛋白CD47的表達在衰老條件下受到調節,其構象變化可能代表參與紅細胞吞噬的另一個“eatme”信號。在糖化紅細胞的膜上,CD47的整體表達量不變,但其構象發生了改變,表明糖化紅細胞向吞噬細胞提供了潛在的“eat-me”信號。與正常紅細胞相比,糖化紅細胞溶血半衰期(HT50)降低了71%,抗自由基誘導溶血的能力顯著下降,表明糖基化可導致紅細胞膜的氧化損傷從而引起紅細胞脆性增加[16]。
1.6 微囊泡:微囊泡(microvesicles, MVs)是多種類型的細胞損傷或凋亡后從細胞胞體脫落到細胞外空間的小囊泡,其名稱取自它們最初來源的細胞,如內皮細胞微囊泡(EMVs)、紅細胞衍生微囊泡(ErMVs)和血小板衍生微囊泡(PMVs)[17,18]。EMVs與內皮功能障礙有關,PMVs與血小板活化有關,ErMVs與血栓形成和穩定性有關。胰島素抵抗增加了細胞外囊泡的分泌,胰島素信號傳導蛋白的水平在具有高水平胰島素抵抗和β細胞功能障礙患者的細胞外囊泡中被改變,MVs優先被白細胞內化致使炎癥信號通路激活,白細胞參與紅細胞活性、氧化應激及免疫調控相關的功能也隨之改變[19]。ErMVs的分泌與HbA1c水平無關,而是與空腹血糖水平呈正相關。此外,MVs不僅是高血糖癥在2型糖尿病中增加血栓形成傾向的新機制,還是血栓形成的早期標志物[20]。2 糖毒性對紅細胞的損害
2.1 紅細胞膜:高血糖通過對膜的直接作用影響紅細胞流變學,包括脂質膜雙層組成和微粘度的改變以及膜Na+-K+--ATP酶功能的變化。糖尿病患者紅細胞膜的脂肪酸模式發生改變,如含有更高水平的飽和脂肪酸、更低水平的不飽和脂肪酸和更低濃度的ω-3脂肪酸。與正常紅細胞相比,在糖尿病患者紅細胞中觀察到較低水平的磷脂酰膽堿和磷脂酰乙醇胺,以及較高水平的鞘磷脂和膽固醇,由此可見糖尿病患者紅細胞膜的脂質組成產生顯著改變。這些變化均可通過干擾紅細胞向組織輸送O2而參與糖尿病微血管并發癥的發生[21]。而作為維持細胞內外離子動態平衡的關鍵酶Na+-K+-ATP酶,則可通過調節細胞體積影響紅細胞的變形性[22]。
2.2 紅細胞變形性:糖尿病患者紅細胞膜的變形性顯著低于正常紅細胞。值得注意的是,糖尿病患者紅細胞的細胞質中升高的HbA1c水平和降低的細胞變形性間存在明顯的相關性。紅細胞血紅蛋白和膜蛋白緩慢不可逆的糖化損害了紅細胞的變形性[23],研究發現HbA1c水平高于9.05%后,紅細胞變形能力顯著降低[24]。
2.3 紅細胞壽命:與正常紅細胞相比,糖尿病患者紅細胞壽命顯著縮短,且紅細胞壽命與空腹血糖水平呈負相關[25]。細胞外氧化環境可能是2型糖尿病患者紅細胞caspase-3活化的原因,有研究將caspase-3的激活設想為一種新的機制,該機制通過損害紅細胞的形狀和功能,與其他途徑一起導致2型糖尿病患者紅細胞壽命縮短,并使患者的部分血液流變學參數出現異常[26]。人紅細胞肌酸(erythrocyte creatine,EC)含量會隨著紅細胞的老化而降低,EC含量是反映平均紅細胞壽命的指標。與正常紅細胞相比,2型糖尿病患者高EC水平紅細胞的比例明顯增加。同時,女性患者高EC水平紅細胞的比例顯著高于男性,表明女性紅細胞對高血糖造成的損傷更為敏感[27]。
2.4 紅細胞攜氧功能:血紅蛋白是紅細胞在血液循環中運輸O2和CO2的主要載體,糖尿病患者體內存在高氧化應激水平,酸堿代謝失衡可使紅細胞血紅蛋白結構改變以及紅細胞內2,3-DPG濃度降低,從而影響血紅蛋白的攜氧和釋氧能力,造成機體組織器官氧供不足,加重內環境紊亂[28-29]。與正常紅細胞相比,糖尿病患者紅細胞中精氨酸酶I的表達增強,促進生成活性氧,而活性氧反之上調紅細胞精氨酸酶I的表達,進一步刺激活性氧生成,最終形成內皮功能障礙[30]。在血管收縮引起組織灌注減少的情況下,紅細胞變形性降低,全血粘度增加,使得紅細胞難以通過微細血管并易聚集成團造成阻塞,進一步影響其攜氧功能,進而產生惡性循環[31-33]。
3 糖尿病對紅細胞免疫調節功能的影響
3.1 攜帶抗原:在毛細血管中,紅細胞與毛細血管壁的摩擦使紅細胞產生電荷,當血液中的細菌靠近紅細胞,電荷的相互作用將細菌吸引并固定在紅細胞表面,同時血紅蛋白釋放O2氧化殺死細菌,死亡的細菌失去電荷,吸引力變弱脫落入血漿。若細菌能抵抗氧化作用,它將沿紅細胞表面滑動,并在高速流動的血液中被困于紅細胞凹面形成的“口袋”里。與正常紅細胞相比,糖尿病患者紅細胞體積減小,凹陷深度減小,表面粗糙程度降低,其與毛細血管壁之間摩擦產生的電荷減少,吸引細菌并固定在其表面的能力減弱,致使其攜帶細菌、病毒等抗原的功能減低[34]。
3.2 清除循環免疫復合物:血液系統中90%以上的補體受體1(complement receptor 1,CR1)位于紅細胞表面,循環中免疫復合物主要由紅細胞CR1攜帶并交給肝脾網狀內皮系統中的巨噬細胞加以清除。糖尿病患者紅細胞膜CR1受到損害和消耗,C3b受體結合花環率(RBC-C3bRR)降低以及紅細胞免疫復合物結合花環率(RBC-ICR)升高,表明糖尿病患者紅細胞清除循環免疫復合物能力下降。體內免疫復合物無法及時清除而沉積在毛細血管系統可引起炎癥和栓塞,這也是糖尿病并發癥發生的基礎。且隨著空腹血糖水平(fasting plasma glucose,FPG)的升高,RBC-C3bRR改變程度較RBC-ICR明顯,說明FPG的變化對紅細胞免疫黏附能力的影響更顯著[35]。
3.3 T細胞依賴反應:T淋巴細胞在機體特異性免疫應答過程中起關鍵作用,CD4+T細胞主要參與體液免疫,可誘導B淋巴細胞的活化與增殖,并促進CD8+T細胞發育成熟。CD8+T細胞主要參與細胞免疫,受抗原刺激后可轉化為細胞毒性T細胞引起靶細胞裂解死亡。糖尿病患者體內CD3+T細胞總數、CD4+T細胞數量、CD4+/CD8+細胞比值及RBC-C3bRR均明顯下降,而糖尿病患者RBC-C3bRR與CD3+、CD4+T細胞的數量呈正相關,表明紅細胞免疫粘附功能的受損可影響T細胞的數量,導致機體自身免疫調節功能紊亂[36]。
3.4 促吞噬作用:與其他細胞相比,吞噬細胞和多形核細胞識別吞噬紅細胞攜帶的循環免疫復合物的速度更快,紅細胞也可顯著增強吞噬細胞吞噬C3b-循環免疫復合物的功能,而其自身不會受到損傷[37]。糖尿病患者紅細胞膜上的CR1功能受損,將C3b-循環免疫復合物中的C3b降解為iC3b的能力下降,使得粒細胞及單核細胞等吞噬細胞上CR3與iC3b的結合速率受到影響。且糖尿病患者紅細胞超氧化物歧化酶活性降低,消除吞噬細胞在吞噬過程中受到過氧化物氧化的功能隨之下降,導致吞噬細胞功能受損,因此糖尿病患者紅細胞的促吞噬作用減弱[38]。
4 展望 作為糖尿病慢性并發癥的重要病理生理基礎,微循環障礙在糖尿病胰島素抵抗期便已存在,微循環功能的異常參與了整個糖尿病的發展過程[39]。糖尿病患者內環境的改變,損害了紅細胞的形態、結構與功能,加重了糖尿病患者體內缺血缺氧的微循環狀態。研究糖尿病對紅細胞理化性質及免疫功能的影響對糖尿病的機制研究與臨床治療具有一定的指導意義。
利益沖突所有作者均聲明不存在利益沖突

