經神經內鏡行基底節區高血壓腦出血治療的臨床研究
汪瑞 倪初源 孫一睿
基底節區高血壓腦出血好發于幕上深部灰質核團,廣義的基底節更是將紅核、黑質、丘腦底核也納入其中。隨著人口老齡化,高血壓腦出血的發病率居高不下,短期死亡率高達30%~60%,10年生存率僅為24%[1],致死致殘率高。骨瓣開顱清除血腫是既往的主要外科術式,但隨著顯微技術的發展和微創理念的深入,其中鉆孔置管抽吸引流術,小骨窗(瓣)開顱經側裂-島葉入路血腫清除術,以及神經內鏡下血腫清除術較傳統骨瓣開顱,已明顯展示出其優越性、有效性及安全性[2]。近年來神經內鏡技術在各基層醫院逐漸普及,在急診腦出血手術中成為了除顯微手術和立體定向手術之外的可選治療方案。然而三種微創手術之間的療效比較研究報道較少,本研究旨在探討三種微創手術治療基底節區高血壓腦出血患者的臨床療效,為手術治療基底節區高血壓腦出血提供最佳方案。
1 資料與方法
1.1 一般資料 本研究回顧性分析黃山市人民醫院2017年1月至2020年1月收住院的基底節區高血壓腦出血患者115例,男79例,女36例;年齡33~87歲,平均年齡(58.9±9.9)歲;患者入院時收縮壓(177.9±27.1)mm Hg,舒張壓(100±17)mm Hg。3組一般資料比較(除術前血腫量和出血部位外)差異無統計學意義(P>0.05),具有可比性。
1.2 納入與排除標準
1.2.1 納入標準:①符合基底節區高血壓腦出血的診斷標準[3]:A既往有高血壓病史,發病時血壓偏高(收縮壓≥140 mm Hg);B急性起病,伴隨神經功能障礙,如頭痛、惡心嘔吐等顱高壓表現,以及三偏征等;C CT或MRI證實基底節區出血,CTA或DSA進一步排除腦血管疾病,如動脈瘤、動靜脈畸形等;②出血量30~100 ml;③手術治療。
1.2.2 排除標準:①繼發性腦出血,如腫瘤、血管病、外傷等;②術前有嚴重臟器功能衰竭及凝血功能異常。多臟器功能衰竭診斷標準[4]:A血氣指標:PaO2<6.67 kPa(50 mm Hg),PaCO2>6.67 kPa(50 mm Hg);B血尿素氮>7.14 mmol/l(20 mg/dl);肌酐>353.6 μmol/L(4 mg/dl);C膽紅素升高:>171 μmol/L,或者每日升高>17 μmol/L。D凝血功能異常:血小板計數<50×109/L;凝血酶原時間(PT)>15 s;部分凝血活酶時間(APTT)>60 s;血漿纖維蛋白原<2 g/L;③術前腦疝以及腦干功能衰竭者。
1.3 治療方法 患者入組后,主治醫生應在24 h內施行血腫清除術。具體手術方式由主治醫生根據患者病情及手術條件決定。科室人員均報名培訓班規范與統一手術操作。具體如下:(1)鉆孔組:術前根據冠狀位、矢狀位及橫斷位CT平掃結果評估血腫部位和形狀,選擇血腫距皮層最近點的非功能區為穿刺點,橫向額紋切口或縱向顳部切口,垂直球形腦表面穿刺,引流管置于血腫中后1/3,術中抽吸出血腫的30%,術后復查頭顱CT,酌情行尿激酶溶栓治療(2萬U/bid,夾管2 h后打開),當引出80%以上血腫時,拔出引流管。(2)側裂組:改良翼點入路,顯微解剖Sylvian淺靜脈,由M2雙干之間的島葉皮層進入血腫腔清除血腫。責任血管一般為豆紋動脈外,電凝處理。根據術中腦壓情況決定是否去骨瓣減壓。(3)內鏡組:腦室額角穿刺點直切口,骨窗直徑2~2.5 cm,切開硬膜、蛛網膜,電凝皮層后,置入內鏡套筒,神經內鏡(STORZ,硬質4 mm,0°)由深至淺緩慢吸除血腫。3組術后常規給予吸氧、止血、脫水降顱壓、強化降壓、營養支持等對癥處理。
1.4 觀察指標及療效評定標準 6個月后死亡率及mRS預后評分:mRS評分分級標準:(1)mRS評分≤2分提示預后良好。(2)mRS評分≥3分提示預后差。
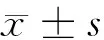

表1 Logistic回歸模型中主要變量及其賦值
2 結果
2.1 3組基線特征比較 3組年齡、性別比、就診時間、術前GCS評分、術前NIHSS評分、術前血壓、既往高血壓、糖尿病、腦卒史、吸煙飲酒史等組間均衡(P>0.05),具有可比性。(2)其中術前血腫量(P=0.002)和出血部位(P=0.001)組間不均衡,為減小混雜因素影響,上述變量分別納入多元邏輯回歸分析,先行單因素分析,P<0.1進入多因素分析,P>0.1剔除。見表2。

表2 3組基線特征比較
2.2 6個月死亡危險因素的單因素分析及二項Logistic回歸分析 先將和6個月死亡有關的可能危險因素進行單因素分析,手術方式、血腫清除率、術前NIHSS評分、術前GCS評分、顱內再出血、術中失血量及術后腦梗死這7項變量可能和6個月死亡有關(P<0.1)。將其納入二元邏輯回歸,行多因素分析。三種微創手術方式在降低基底節區高血壓腦出血患者6個月病死率上差異無統計學意義(P>0.05)。(2)術前NIHSS評分越高,患者6個月死亡風險越高(P=0.039,OR=3.021)。見表3、4。
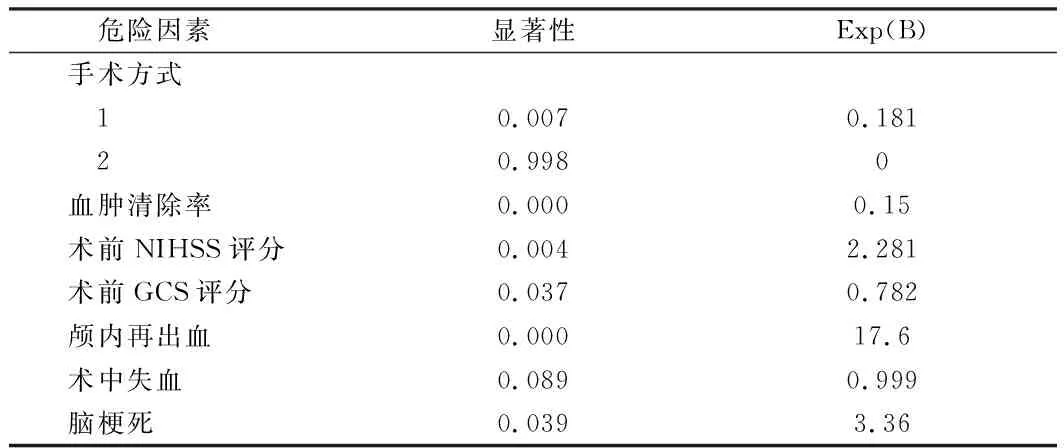
表3 死亡相關危險因素單因素分析
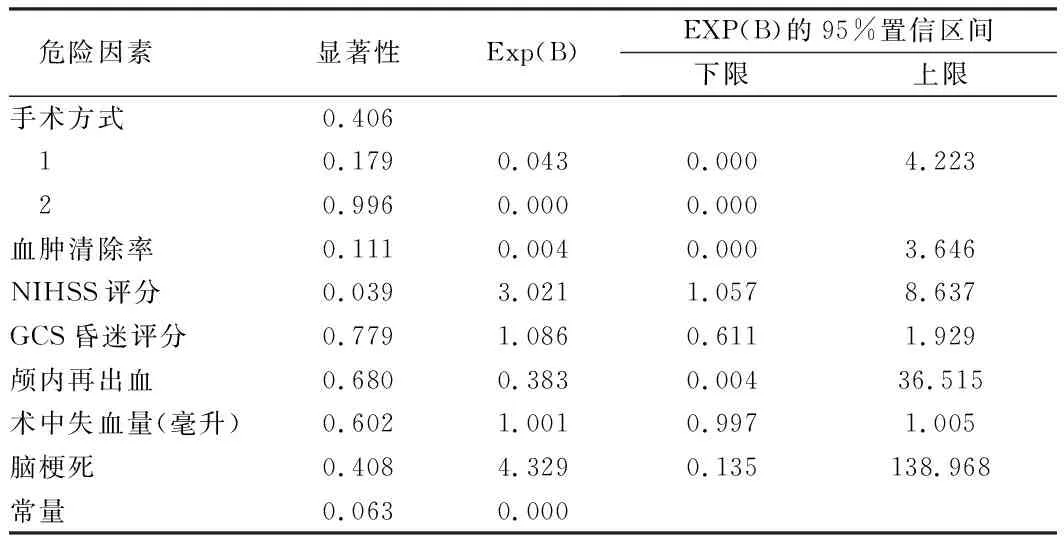
表4 6個月死亡危險因素的二項Logistic回歸分析
2.3 6個月預后危險因素的二項Logistic回歸分析 先將和6個月預后有關的可能危險因素進行單因素分析,手術方式、血腫清除率、術前NIHSS評分、術前GCS評分、術前血腫量、顱內再出血、術中失血、術后腦梗死、年齡和出血部位這10項變量可能和6個月預后有關(P<0.1)。將其納入二元邏輯回歸,行多因素分析。神經內鏡手術(P=0.027,OR=19.056)相對于鉆孔引流術能明顯改善基底節出血患者6個月預后。(2)術前GCS評分越高,預后越好(P=0.007,OR=1.861)。術前NIHSS評分越高,預后越差(P=0.002,OR=0.657)。見表5、6。

表5 預后相關危險因素單因素分析
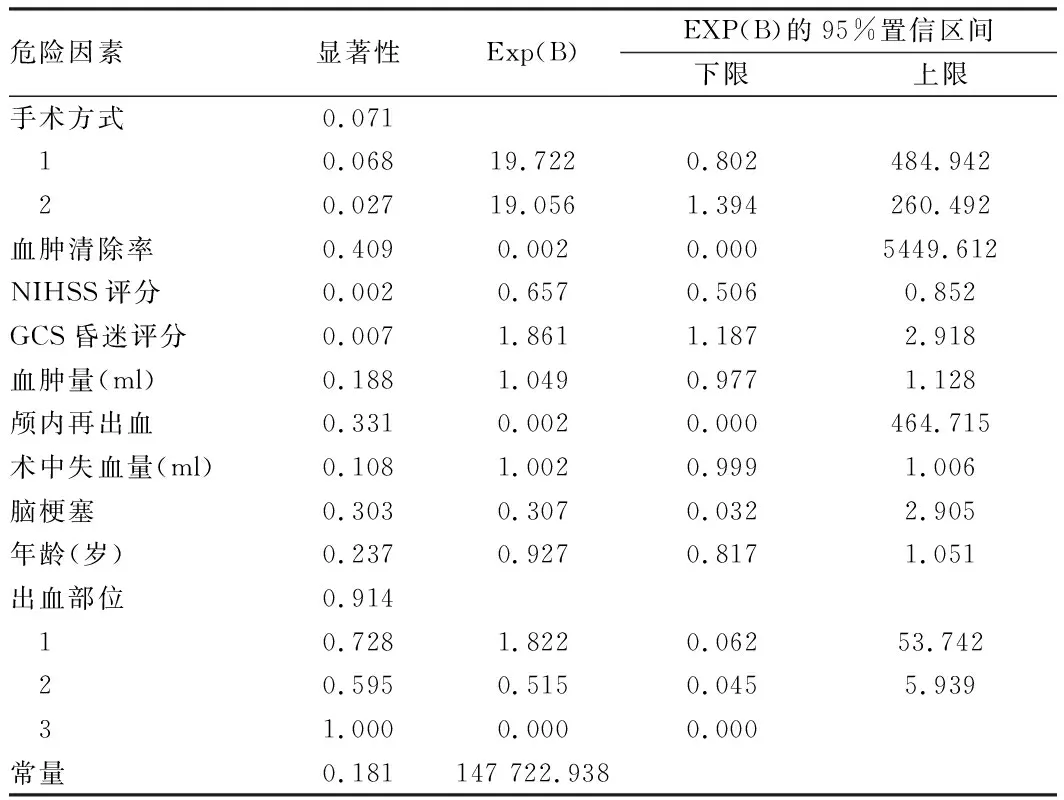
表6 6個月預后危險因素的二項Logistic回歸分析
3 討論
中國是出血性腦卒中高發地區,年死亡率約為(114.8~159.8)/100 000人。基底節區是高血壓腦出血的最常好發部位,至少有70%的該部位患者致死或致殘[5]。當出血量較大,常需外科干預,手術是有效的搶救方式[6]。但STICH-Ⅱ研究認為傳統的骨瓣開顱手術創傷大,較保守治療并不能降低患者病死率或改善預后[7]。隨著神經顯微外科的發展,和傳統手術及保守治療相比,微創手術的安全性和有效性越來越顯現出優勢[8],目前有關腦出血主要的微創手術方式有三種,分別是鉆孔置管抽吸引流術,小骨窗(瓣)開顱經側裂-島葉入路血腫顯微清除術以及神經內鏡下血腫清除術。
神經內鏡手術作為近年興起的微侵襲手術方式,優勢明顯,比如創傷小,術時短,清晰度高,視野好,能早期清除血腫,防止繼發性腦損傷。Ratre等[9]認為神經內鏡手術是有效和安全的,可以很好地顯示血腫和周圍的腦組織,并有助于精確止血。Xu等[10]報道內鏡組的平均手術時間較開顱組明顯縮短,這和本次研究結果一致,提示內鏡手術創傷小,耗時短,且血腫清除效果佳,患者住院時間短,術后恢復快。但該術式也有一定局限性,比如術野較小,可直視范圍窄;內鏡下操作不熟練甚至有可能加重對正常腦組織和側裂區血管損傷。助手也需要掌握基礎的神經內鏡技術,否則術中配合不流暢,導致手術時間延長,影響手術效果。所以,在熟練掌握神經內鏡操作的基礎上,神經內鏡下手術可能是一種更為有效的治療方法。
Fu等[11]通過對比發現穿刺引流術創傷最小,手術時間短,但不能快速清除血腫,再出血率最高,其是否和尿激酶操作有關,目前還需進一步證實。本次研究中,溶栓藥物選擇了尿激酶(uPA),和Qiang等[12]的實驗結果一致,認為相較組織型纖溶酶原激活劑(tPA),uPA能更有效的上調血腦屏障緊密結合蛋白,更好減輕腦出血后的水腫反應,并改善患者預后。Sun等[13]報道:鉆孔引流術伴尿激酶灌注溶栓不會增加術后再出血率,和小骨瓣開顱組比較,2組遠期神經功能預后無差異。但對于術前出血量大、顱高壓、腦疝患者而言,該方法由于無法緩解顱高壓而不作為首選。吳留洋等[14]認為對于出血量>60ml腦出血患者,該術式效果相對較差。
外側裂是天然腦間隙,經側裂-島葉入路顯微手術路徑最短,同時避開重要神經傳導束和功能區,理論上手術創傷最小(主要指腦創傷)。術中通過變動患者頭位,適度的腦牽拉和顯微鏡的投射方向,能全方位暴露血腫腔,最大限度發現責任血管。Hwan等[15]報道,和皮層造瘺相比,經側裂-島葉入路能更有效降低術后致殘率及致死率。特別是優勢半球的語言中樞與視神經束等功能區無附加損傷。本次研究中側裂組的再出血率明顯低于鉆孔組,說明側裂-島葉入路止血效果更佳。但側裂組的術后腦梗死發生率稍高,可能和側裂組術中牽拉暴露,側裂血管過度騷擾有關。在改善預后和降低死亡率上,和內鏡組一樣均好于鉆孔組。
本研究有幾點局限性:(1)回顧觀察性研究,有選擇偏倚。如術前血腫量等組間不平衡。(2)單中心研究,樣本量小。(3)沒有進一步分層分析,如術前血腫量,年齡以及術前GCS評分等。(4)結論可能受到手術醫生的影響,參與研究的手術醫生對于三種術式的技巧掌握和熟練度不同,有的擅長內鏡,而有的更擅長側裂入路手術和鉆孔引流術。
綜上所述,3種手術方式在降低基底節出血患者遠期病死率上無顯著差異;但是神經內鏡手術能更好改善預后,且圍手術期并發癥更少,治療費用低,住院時間短,成本效益高,在臨床上值得推廣。

