下調(diào)miR-32對幽門螺桿菌誘導的腸上皮細胞凋亡及TAK1-p38通路的影響
易慶軍 楊宇 胡煜 吳曉芳
幽門螺桿菌(helicobacter pylori,H.pylori)一種生存于胃和十二指腸內(nèi)的革蘭氏陰性需氧菌,該菌感染最先損害胃黏膜組織,引起胃黏膜上皮細胞增生、凋亡,促進胃癌癌前病變及發(fā)展[1-3]。近來由H.pylori引起的小兒腸炎發(fā)病率逐漸增加,腸炎是常見消化道疾病,可引起小兒腹痛、腹瀉及消化不良,若不及時正確干預可導致慢性腸炎,導致兒童可能出現(xiàn)營養(yǎng)不良,甚至嚴重影響兒童的健康和生長[4]。H.pylori感染可通過招募和誘導中性粒細胞導致相關蛋白及微小RNA(microRNA,miRNA)異常表達,釋放細胞毒素等物質(zhì)。miRNA是一類非編碼小RNA,在進化過程中高度保守,多種miRNA異常表達在腸上皮炎癥損傷及腸癌發(fā)生發(fā)展過程中發(fā)揮重要作用[5,6],研究報道m(xù)iR-32在結直腸癌組織中顯著上調(diào),可誘導其凋亡[7],miR-32-5p上調(diào)可加重H.pylori所致小兒腸炎的腸上皮細胞損傷[8],但其機制尚不完全明確。轉(zhuǎn)化生長因子β激活激酶1(transforming growth factor β activated kinase 1,TAK1)是p38絲裂原激活蛋白激酶(p38 mitogen activated protein kinases,p38)和核因子-κB信號通路共同上游調(diào)節(jié)因子,與炎癥損傷密切相關[9]。因此本研究擬探究下調(diào)miR-32對通過H.pylori誘導HIEC-6細胞凋亡及TAK1-p38通路的影響,以期揭示其作用機制,為臨床小兒腸炎的靶向治療提供新的思路,報道如下。
1 材料與方法
1.1 細胞、主要試劑及儀器 HIEC-6細胞購自中國細胞資源庫保藏中心。H.pylori菌株購自ATCC細胞庫;DMEM/F-12培養(yǎng)基(貨號:12634010)、胎牛血清(fetal bovine serum,F(xiàn)BS,貨號:10099-145)購自美國Gibco公司;CCK-8試劑盒(貨號:11465007001)、AnnexinV-FITC凋亡檢測試劑盒(貨號:APOAF)購自美國Sigma公司。Lipofectamine? 2000轉(zhuǎn)染試劑盒(貨號:11668)購自美國Invitrogen公司;引物及miR-32 inhibitor/NC序列由廣州銳博生物工程有限公司合成;兔源一抗anti-TAK1(貨號:ab196955)、anti-p38(貨號:ab170099)、anti-GAPDH(貨號:ab181602)、二抗羊抗兔IgG(貨號:ab6721)均購自英國Abcam公司;Evolution 220紫外分光光度計、FC酶標儀、Forma Steri-Cycle i160 5%CO2培養(yǎng)箱購自美國Thermo Fisher公司;7500 RT-qPCR儀購自美國Bio-Rad公司;FACS Canto II流式細胞儀購自美國BD公司;IX75倒置熒光顯微鏡購自日本Olympus公司等。
1.2 方法
1.2.1 細胞培養(yǎng):HIEC-6細胞常規(guī)復蘇后采用含10%FBS、1%青鏈霉素的DMEM/F-12培養(yǎng)基置于37℃、5%CO2、完全飽和濕度細胞培養(yǎng)箱中培養(yǎng)。細胞傳代時用0.25%胰蛋白酶消化處理。
1.2.2 細胞轉(zhuǎn)染及分組:取對數(shù)期生長HIEC-6細胞接種于6孔細胞培養(yǎng)板,分別設為空白對照組(BC組)、H.pylori組、H.pylori+NC組、H.pylori+inhibitor組。H.pylori用無菌PBS重懸,2 000 r/min離心后留取沉淀,添加2%FBS DMEM/F-12培養(yǎng)基調(diào)成為1×1012cuf/L。H.pylori組以細菌:細胞為200∶1共孵育24 h;H.pylori + NC組、H.pylori + inhibitor組均采用Lipofectamine? 2000轉(zhuǎn)染法分別轉(zhuǎn)染miR-32 inhibitor-NC、inhibitor序列,孵育4~6 h更換含有H.pylori新鮮培養(yǎng)基給予孵育24 h,轉(zhuǎn)染具體操作嚴格按照試劑盒說明書進行;BC組為未進行任何處理正常生長細胞,每組6個重復。24 h觀察到熒光表達,并通過實時熒光定量PCR(real-time quantitative PCR,RT-qPCR)驗證轉(zhuǎn)染效果。
1.2.3 CCK-8檢測HIEC-6細胞活性:將4組HIEC-6細胞以1×104個/孔密度接種于96孔細胞板,每組6個復孔,采用CCK-8試劑盒檢測各孔HIEC-6細胞450 nm處吸光度(OD)值,細胞活性(%)=(OD試驗組-OD空白組)/(OD對照組-OD空白組)×100%。
1.2.4 Annexin V-FITC/PI檢測HIEC-6細胞凋亡情況:收集各組HIEC-6細胞,并以1×109/L的濃度將細胞重懸于PBS液,添加5 μl Annexin V和5 μl PI室溫避光孵育15 min后,使用流式細胞儀檢測各組細胞凋亡情況。
1.2.5 ELISA檢測HIEC-6細胞上清液TNF-α、IL-6表達量:收集各組HIEC-6細胞,離心后留取上清液,采用酶聯(lián)免疫吸附試驗(enzyme-linked immunosorbent assay,ELLSA)檢測上清液中TNF-α、IL-6表達量,具體操作步驟嚴格按照試劑盒說明書進行。
1.2.6 RT-qPCR檢測HIEC-6細胞miR-32、TAK1、p38 mRNA表達:采用Trizol提取各組HIEC-6細胞總RNA,用紫外分光光度計檢測總RNA濃度及純度(OD260/280為1.7~2.0)。反轉(zhuǎn)錄得到cDNA,置于-20℃保存?zhèn)溆谩2捎肦T-qPCR儀擴增miR-32、TAK1、p38 mRNA片段。反應體系(20 μl):TB Green Premix Ex Taq II(Tli RNaseH Plus)(2×) 10.0 μl,ROX Reference Dye II(50×)0.4 μl,cDNA(50 ng/μl)2.0 μl,上下游引物(10 μmol/L)各0.8 μl,ddH2O 6.0 μl。反應條件為:95℃ 30 s;95℃ 5 s,60℃ 34 s,40個循環(huán)。采用2-ΔΔCT法定量分析細胞中miR-32、TAK1、p38 mRNA相對表達水平。見表1。

表1 RT-qPCR引物序列
1.2.7 WB檢測HIEC-6細胞TAK1、p38蛋白表達水平:提取4組HIEC-6細胞總蛋白,BCA法測定蛋白濃度,置于-80℃冰箱保存待用。采用免疫印跡(western blot,WB)法檢測TAK1、p38蛋白表達。取50 g蛋白樣品經(jīng)十二烷基硫酸鈉-聚丙烯酰氨凝膠電泳(SDS-PAGE)、轉(zhuǎn)膜、封閉、一抗孵育(anti-TAK1稀釋比
1∶1 000;anti-p38稀釋比1∶2 000;anti-GAPDH稀釋比1∶5 000),4℃過夜,二抗孵育(IgG稀釋比1∶10 000),37℃ 1 h,顯像、曝光、拍照并分析結果。以靶蛋白灰度值與內(nèi)參GAPDH灰度值比值為靶蛋白相對表達量。
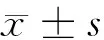
2 結果
2.1 miR-32轉(zhuǎn)染效率鑒定 H.pylori + NC組、H.pylori + inhibitor組細胞轉(zhuǎn)染24 h后即出現(xiàn)大量熒光,且RT-qPCR檢測發(fā)現(xiàn),與BC組比較,H.pylori組HIEC-6細胞miR-32表達水平顯著增加(P<0.05);H.pylori、H.pylori + NC組miR-32表達水平比較,差異無統(tǒng)計學意義(P>0.05);與H.pylori + NC組比較,H.pylori + inhibitor組miR-32表達水平顯著降低(P<0.05),提示轉(zhuǎn)染成功。見圖1,表2。

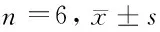
表2 4組HIEC-6細胞miR-32表達水平、細胞活性及凋亡率比較
2.2 下調(diào)miR-32表達對HIEC-6細胞活性的影響 與BC組比較,H.pylori組HIEC-6細胞活性顯著降低(P<0.05);H.pylori、H.pylori+NC組HIEC-6細胞活性比較,差異無統(tǒng)計學意義(P>0.05);與H.pylori+NC組比較,H.pylori+inhibitor組HIEC-6細胞活性顯著增加(P<0.05)。見表2。
2.3 下調(diào)miR-32表達對HIEC-6細胞凋亡的影響 與BC組比較,H.pylori組HIEC-6細胞凋亡率顯著增加(P<0.05);H.pylori、H.pylori+NC組HIEC-6細胞凋亡率比較,差異無統(tǒng)計學意義(P>0.05);與H.pylori+NC組比較,H.pylori+inhibitor組HIEC-6細胞凋亡率顯著降低(P<0.05)。見圖2,表2。

2.4 下調(diào)miR-32表達對HIEC-6細胞上清液炎性因子表達量的影響 與BC組比較,H.pylori組HIEC-6細胞上清液TNF-α、IL-6表達量顯著增加(P<0.05);H.pylori、H.pylori + NC組HIEC-6細胞上清液TNF-α、IL-6表達量比較,差異無統(tǒng)計學意義(P>0.05);與H.pylori + NC組比較,H.pylori + inhibitor組HIEC-6細胞上清液TNF-α、IL-6表達量顯著降低(P<0.05)。見表3。
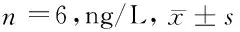
表3 4組HIEC-6細胞上清液TNF-α、IL-6表達量比較
2.5 下調(diào)miR-32對HIEC-6細胞TAK1、p38 mRNA表達水平的影響 與BC組比較,H.pylori組HIEC-6細胞TAK1、p38 mRNA表達水平顯著增加(P<0.05);H.pylori、H.pylori+NC組HIEC-6細胞TAK1、p38 mRNA表達水平比較,差異無統(tǒng)計學意義(P>0.05);與H.pylori + NC組比較,H.pylori+inhibitor組HIEC-6細胞TAK1、p38 mRNA表達水平顯著降低(P<0.05)。見表4。
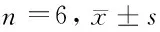
表4 4組HIEC-6細胞TAK1、p38 mRNA表達水平比較
2.6 下調(diào)miR-32對TAK1、p38蛋白表達的影響 與BC組比較,H.pylori組HIEC-6細胞TAK1、p38蛋白表達量顯著增加(P<0.05);H.pylori、H.pylori + NC組HIEC-6細胞TAK1、p38蛋白表達量比較,差異無統(tǒng)計學意義(P>0.05);與H.pylori + NC組比較,H.pylori + inhibitor組HIEC-6細胞TAK1、p38蛋白表達量顯著降低(P<0.05)。見表5。
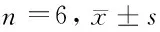
表5 4組HIEC-6細胞TAK1、p38蛋白表達量比較
3 討論
miRNA是通過轉(zhuǎn)錄后調(diào)控參與多種疾病基因表達的內(nèi)源性非編碼小RNA,是細胞功能和體內(nèi)平衡的重要調(diào)節(jié)因子,近來研究發(fā)現(xiàn),多種miRNA異常表達在腸道疾病發(fā)生機制中發(fā)揮重要作用[10-12]。Liang等[13]研究報道,與正常結腸上皮細胞比較,miR-32-5p在結腸癌細胞中顯著上調(diào),抑制其表達可增強結腸癌細胞放射敏感性,抑制其遷移和侵襲。魏凱等[14]研究報道,miR-32在胃癌細胞中亦顯著上調(diào),與胃癌細胞增殖及侵襲有關。H.pylori被世界衛(wèi)生組織國際癌癥研究協(xié)會定義為Ⅰ類致癌因子,H.pylori感染能夠影響相關miRNA表達,通過參與調(diào)控細胞生物學行為、表觀遺傳學修飾等,在胃腸道疾病發(fā)生發(fā)展中起重要作用[15]。有研究報道,H.pylori感染與小兒腸炎有顯著相關性[16],而與炎癥性腸病患者呈負相關[17],但具體機制尚不明確。Feng等[8]研究報道,miR-32-5p可促進H.pylori所致小兒腸炎的腸上皮細胞HIEC-6細胞凋亡,加重其炎癥損傷,可能與靶向SMAD6基因,調(diào)節(jié)TAK1-p38信號通路有關。本研究結果發(fā)現(xiàn),與BC組比較,H.pylori組HIEC-6細胞miR-32表達水平、凋亡率顯著增加,細胞活性顯著降低,而下調(diào)miR-32可減輕H.pylori誘導的細胞凋亡,增加其活性,提示miR-32可能促進H.pylori感染引起的HIEC-6細胞凋亡,而下調(diào)其表達則可逆轉(zhuǎn)H.pylori促HIEC-6細胞凋亡作用,促進其存活。
TAK1是一種絲氨酸/蘇氨酸激酶,可被TNF-α、IL-1β等多種因素激活,是介導MAPK、NF-κB信號通路的關鍵調(diào)節(jié)因子,主要參與下游信號分子的表達介導組織損傷及細胞炎性反應[18]。p38是MAPK家族成員之一,自身發(fā)生磷酸化后被激活。Zaidi等[19]研究報道,H.pylori可通過新的TAK1-p38激活途徑,以不依賴于HB- EGF的方式誘導EGFR的絲氨酸磷酸化,與相關性胃癌發(fā)生有關。Wei等[20]研究報道,抑制TAK1/p38/NF-κB信號通路可減輕oxo-LDL誘導的內(nèi)皮細胞凋亡及炎癥損傷。但目前關于miR-32在小兒腸炎中的研究較少。本研究結果發(fā)現(xiàn),與BC組比較,H.pylori組HIEC-6細胞TNF-α、IL-6表達量、TAK1、p38 mRNA及蛋白表達水平顯著增加,提示H.pylori感染可促進HIEC-6細胞凋亡可能與促進炎性反應,激活TAK1-p38通路有關。與H.pylori + NC組比較,H.pylori + inhibitor組HIEC-6細胞TNF-α、IL-6表達量、TAK1、p38 mRNA及蛋白表達水平顯著降低,提示下調(diào)miR-32可能對H.pylori感染導致的HIEC-6細胞炎性反應及TAK1-p38通路激活有抑制作用。
綜上所述,下調(diào)miR-32可抑制H.pylori感染誘導的HIEC-6細胞凋亡,可能與抑制TAK1-p38通路激活及炎性反應有關。但關于miR-32在調(diào)控TAK1-p38通路中的具體作用靶點及對相關炎癥通路的調(diào)節(jié)作用,有待進一步深入探究。

