MCP-1和CD105在稽留流產患者蛻膜組織中的表達及意義
劉學 欒曉瑾 肖正華
稽留流產(missed abortion,MA)指胚胎或胎兒已死亡,仍然滯留在宮腔內,未能及時從陰道排出[1-2]。MA是妊娠早期的常見并發癥,在我國的發生率約為13.4%,且呈逐年遞增的趨勢[3]。MA發病因素復雜,目前研究認為其發生與染色體異常、生殖道感染、母體系統疾病、內分泌失調和解剖缺陷等有關。然而仍有30%的MA病因尚不明確[4]。近年來,有研究發現單核細胞趨化蛋白-1(monocyte chemoattractant protein-1,MCP-1)作為重要的趨化因子,在胎盤中廣泛表達[5]。并且有研究指出當胚泡植入后MCP-1表達受抑,有助于胎盤的發育和妊娠的維持[6]。在復發性流產和反復著床失敗的發展過程中,MCP-1能夠將單核細胞募集到損傷和感染部位上,發揮促炎效應,從而導致不良結局[7]。胎盤的發育伴隨著滋養細胞的侵襲和子宮螺旋動脈的重塑,這一過程受一系列血管生成因子的調控。CD105作為血管生成的相關標志物之一,參與維持血管內皮細胞的穩定,在胎盤組織中也呈廣泛表達[8]。然而目前尚未有文獻報道MCP-1和CD105在MA中的作用。本研究通過檢測MA和正常宮內早孕要求終止妊娠者蛻膜組織中MCP-1和CD105的表達水平,探討MCP-1和CD105在MA發生、發展中的作用,為進一步研究MA的發病機制提供理論依據。
1 對象和方法
1.1 對象 選取2020年6至12月重慶醫科大學附屬永川醫院收治住院的10例MA患者作為MA組,選取同期收治住院的10例正常宮內早孕要求終止妊娠者作為對照組。MA組納入標準:(1)孕周7~13周;(2)年齡20~35周歲;(3)彩超檢查提示胚胎停止發育;(4)胚胎無染色體異常。對照組納入標準:(1)孕周 7~13 周;(2)年齡20~35周歲;(3)彩超檢查提示宮內妊娠,可見心管搏動。兩組排除標準:(1)伴有全身性或生殖道的感染;(2)既往有不良孕產史;(3)有心血管系統、免疫系統、肝腎功異常的患者;(4)妊娠期間應用保胎藥物。兩組對象年齡、孕周、孕次、產次比較差異均無統計學意義(均P>0.05),見表1。本研究經重慶醫科大學附屬永川醫院醫學倫理委員會審批通過,所有對象均簽署知情同意書。
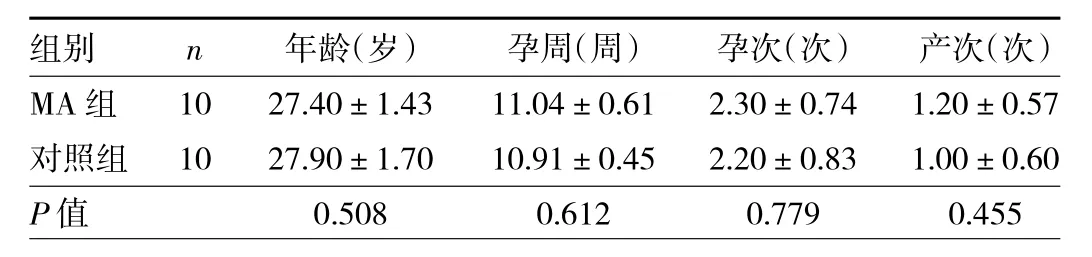
表1 兩組對象一般資料比較
1.2 主要儀器和試劑 FACSCanto Ⅱ流式細胞分析儀、電泳儀、制膠板、電泳槽、成像儀、Stain Buffer(批號:554657)均購自美國 BD公司;BCA試劑盒(批號:B00S001100)、Dulbecco's磷酸鹽緩沖液(DPBS,批號:G4200)、4%多聚甲醛溶液(批號:AR0211)均購自中國鼎國公司;FBS(批號:F8687)和膠原酶Ⅳ(批號:V900893)均購自美國Sigma公司;ficoll分離液(批號:17544652)購自美國 Cytiva公司;CD45-APC-Cy7(批號:B314603)、MCP-1-PE(批號:B193217)、CD105 抗體(批號:10010278)、山羊抗小鼠單克隆抗體(批號:SA00001-1)、DAB 顯色試劑盒(批號:PK10005)均購自美國Proteintech公司。
1.3 標本采集 術后立即收集兩組的蛻膜組織,使用預冷的0.9%氯化鈉溶液洗凈組織的血液,直至漂洗液呈無色,一部分蛻膜組織放入凍存管內,置于-80℃冰箱保存,用于行流式細胞術和Western blot檢測;一部分組織石蠟包埋后常溫保存,用于免疫組化染色。
1.4 蛻膜免疫細胞(decidual immunocyte,DIC)中MCP-1表達水平檢測 采用流式細胞術。兩組每例各取50 g蛻膜組織于EP管中剪碎,加入1 ml濃度為0.01 g/ml的膠原酶Ⅳ消化30 min。然后加入5 ml含有10%FBS和1%雙抗的完全培養基終止消化,用70 μm細胞過濾器過濾,收集沉淀細胞,然后使用5 ml DPBS重懸備用。另外準備一只15 ml離心管,將密度為1.077的5 ml ficoll分離液緩慢加入其中,再將準備好的細胞懸液緩慢覆蓋在ficoll分離液上。使用水平離心機以2 500 r/min離心15 min,在5 ml的位置可見一層云霧狀的液面則是所需DIC,緩慢將其吸出,離心后用Stain Buffer重懸,調整細胞濃度為1×106/ml。吸取100 μl上述細胞懸液放置于流式管中,分別加入CD45-APC-Cy7、MCP-1-PE流式熒光抗體各2.5 μl,然后避光孵育30 min,再用DPBS洗滌兩遍后,用DPBS重懸至500 μl,立即用流式細胞儀檢測。應用Flowjo軟件測定MCP-1陽性細胞的比例,并進行統計學分析。
1.5 蛻膜組織中CD105的定位及表達水平檢測 采用免疫組化法。分別取兩組蛻膜組織石蠟塊切片固定后做好標志,然后進行脫蠟和水化處理,再滴加 50 μl 10%BSA溶液于切片上,室溫孵育60 min進行封閉,然后將50 μl抗-CD105鼠抗稀釋液滴加在切片上 4℃孵育過夜。再用PBS洗滌后,向每個切片中添加100 μl二抗稀釋液(1∶500),并在 4 ℃下再次孵育 50 min,陰性對照組使用PBS代替一抗。最后使用DAB顯色,將所有切片用蘇木精復染,通過分級乙醇脫水并用中性樹膠封固。將制備好的切片置于顯微鏡下觀察,并且隨機選擇3個視野(×10)進行拍攝。使用Image J軟件測量每個視野CD105陽性信號的平均光密度值(average optical density,AOD),并進行統計學分析。
1.6 蛻膜組織中CD105表達水平檢測 采用Western blot法。分別取兩組每例蛻膜組織30 mg,嚴格按照BCA試劑盒測定蛋白濃度,然后置于-80℃冰箱內保存。分別配制10%分離膠和4%上樣膠,待膠凝固后,每孔加入30 μg蛋白,然后在100 V恒壓條件下進行跑膠,跑膠結束后,按照黑膠白膜的順序于轉膜液中組裝夾板,將組裝好的夾板放入轉膜槽中,以恒定電流250 mA轉90 min,轉膜結束后將膜放置在5%脫脂奶粉中封閉1 h,然后加入1∶1 000稀釋的鼠抗CD105單克隆抗體,4℃孵育過夜,再用TBST洗膜3次,接著用對應一抗種屬的二抗稀釋液(1∶1 000)敷育1 h后用TBST洗膜,最后用ECL發光檢測試劑盒進行化學發光檢測。使用Gel-Proanlyzer軟件進行灰度定量分析。
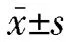
2 結果
2.1 兩組DIC中MCP-1表達水平比較 與對照組比較,MA組患者DIC中MCP-1陽性細胞比例明顯升高,差異有統計學意義[(36.27±3.98)%比(15.17±7.62)%,P<0.05],見圖 1。
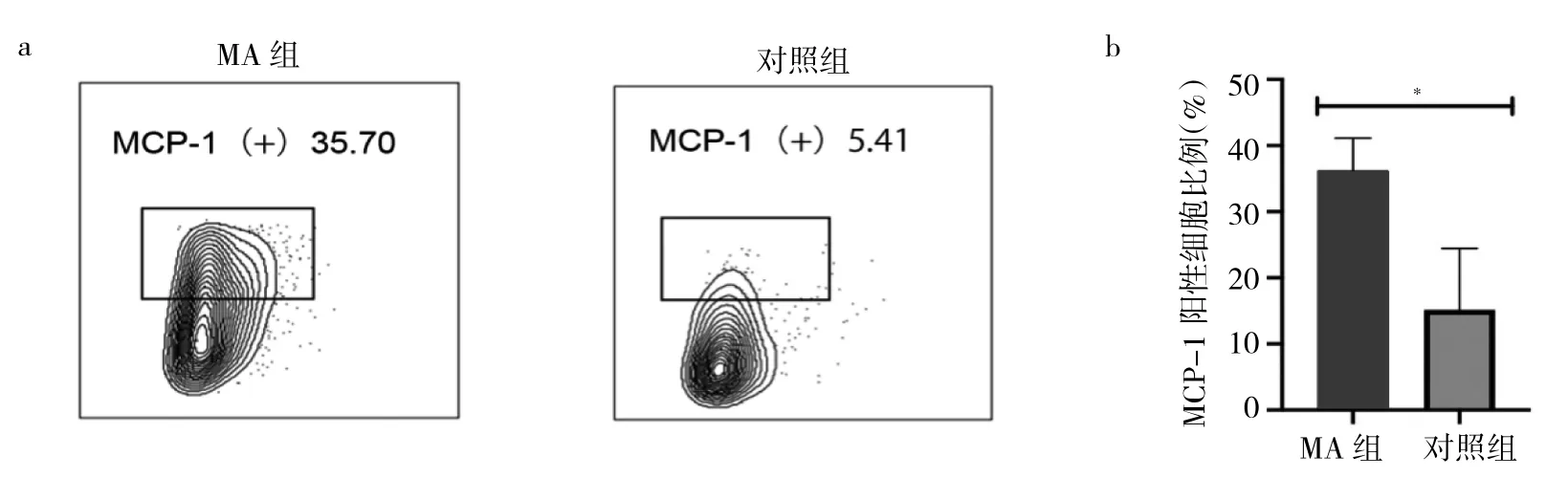
圖1 兩組蛻膜免疫細胞(DIC)中單核細胞趨化蛋白-1(MCP-1)表達水平比較(a:兩組DIC中MCP-1表達的流式細胞圖;b:兩組DIC中MCP-1陽性細胞比例比較的柱狀圖,*P<0.05;MA為稽留流產)
2.2 兩組蛻膜組織中CD105表達水平比較 免疫組化結果顯示,CD105在兩組蛻膜基質細胞的細胞質與細胞核中均有表達,見圖2a-b;與對照組比較,MA組患者蛻膜組織中CD105表達水平升高,差異有統計學意義(5.40±0.49 比 3.03±0.21,P<0.05),見圖 2c。Western blot結果顯示,與對照組比較,MA組蛻膜組織中CD105蛋白表達水平升高,差異有統計學意義(3.38±0.29比2.29±0.42,P<0.05),見圖 3。
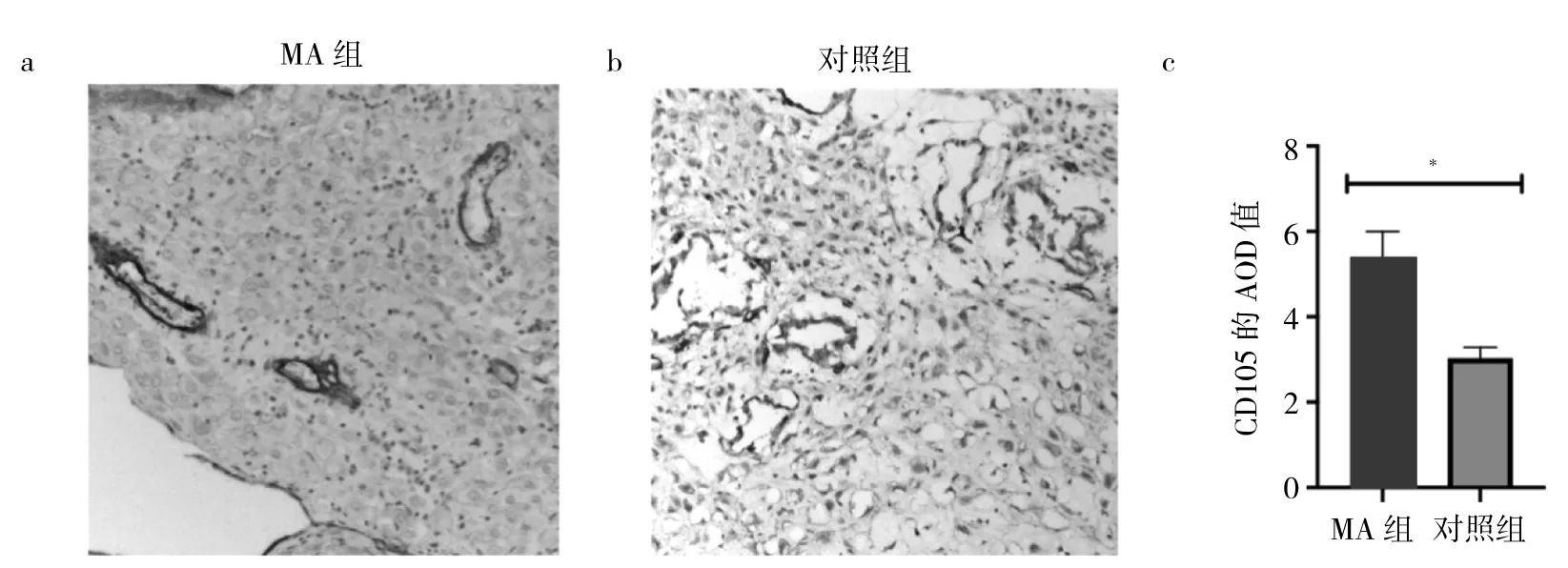
圖2 兩組蛻膜組織中CD105的定位和表達水平[a:稽留流產(MA)組蛻膜組織免疫組化染色所見,×10;b:對照組蛻膜組織免疫組化染色所見,×10;c:兩組蛻膜組織中CD105平均光密度值(AOD)比較的柱狀圖,*P<0.05]
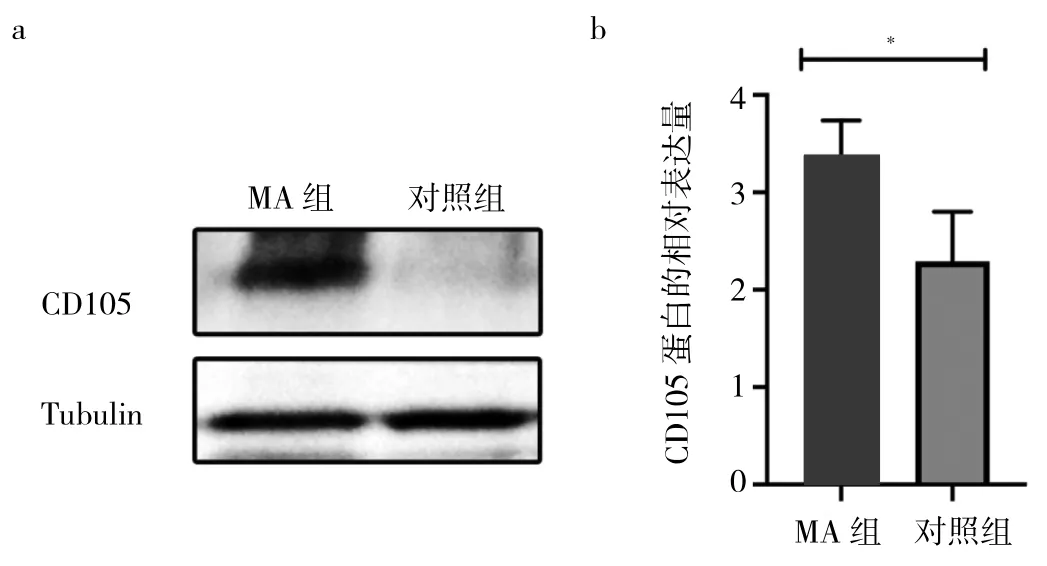
圖3 兩組蛻膜組織中CD105蛋白表達水平比較(a:兩組蛻膜組織中CD105蛋白表達的電泳圖;b:兩組蛻膜組織中CD105灰度值比較的柱狀圖,*P<0.05;MA為稽留流產)
2.3 兩組MCP-1陽性細胞比例與CD105蛋白表達水平的相關性分析 兩組MCP-1陽性細胞比例和CD105蛋白表達水平均呈正相關(r=0.931和0.940,均P<0.01),見圖4。
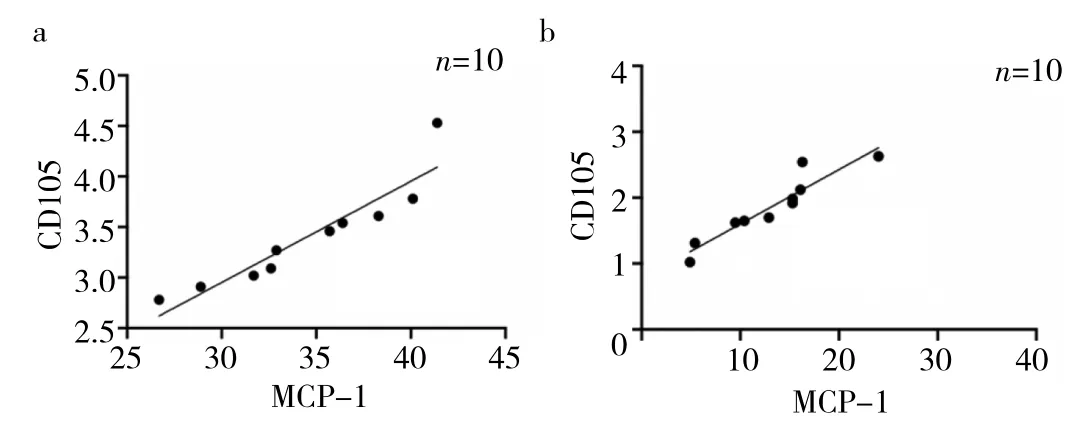
圖4 兩組單核細胞趨化蛋白-1(MCP-1)陽性細胞比例與CD105蛋白表達水平的散點圖[a:稽留流產(MA)組;b:對照組]
3 討論
在胚胎植入過程中,子宮內膜受卵巢激素的調控,促進子宮內膜間質細胞轉變為較大圓形的蛻膜細胞,稱為蛻膜化。同時,具有侵襲性的絨毛外滋養層細胞(extra villous trophoblasts,EVTs),植入和浸潤至蛻膜化的子宮內膜中,促進螺旋動脈的形成和重塑,為生長中的胎盤和胎兒提供營養和氧氣[9]。蛻膜化是成功建立和維持妊娠必不可少的一環,蛻膜基質細胞現已被認為是胎盤的主要免疫調節細胞之一,具有調節滋養細胞侵襲,抵抗炎癥和氧化應激以及抑制母體局部免疫反應的獨特能力[10-11]。一旦蛻膜化障礙則會導致EVTs遷移和侵襲受損,使螺旋小動脈重塑不足,胎盤血流量減少,進而導致胎盤缺氧。同時,蛻膜基質細胞釋放各種胎盤因子,激活系統炎癥反應,最終導致一系列妊娠并發癥,如胎兒生長受限、先兆子癇和流產等[12-13]。本研究中所涉及的MCP-1和CD105是公認的與炎癥免疫和血管形成相關的關鍵分子,本研究通過檢測MA患者蛻膜組織中MCP-1和CD105的表達水平,從而為探究炎癥和血管形成在MA發生、發展中的作用提供理論依據。
母胎界面主要由來自母體的蛻膜和來自胚胎和胎盤的滋養細胞組成,作為半同種異源的胚胎,不被母體免疫系統排斥,依賴于DIC的免疫調控。母胎界面的DIC主要由NK細胞、巨噬細胞、T細胞和多種少數細胞類型(如樹突狀細胞、自然殺傷T細胞等)組成[14]。蛻膜NK(dNK)細胞是最大的細胞群,在妊娠早期占母體免疫細胞的50%~70%,dNK細胞具有維持蛻膜微環境穩態的多種功能[15]。目前已被證實,dNK細胞數量和功能的變化與妊娠并發癥有關,如流產、胎兒宮內生長受限和子癇前期等[16]。而MCP-1是子宮內NK細胞的有效引誘劑和激活劑,MCP-1的升高能激活和招募dNK細胞,使dNK細胞從它的自然保護作用轉變為類似于具有細胞毒性的NK細胞,釋放穿孔素和誘導滋養層細胞凋亡,導致流產[17]。此外,在胚泡植入的過程中,大量MCP-1由蛻膜巨噬細胞誘導釋放,從而進一步將單核細胞激活為巨噬細胞并招募至母胎界面,參與炎癥的發生[18]。蛻膜組織中MCP-1表達的升高可能促進促炎型巨噬細胞募集,進而分泌大量炎性細胞因子(如TNF-α、INF-γ和IL-1等),進一步增強MCP-1的表達,形成一個正反饋回路,最終導致不良妊娠結局[19-20]。本研究發現,MA組蛻膜組織中MCP-1的表達水平明顯高于對照組,提示MCP-1在MA中發揮重要作用。因此筆者推測蛻膜組織中MCP-1水平參與了母胎界面的免疫失衡,MCP-1水平升高,直接導致了dNK細胞活性的改變,使其發揮細胞毒性作用。同時,MCP-1還可能通過誘導蛻膜巨噬細胞數量和功能的改變,發揮促炎的作用,最終導致MA的發生。
EVTs入侵子宮蛻膜后,與dNK和蛻膜巨噬細胞之間相互影響。在EVTs的植入過程中,螺旋小動脈壁的平滑肌細胞和內皮細胞不斷降解,螺旋動脈從窄口徑、高阻力血管轉變為大口徑、低阻力血管,血液以較低的流速向絨毛間隙輸送,促進胎盤和胎兒的生長發育[21]。螺旋動脈發育障礙嚴重影響了胎盤和胎兒的發育,最終導致各種妊娠并發癥。有研究指出,在子癇前期患者的血清中觀察到CD105的表達水平顯著上調,高水平的CD105導致血管內皮功能障礙、血管收縮和免疫失調,從而對母體和胎兒產生不良影響[22]。CD105是轉化生長因子-β的跨膜輔助受體,能夠干擾TGF-β與其受體的結合,抑制內皮一氧化氮合酶對血管的擴張作用,導致血管生成障礙,最終影響胎盤發育[23]。目前已經發現CD105除了抗血管生成的作用外,也可以參與炎癥過程并調節免疫反應。CD105可以促進單核巨噬細胞的黏附和遷移,誘導促炎型的巨噬細胞分化,從而導致不良的妊娠結局[24]。本研究中,與對照組相比,MA組CD105的表達水平呈上調趨勢,差異有統計學意義。因此筆者推測,CD105可能通過抑制血管發育和誘導炎癥免疫反應來促進MA的發生。蛻膜組織中CD105表達水平上調,一方面證實了在MA患者中,存在胎盤血管發育障礙。另一方面,CD105作為炎癥的調控因子之一,同MCP-1一樣,也能導致促炎型巨噬細胞增多,加劇母胎界面的炎癥反應爆發,最終導致MA患者的胚胎死亡。同時相關性分析顯示,在蛻膜組織中,MCP-1和CD105呈正相關,這提示MCP-1和CD105兩者可能存在著相互作用,從而共同調控MA的發生,但這仍需要進一步研究。
綜上所述,本研究顯示MA患者蛻膜組織中MCP-1和CD105高表達。MCP-1表達水平的升高,促使DIC的數量和活性發生改變,從而導致母體界面的免疫失衡。同時CD105的上調,導致子宮螺旋小動脈形成和重塑障礙,使胎盤發育不良,最終導致MA的發生。探討MCP-1、CD105與MA的關系,有利于為研究MA的發病機制提供新的理論依據。

