干預(yù)miR-31對(duì)哮喘小鼠肺組織TGF-β1/Smad3、TLR2/MyD88/NF-κB信號(hào)通路的影響
李玲 李慶玲 劉文春
支氣管哮喘(簡(jiǎn)稱哮喘)是一種由嗜酸性粒細(xì)胞、T淋巴細(xì)胞等參與的異質(zhì)性疾病,其主要特征為氣道組織慢性炎癥反應(yīng),患者主要臨床表現(xiàn)為胸悶、咳嗽、反復(fù)喘息等,對(duì)患者身體健康、生活質(zhì)量造成嚴(yán)重影響[1-3]。流行病學(xué)調(diào)查顯示,兒童、老年人群為哮喘主要發(fā)病群體,近年來我國哮喘發(fā)病率一直居高不下,癥狀嚴(yán)重程度隨時(shí)間變化而不斷改變,多數(shù)患者清晨、夜晚時(shí)間癥狀較為嚴(yán)重[4]。研究發(fā)現(xiàn),若哮喘癥狀不能及時(shí)根治,病情可能會(huì)不斷發(fā)展而造成氣道重塑[5]。因此,對(duì)哮喘進(jìn)行及時(shí)有效的治療具有重要意義。目前尚無一種特效的治療哮喘的藥物。研究發(fā)現(xiàn),miR-31在哮喘癥狀中表達(dá)異常,其表達(dá)變化與炎癥反應(yīng)密切相關(guān),與哮喘病情具有一定的相關(guān)性,miR-31對(duì)哮喘具有一定的診斷價(jià)值[6]。但關(guān)于調(diào)控miR-31表達(dá)對(duì)哮喘干預(yù)效果的研究還鮮有報(bào)道。本研究通過建立小鼠哮喘模型,探討干預(yù)miR-31對(duì)哮喘小鼠肺組織轉(zhuǎn)化生長(zhǎng)因子-β1(transforming growth factor-β1,TGF-β1)/果蠅 MAD 基因 3 哺乳動(dòng)物類似基因(drosophila mad gene 3 mammalian like gene,Smad3)、Toll樣受體 2(toll-like receptor 2,TLR2)/髓樣分化因子(myeloid differentiation factor 88,MyD88)/NF-κB 信號(hào)通路的影響。
1 材料和方法
1.1 實(shí)驗(yàn)動(dòng)物 SD健康雄性小鼠40只,年齡7~10(8.5±1.2)周,體重 19~28(23.5±3.6)g,購自洛陽普萬泰生物技術(shù)有限公司。在相對(duì)濕度50%~55%、溫度(23.1±1.9)℃的環(huán)境中喂養(yǎng)1周,光照12 h/d。本研究經(jīng)醫(yī)院醫(yī)學(xué)倫理委員會(huì)審批通過。
1.2 主要試劑和儀器 大鼠抗小鼠miR-31抗體(美國Invitrogen公司,批號(hào):C1358);兔抗小鼠 CD44抗體(美國BD公司,批號(hào):N3667);小鼠抗兔IFN-γ抗體(丹麥Dako公司,批號(hào):D8569);小鼠抗大鼠 IL-2、IL-4、IL-22、IL-3 抗體(美國 Selleck 公司,批號(hào):S8753、S2357、S1675、S2565);大鼠抗小鼠總抗氧化能力(total antioxidant capacity,TAOC)、一氧化氮(nitric oxide,NO)抗體(美國Hyclone 公司,批號(hào):A25291、A23652);小鼠抗兔 TGF-β1、Smad3抗體(美國Gibco公司,批號(hào):A25291、A23652);兔抗小鼠TLR2、MyD88抗體(丹麥Dako公司,批號(hào):D9231、D8563);小鼠抗大鼠 NF-κB p65抗體(美國 Sigma公司,批號(hào):D9423);卵白蛋白(上海澤葉生物科技有限公司,批號(hào):ZY9000,規(guī)格:1 g);硫酸鋁鉀(北京百奧萊博科技有限公司,規(guī)格:50 g,批號(hào):Y16210);miR-31激動(dòng)劑(agomiR-31)、miR-31拮抗劑(antagomiR-31)(美國Hyclone公司,批號(hào):A32265、A26719);酶標(biāo)分析儀(上海酶聯(lián)生物科技有限公司,型號(hào):ML-dr3518)。
1.3 建模及分組干預(yù) 隨機(jī)選取10只小鼠作為正常組,不做任何處理。其余30只小鼠建立哮喘模型:將0.2 mg卵白蛋白、1 mg硫酸鋁鉀溶于2 ml 0.9%氯化鈉注射液制作致敏液,分別于建模第1、7、14天腹腔注射0.2 ml致敏溶液;建模第15天起將小鼠置于3 L密閉玻璃箱,霧化吸入含有1%卵白蛋白的0.9%氯化鈉溶液噴霧,隔日1次,0.5 h/次,持續(xù)干預(yù)1周。建模成功標(biāo)準(zhǔn):打噴嚏、抓耳撓鼻,喘息,毛發(fā)無光,活動(dòng)量減少。建模成功后,將30只小鼠分為哮喘組、上調(diào)組和下調(diào)組,每組各10只。上調(diào)組小鼠尾部靜脈注射30 mg/kg agomiR-31干預(yù),下調(diào)組小鼠尾部靜脈注射30 mg/kg antagomiR-31干預(yù),正常組、哮喘組小鼠尾部靜脈注射等量0.9%氯化鈉注射液(3 ml)干預(yù),尾部靜脈注射方法參照余濤等[7]研究中操作方法。
1.4 標(biāo)本采集 干預(yù)結(jié)束后,取各組小鼠腹腔靜脈血3 ml,采血過程參照伍磊等[8]研究中操作方法,2 000 r/min離心15 min后分離上清液,-40℃保存待檢。各組小鼠麻醉后頸椎脫臼法處死,取小鼠肺組織保存待檢。
1.5 各組小鼠肺組織病理學(xué)檢查 采用HE染色。將小鼠肺組織完全浸泡在4%甲醛中,1 d后行常規(guī)石蠟包埋、4 μm連續(xù)切片。將切片烤干后進(jìn)行脫蠟處理,之后順序置入70%、75%、80%、90%、95%濃度的乙醇溶液中各復(fù)水3 min。使用蘇木精染色15 min后清洗3次,使用鹽酸乙醇分化處理30 s,充分清洗之后使用1%伊紅染色,使用95%乙醇進(jìn)行脫水處理后進(jìn)行脫蠟處理,封片后使用顯微鏡觀察各組小鼠肺組織病理學(xué)改變情況。
1.6 各組小鼠肺組織miR-31、CD44 mRNA表達(dá)水平檢測(cè) 采用RT-PCR法。將TRIzol試劑添加至各組肺組織標(biāo)本中靜置溶解,添加三氯甲烷600 μl攪拌,呈乳白色后離心處理提取總RNA,檢測(cè)完整性之后合成cDNA,逆轉(zhuǎn)錄處理,使用熒光定量PCR試劑盒進(jìn)行PCR擴(kuò)增,2-ΔΔCt方法計(jì)算 miR-31、CD44 mRNA 表達(dá)量,內(nèi)參為U6。U6 上游引物:5'-CTCGCTTCGGCAGCACA-3',下游引物:5'-AACGCTTCACGAATTTGCGT-3'。miR-31上游引物:5'-AGGCAAGAUGCUGGCAUAGUC-3',下游引物:5'-ACGUGACACGUUCGGAGAAT-3'。CD44 上游引物:5'-ACCAAGAAGACATCGATGCC-3',下游引物:5'-TGTCCAGCTAATTCGGATCC-3'。
1.7 各組小鼠血清Th1/Th2趨化因子、炎癥反應(yīng)指標(biāo)水平檢測(cè) 將血清標(biāo)本、稀釋液以及檢測(cè)卡平衡至24℃,對(duì)檢測(cè)卡進(jìn)行編號(hào)后置于平臺(tái)之上,配制標(biāo)準(zhǔn)液并按照1∶10比例對(duì)待測(cè)標(biāo)本進(jìn)行稀釋,將血清標(biāo)本、稀釋后標(biāo)準(zhǔn)液置于酶標(biāo)板中,使用酶標(biāo)分析儀檢測(cè)Th1/Th2趨化因子(IFN-γ、IL-2、IL-4)及炎癥反應(yīng)指標(biāo)(IL-22、IL-3)水平。
1.8 各組小鼠血清氧化應(yīng)激指標(biāo)水平檢測(cè) 采用免疫透射比濁法。取3個(gè)清潔試管,并分別記作空白管、標(biāo)準(zhǔn)管、測(cè)定管,每管中添加350 μl緩沖液。此外,空白管添加蒸餾水 20 μl,標(biāo)準(zhǔn)管添加 TAOC、NO 標(biāo)準(zhǔn)液 20 μl,測(cè)定管添加血清標(biāo)本20 μl,震蕩均勻,27℃靜置10 min,使用分光光度計(jì)比色,500 nm波長(zhǎng)處以空白管調(diào)零,記錄吸光度值,計(jì)算TAOC、NO水平。
1.9 各組小鼠肺組織 TGF-β1/Smad3、TLR2/MyD88/NF-κB信號(hào)通路蛋白表達(dá)水平檢測(cè) 采用Western blot法。提取各組小鼠肺組織總蛋白,取蛋白質(zhì)樣本20 μg,SDS-PAGE凝膠電泳后轉(zhuǎn)PVDF膜,室溫封閉1.5 h,1:1 000加入待測(cè)蛋白抗體,1:2 000添加內(nèi)參抗體,過夜孵育,次日取出,TBST液清洗后1:5 000添加稀釋后二抗孵育,1 h后使用TBST液洗滌5次,顯色、曝光、成像后檢測(cè)條帶灰度值。

2 結(jié)果
2.1 各組小鼠肺組織病理學(xué)改變情況比較 正常組小鼠氣道上皮完整,細(xì)胞排列整齊且緊密,結(jié)構(gòu)較為清晰,大小均一,無炎性細(xì)胞浸潤(rùn)情況;哮喘組、上調(diào)組小鼠出現(xiàn)嚴(yán)重氣道壁增厚情況,細(xì)胞排列雜亂且疏松,炎性細(xì)胞浸潤(rùn)情況較為嚴(yán)重;下調(diào)組小鼠氣道壁增厚情況明顯減輕,細(xì)胞排列較為整齊,結(jié)構(gòu)較為清晰,炎性細(xì)胞浸潤(rùn)狀況明顯減輕,見圖1(插頁)。
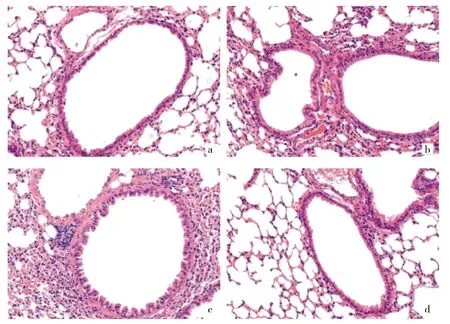
圖1 各組小鼠肺組織病理學(xué)檢查所見(a:正常組;b:哮喘組;c:上調(diào)組;d:下調(diào)組;HE染色,×400)
2.2 各組小鼠miR-31、CD44 mRNA表達(dá)水平比較 與正常組比較,其他3組小鼠miR-31、CD44 mRNA表達(dá)水平均升高,差異均有統(tǒng)計(jì)學(xué)意義(均P<0.05);與哮喘組、上調(diào)組比較,下調(diào)組小鼠miR-31、CD44 mRNA表達(dá)水平均降低,差異均有統(tǒng)計(jì)學(xué)意義(均P<0.05),見表1。
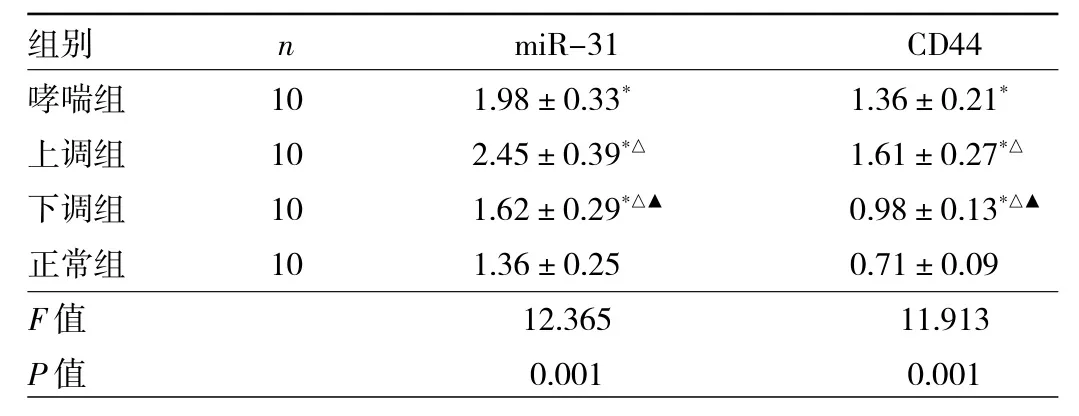
表1 各組小鼠miR-31、CD44 mRNA表達(dá)水平比較
2.3 各組小鼠Th1/Th2趨化因子水平比較 與正常組比較,其他3組小鼠IFN-γ水平均降低,IL-2、IL-4水平均升高,差異均有統(tǒng)計(jì)學(xué)意義(均P<0.05);與哮喘組、上調(diào)組比較,下調(diào)組小鼠IFN-γ水平升高,IL-2、IL-4水平均降低,差異均有統(tǒng)計(jì)學(xué)意義(均P<0.05),見表2。

表2 各組小鼠Th1/Th2趨化因子水平比較(ng/L)
2.4 各組小鼠氧化應(yīng)激、炎癥反應(yīng)嚴(yán)重程度比較 與正常組比較,其他3組小鼠TAOC、NO、IL-22、IL-3水平均升高,差異均有統(tǒng)計(jì)學(xué)意義(均P<0.05);與哮喘組、上調(diào)組比較,下調(diào)組小鼠TAOC、NO、IL-22、IL-3水平均降低,差異均有統(tǒng)計(jì)學(xué)意義(均P<0.05),見表3。

表3 各組小鼠氧化應(yīng)激、炎癥反應(yīng)嚴(yán)重程度比較
2.5 各組小鼠TGF-β1/Smad3信號(hào)通路蛋白水平比較 與正常組比較,其他3組小鼠TGF-β1、Smad3水平均升高,差異均有統(tǒng)計(jì)學(xué)意義(均P<0.05);與哮喘組、上調(diào)組比較,下調(diào)組小鼠TGF-β1、Smad3水平均降低,差異均有統(tǒng)計(jì)學(xué)意義(均P<0.05),見表4。
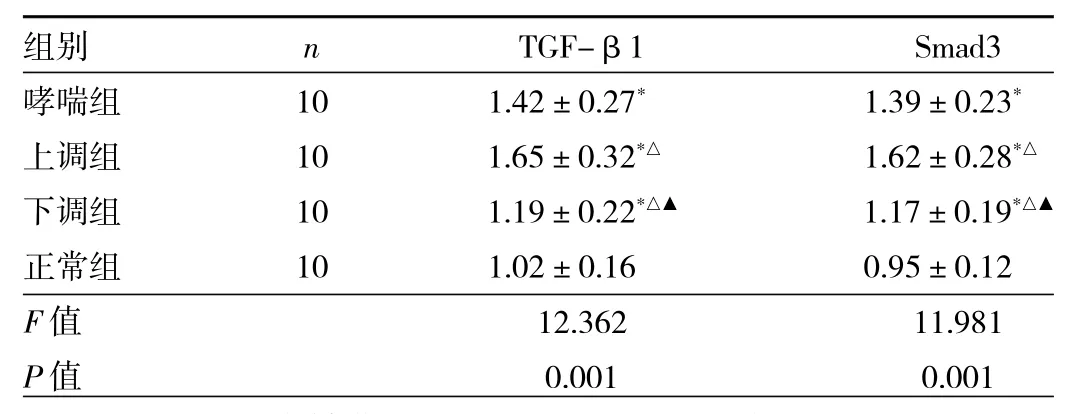
表4 各組小鼠TGF-β1/Smad3信號(hào)通路蛋白水平比較
2.6 各組小鼠TLR2/MyD88/NF-κB信號(hào)通路蛋白水平比較 與正常組比較,其他3組小鼠TLR2、MyD88、NF-κB p65水平均升高,差異均有統(tǒng)計(jì)學(xué)意義(均P<0.05);與哮喘組、上調(diào)組比較,下調(diào)組小鼠TLR2、MyD88、NF-κB p65水平均降低,差異均有統(tǒng)計(jì)學(xué)意義(均P<0.05),見表5。
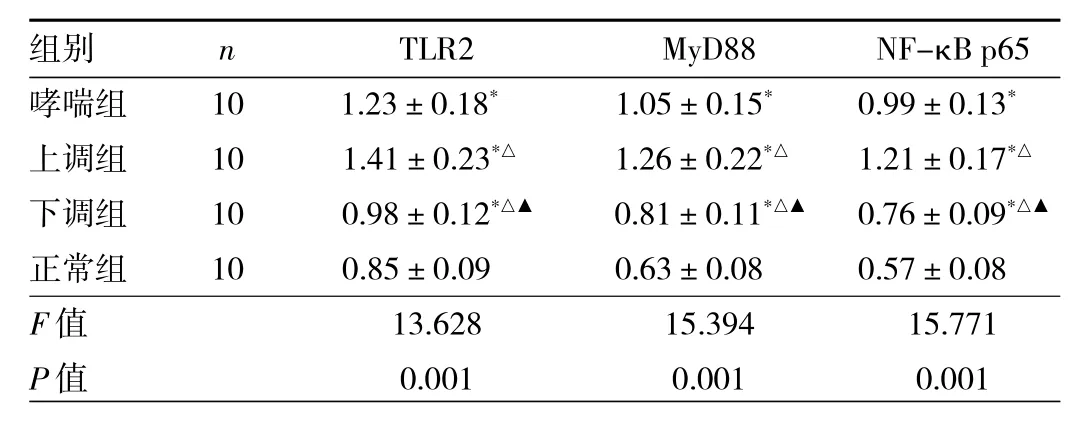
表5 各組小鼠TLR2/MyD88/NF-κB信號(hào)通路蛋白水平比較
3 討論
哮喘是一種臨床常見的、易反復(fù)發(fā)作的呼吸系統(tǒng)疾病[9],主要臨床表現(xiàn)為胸悶、咳嗽、喘息等。目前哮喘的發(fā)病機(jī)制尚未明確,過敏、呼吸道感染、運(yùn)動(dòng)、外界刺激等均為常見的導(dǎo)致哮喘發(fā)病的危險(xiǎn)因素[10-11]。臨床常用的治療哮喘的手段為糖皮質(zhì)激素藥物治療,但研究發(fā)現(xiàn)長(zhǎng)時(shí)間使用糖皮質(zhì)激素治療會(huì)出現(xiàn)臨床療效下降、不良反應(yīng)增加、病情復(fù)發(fā)等情況,因此尋找一種安全有效的治療手段成為目前哮喘研究的主要方向[12-13]。
miRNA廣泛存在于多數(shù)生物體之中,miRNA水平變化與微生物感染、炎癥反應(yīng)及機(jī)體免疫狀態(tài)等病理學(xué)改變均有一定的關(guān)系,越來越多的專家學(xué)者致力于miRNA在哮喘發(fā)生、發(fā)展過程中的作用研究[14-15]。有研究表示,miRNA在機(jī)體氣道炎癥反應(yīng)中具有重要作用,miR-31為miRNA家族的重要組成成員,其水平變化對(duì)T細(xì)胞活化、機(jī)體炎癥反應(yīng)具有一定的調(diào)控作用[16]。CD44為廣譜的細(xì)胞黏附因子,對(duì)炎癥細(xì)胞增殖、聚集具有一定的促進(jìn)作用。有研究表示,CD44水平變化與機(jī)體炎癥反應(yīng)、免疫反應(yīng)具有密切聯(lián)系,參與哮喘的發(fā)生、發(fā)展[17-18]。本研究發(fā)現(xiàn),哮喘模型小鼠miR-31、CD44 mRNA水平較高,下調(diào)miR-31的哮喘小鼠CD44 mRNA水平下降,說明下調(diào)miR-31能夠調(diào)控CD44 mRNA表達(dá)水平,從而對(duì)哮喘模型小鼠起到一定的治療作用。
目前哮喘的發(fā)病機(jī)制尚未明確,有研究表示,Th1/Th2趨化因子水平變化與哮喘患者免疫應(yīng)答具有密切聯(lián)系[19-20]。IFN-γ、IL-2、IL-4 為廣譜的 Th1/Th2 趨化因子,本研究發(fā)現(xiàn),哮喘模型小鼠IFN-γ水平較低,IL-2、IL-4水平均較高,下調(diào)miR-31的哮喘小鼠IFN-γ水平上升,IL-2、IL-4水平均下降,出現(xiàn)這一研究結(jié)果的原因可能是下調(diào)miR-31能夠調(diào)節(jié)哮喘小鼠Th1/Th2平衡,從而改善免疫功能,減輕哮喘小鼠炎癥反應(yīng)。
大量實(shí)驗(yàn)研究表明,哮喘癥狀的發(fā)生、發(fā)展與機(jī)體氣道氧化應(yīng)激、炎癥反應(yīng)具有密切聯(lián)系[21-22]。TAOC、NO是常用的評(píng)價(jià)機(jī)體氧化應(yīng)激反應(yīng)的指標(biāo);IL-22、IL-3是常用的評(píng)價(jià)機(jī)體炎癥反應(yīng)的指標(biāo),兩者水平變化與機(jī)體炎癥反應(yīng)密切相關(guān)。本研究發(fā)現(xiàn),哮喘模型小鼠TAOC、NO、IL-22、IL-3水平均上升,說明哮喘的發(fā)生、發(fā)展伴隨著氧化應(yīng)激反應(yīng)、炎癥反應(yīng)。本研究還發(fā)現(xiàn),下調(diào)miR-31 的哮喘小鼠 TAOC、NO、IL-22、IL-3 水平均下降,說明下調(diào)miR-31能夠減輕哮喘模型小鼠氣道氧化應(yīng)激反應(yīng)、炎癥反應(yīng)的嚴(yán)重程度。
氣道重塑為哮喘發(fā)生、發(fā)展過程中的標(biāo)志性病理變化,在哮喘發(fā)生、發(fā)展過程中具有重要作用。TGF-β1/Smad3信號(hào)通路對(duì)哮喘氣道重塑具有一定的調(diào)控作用,對(duì)哮喘患者病情發(fā)展、肺功能變化具有重要意義。本研究發(fā)現(xiàn),哮喘模型小鼠TGF-β1、Smad3水平均較高,下調(diào)miR-31的哮喘小鼠TGF-β1、Smad3水平均下降,出現(xiàn)這一研究結(jié)果的原因可能是哮喘小鼠伴有氣道重塑,下調(diào)miR-31能夠?qū)GF-β1/Smad3信號(hào)通路蛋白水平造成一定影響,從而起到改善哮喘模型小鼠氣道重塑的作用。
本研究發(fā)現(xiàn)哮喘癥狀的發(fā)生、發(fā)展伴隨著炎癥反應(yīng),因此本研究對(duì)調(diào)控miR-31水平改善炎癥反應(yīng)的作用機(jī)制進(jìn)行研究。TLR2/MyD88/NF-κB信號(hào)通路蛋白水平與機(jī)體炎癥反應(yīng)具有密切聯(lián)系,參與氣道炎癥反應(yīng)的發(fā)生、發(fā)展。本研究發(fā)現(xiàn),哮喘模型小鼠TLR2、MyD88、NF-κB p65水平均較高,下調(diào)miR-31的哮喘小鼠TLR2、MyD88、NF-κB p65 水平均下調(diào),出現(xiàn)這一研究結(jié)果的原因可能是下調(diào)miR-31能夠靶向TLR2/MyD88/NF-κB信號(hào)通路蛋白水平,從而起到抑制哮喘小鼠氣道炎癥反應(yīng)的作用。
綜上所述,下調(diào)哮喘小鼠miR-31,能夠調(diào)控CD44 mRNA水平,調(diào)節(jié)Th1/Th2平衡,減輕哮喘小鼠氧化應(yīng)激反應(yīng)、炎癥反應(yīng)的嚴(yán)重程度,其作用機(jī)制可能與調(diào)控TGF-β1/Smad3、TLR2/MyD88/NF-κB信號(hào)通路蛋白水平有關(guān)。
- 浙江醫(yī)學(xué)的其它文章
- 酸棗仁皂苷A促進(jìn)大鼠股骨骨折愈合的機(jī)制研究
- 線粒體分裂抑制劑1對(duì)膠原誘導(dǎo)性關(guān)節(jié)炎小鼠疾病進(jìn)展的抑制作用和機(jī)制
- 外周血Cryab聯(lián)合MRI檢測(cè)對(duì)視神經(jīng)脊髓炎的診斷價(jià)值
- 新生兒化膿性腦膜炎神經(jīng)系統(tǒng)并發(fā)癥與血清 NSE、S-100B、NT-proCNP水平的關(guān)系研究
- 重癥肺結(jié)核合并真菌感染患者的臨床特征及發(fā)病危險(xiǎn)因素分析
- 早產(chǎn)兒早期血清白蛋白水平與敗血癥發(fā)生關(guān)系分析

