玻璃體切割聯合內界膜填塞及鼠神經生長因子注射治療大直徑特發性黃斑裂孔
李巧林,周云帆,徐向忠,蔣 沁,李柯然
?KEYWORDS:large idiopathic macular hole; pars plana vitrectomy; internal limiting membrane insertion; nerve growth factor; ellipsoid zone
0引言
全層黃斑裂孔(macular hole, MH)是指黃斑部視網膜神經上皮層的全層組織中斷,是嚴重影響視力的黃斑病變之一[1],普通人群中MH的發病率為0.1%~0.3%,而其中大多數是特發性黃斑裂孔(idiopathic macular hole, IMH)[2-3]。研究認為玻璃體的不完全后脫離對黃斑視網膜的縱向牽拉及內界膜的切線方向收縮是IMH形成和發生發展的重要因素。目前經睫狀體扁平部玻璃體切割術(pars plana vitrectomy, PPV)聯合內界膜(internal limiting membrane, ILM)剝除術被認為是治療MH的標準化方案且術后裂孔的解剖閉合率可達85%~90%[4-5]。然而對于某些大直徑IMH,常規ILM剝除術后效果并不理想,視功能恢復欠佳。研究顯示,44%的大直徑IMH在首次手術后無法閉合,19%~39%的大直徑IMH在常規ILM剝除術后會出現裂孔再次開放[6]。而對于底徑>1 000μm的IMH,其裂孔閉合率則更不盡如人意。為了進一步提高大直徑IMH的閉合率,國內外學者不斷嘗試對術式進行改良,呈現出各類如改良的IMH剝除技術[7]、干細胞及游離皮瓣移植技術[8]、眼內組織(自體ILM或晶狀體囊膜)和生物組織的填塞或覆蓋術以及輔助使用自體全血覆蓋、低分子黏彈劑等進行瓣膜固定等方法[9-11]。既往的多項研究表明[12-14],Müller細胞作為視網膜主要的神經膠質細胞,對視網膜神經元起到支持、營養、維持細胞穩態等作用。而在IMH發生發展各階段的ILM表面均存在Müller細胞的增殖和去分化,Müller細胞可呈現出神經干細胞特性,替代部分損傷的視網膜神經元。這一病理過程中,激活的Müller細胞可同時合成和分泌少量的經典神經生長因子(neurotrophic factor, NGF),參與調節神經細胞的生長、發育、分化、生存和損傷后再修復等過程,且NGF目前已被國家醫藥產品管理局(NMPA)批準用于臨床治療。基于以上研究和理論,我們課題組嘗試對收治的大直徑IMH患者進行PPV聯合ILM填塞及鼠NGF注射治療,取得較好的臨床效果,現將課題組結果報告如下。
1對象和方法
1.1對象回顧性病例研究。選取2018-05/2020-05在南京醫科大學附屬眼科醫院經檢查確診的大直徑IMH患者16例16眼納入本研究。病程為20d~3mo(平均1.8mo)。納入標準:(1)頻域光學相干斷層掃描(spectral domain-optical coherence tomography, SD-OCT)確診為IMH;(2)MH的最小直徑>500μm,底徑>1 000μm,但屈光度<-6.00D或眼軸長度<26.5mm。排除標準:(1)MH合并視網膜脫離者;(2)既往有眼外傷、眼部手術史或眼內藥物注射治療史者;(3)繼發性MH,如繼發于眼部外傷、高度近視、眼底手術或眼底疾病等;(4)合并年齡相關性黃斑變性、中心性漿液性視網膜病變、動靜脈阻塞等眼底血管性疾病、高度近視、青光眼、葡萄膜炎等其他除晶狀體混濁及MH外影響視力的眼部疾病或影響眼部功能的全身疾患者;(5)有嚴重全身基礎疾病如嚴重心、肺、肝、腎功能不全等不能耐受PPV或不能堅持術后俯臥位的患者;(6)不愿簽署知情同意書的患者。本研究經過南京醫科大學附屬眼科醫院倫理委員會批準并取得患者書面知情同意(倫理號:20211107)。
1.2方法
1.2.1術前檢查所有患者術前均詳細詢問病史,行最佳矯正視力(best corrected visual acuity, BCVA)、裂隙燈顯微鏡、屈光度、散瞳后采用前置鏡行眼底檢查、A/B型超聲、眼底彩色照相和廣角眼底照相、SD-OCT等檢查。BCVA檢查采用標準對數視力表進行,記錄結果時換算為LogMAR視力。SD-OCT對黃斑部行線性水平掃描:掃描深度2.0mm,橫向分辨率11.40μm,軸向分辨率3.87μm,掃描模式512×496,范圍5.8mm×5.8mm,深度2.3mm,手動操作測量MH最小直徑和基底直徑(測量均由同一檢查者完成。每次掃描采用隨訪跟蹤模式)并記錄測量結果。
1.2.2手術方法所有患者均行經睫狀體扁平部三通道23G PPV聯合ILM填塞及鼠NGF注射。手術由同一位資深眼底外科醫生進行。所有患者均聯合行白內障超聲乳化及人工晶狀體植入手術。建立常規23G玻璃體切割三通道,切除玻璃體腔中周部玻璃體后行人工玻璃體后脫離,確保徹底清除玻璃體后皮質,吲哚菁綠染色30s顯示內界膜形態,灌注液下剝除黃斑裂孔周圍約2PD大小的ILM,裂孔緣1~1.5個象限的ILM瓣不離斷,可適當修剪瓣膜后小心的將ILM組織(與裂孔大小相近)填塞入裂孔內以平整覆蓋基底部。行液-氣交換,后將1滴(0.06mL)從小鼠頜下腺分離的NGF注射入黃斑中心凹中,注射用NGF來自商品化的藥品保證了無菌性、安全性和有效性[26]。后行C3F8填充,患者術后每天保持仰臥位4~6h,以保證填塞的ILM瓣和鼠NGF的充分接觸和吸收。告知患者術后保持俯臥位至少1wk。
1.2.3術后隨訪術后至少隨訪6mo。進行BCVA、眼壓、裂隙燈顯微鏡、散瞳眼底檢查、眼底照相、廣角眼底照相、及黃斑區OCT等檢查,記錄并分析BCVA(LogMAR),參照文獻[15-16],以手術后OCT測量的MH基底直徑是否為0μm來確立裂孔是否閉合及閉合率、并按照中心凹輪廓對閉合裂孔形態進行分類:分為U形閉合(黃斑中心凹有組織,形態基本正常)、V形閉合(黃斑中心凹組織菲薄,陡峭性閉合)、不規則閉合(中心凹無明顯細胞成分,瘢痕增生)、平坦狀閉合(中心凹神經感覺層仍缺失)。同時檢測外層結構包括EZ和ELM的完整性及連續性。觀察并記錄有無活動性出血、葡萄膜炎、眼內炎、玻璃體積血、網脫、脈絡膜脫離等相關并發癥的發生。術后視力評定標準:提高:較術前視力提高;不變:較術前視力無變化;下降:較術前視力下降。
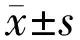
2結果
2.1患者基本信息納入研究的大直徑IMH患者16例16眼基本特征見表1。其中,男4例4眼,女12例12眼。年齡51~76(平均63.25±7.22)歲。術前BCVA(LogMAR)為0.7~1.4(平均1.15±0.21);術前MH最小孔徑為508~963(平均659±115.86)μm;基底徑為1 007~1 505(平均1 222.25±170.65)μm。

表1 大直徑IMH患者手術前后基本特征
2.2術后裂孔閉合率及BCVA 術后6mo隨訪,16例16眼大直徑IMH完全閉合,閉合率100%。隨訪期內均未見裂孔復發。術前患者BCVA(LogMAR)平均值為1.15±0.21,術后3、6mo的BCVA(LogMAR)分別為1.02±0.19,0.87±0.24,差異有統計學意義(F=34.966,P<0.01);術后3、6mo患者的BCVA(LogMAR)較術前均有改善(P<0.01),且術后6mo BCVA(LogMAR)較術后3mo有改善(P<0.01)。術后6mo,BCVA提高13眼,視力不變3眼,無視力下降眼。
2.3裂孔閉合形態和微結構及不同閉合形態下BCVA的改變術后6mo隨訪,OCT所示的大直徑IMH術后閉合形態及微結構(圖1),其中11眼(69%)呈U型閉合;3眼(19%)呈V型閉合;2眼(13%)呈不規則閉合,無平坦狀閉合眼。術后6mo的U型閉合組眼、V型閉合組眼、不規則閉合組眼的BCVA(LogMAR)分別為0.75±0.18、1.05±0.25、1.20±0.00,差異有統計學意義(F=6.937,P<0.01);經LSD-t檢驗兩兩比較分析,U型閉合組眼BCVA恢復明顯優于V型閉合組眼和不規則閉合組眼,差異有統計學意義(P=0.027、0.007),V型閉合組BCVA與不規則閉合組比較,差異無統計學意義(P=0.384)。

圖1 大直徑IMH患眼手術后黃斑孔閉合形態OCT像 A:U形閉合;B:V形閉合;C:不規則形閉合。
術后1mo 16眼ELM及EZ結構恢復連續性分別為8眼(50%)、3眼(19%);術后3mo ELM及EZ結構恢復連續性分別為10眼(63%)、6眼(38%);術后6mo ELM及EZ結構恢復連續性分別為12眼(75%)、8眼(50%)。術后6mo,16眼中12眼ELM恢復連續性,4眼ELM結構未恢復連續性,ELM結構恢復連續性與未恢復連續性者的BCVA(LogMAR)分別為0.75±0.16、1.2±0.08。ELM結構恢復連續性者其BCVA恢復更好,差異有統計學意義(t=-5.29,P<0.01)。
術后6mo,U形閉合組中分別有10眼(91%)ELM恢復連續性、7眼(64%)EZ恢復連續性,V型閉合組中有分別有2眼(67%)ELM恢復連續性、1眼(33%)EZ恢復連續性,不規則閉合眼中未見ELM、EZ連續性恢復。比較U型閉合組,V型閉合組,不規則閉合組中ELM和EZ的連續性構成比,三組間ELM連續性差異有統計學意義(P=0.027,表2)。三組間EZ連續性差異無統計學意義(P=0.354,表3)。

表2 術后三組閉合形態的ELM連續性構成比比較眼(%)

表3 術后三組閉合形態的EZ連續性構成比比較眼(%)
2.4手術并發癥術中黃斑裂孔內填塞的瓣膜無移位且未見明顯影響手術操作的并發癥。術后未見活動性出血、一過性眼壓增高、葡萄膜炎、視網膜醫源性裂孔、視網膜脫離及脈絡膜脫離、眼內炎、玻璃體積血等并發癥的發生。
3討論
近年來,大直徑IMH也被認為是一種難治性MH,而常規ILM剝除術后裂孔閉合率較低,即使Ⅰ期閉合后,裂孔形態往往呈V形或W形,或扁平開口狀即出現視網膜色素上皮層裸露、光感受器細胞的丟失、黃斑中心凹組織缺損,從而導致視力預后不佳[16]。因此各種基于內界膜不同處理的創新手術方式不斷衍生,包括ILM瓣翻轉覆蓋術、移植術等。但上述方法在手術過程中會面臨由于氣液交換過程中壓力的不穩定而使倒置或移植的ILM瓣游離,增加了手術操作的難度甚至可能造成手術的失敗[17]。目前有專家認為,對于裂孔直徑超過800~1 000μm的大直徑IMH,無法僅通過松解周圍視網膜的張力來使缺損的黃斑區組織愈合,可以聯合使用各類組織填塞技術,填塞手術旨在為大直徑裂孔神經上皮層的愈合提供纖維支架,提高裂孔的解剖愈合率[18]。由此可見,對于大直徑IMH,其治療方式的改進、術后效果及預后仍然是目前研究的熱點和重難點。
IMH形成的病理過程中,激活的Müller細胞可同時合成和分泌大量NGF。作為一種經典的神經保護因子,NGF參與調節神經細胞的生長、發育、分化、生存和損傷后再修復等過程,對于交感神經元和感覺神經元的存活和維持至關重要[19]。研究顯示NGF可以激活酪氨酸激酶A(tyrosine kinase A,TrkA)、磷脂酰肌3激酶(phosphatidylinositol 3 kinase,PI3K/Akt)和細胞外信號調節激酶1/2(extracellular signal regulated kinase 2, ERK1/2)等通路促進Müller細胞增殖和細胞周期進展,同時減少視網膜損傷后的感光細胞和視網膜神經元的凋亡[20-22];Zhang等[23]對兔Müller細胞和ILM進行共培養后發現,Müller細胞和ILM共培養組中Müller細胞的增殖速率明顯高于單純Müller細胞組,說明ILM可作為Müller細胞增殖的骨架。而添加外源性NGF后,Müller細胞和ILM共培養組中Müller細胞的增殖速率則明顯增高。由此可見,鼠NGF是Müller細胞增殖及遷移中的關鍵調控因子,它與ILM的協同作用對于促進Müller細胞的增殖和遷移具有至關重要的作用。
因此,鑒于NGF在Müller細胞增殖及遷移中不可忽視的重要作用,我們采用了PPV聯合ILM填塞及鼠NGF注射觀察該方法對于大直徑IMH的臨床療效。劉丹寧[24]的研究證實,目前已被NMPA批準用于臨床治療的鼠NGF在對35例視網膜色素變性患者進行反復玻璃體內注射(30μg/0.15mL,玻璃體腔內終濃度約為6μg/0.15mL)后,可以顯著保護視網膜色素上皮且無明顯的毒性反應和副作用,安全有效。同時在實驗性視網膜變性和光損傷動物模型中進行了安全性評估[25-28]。因此我們采用了相同的NGF濃度,且在隨訪過程中并未發現毒性作用或異常組織反應。
在我們的研究結果中,術后大直徑IMH的閉合率達到100%,患者術后3、6mo的BCVA明顯優于術前。其中U形閉合比例最高,且U型閉合組眼的BCVA恢復明顯優于V型閉合組眼和不規則閉合組眼。手術后6mo,U形閉合組中分別有10眼(91%)、7眼(64%)的ELM、EZ恢復連續性,其中ELM連續性恢復明顯高于其他兩組,且視力較ELM結構不完整者恢復更佳。說明ELM的完整性是術后BCVA的恢復的關鍵,對黃斑區感光細胞的重塑和視功能的提高至關重要,該結論也與既往研究結果一致[29]。同時Mitamura等[30]研究發現術后早期ELM的連續性和完整性是后期EZ重塑的關鍵。本研究也證實了這一結論,術后早期1mo ELM結構恢復連續性的患眼數目明顯多于EZ恢復連續性的患眼,而EZ在其后的隨訪中也逐漸恢復其連續性。但術后6mo U型閉合組中EZ的連續性與其他兩組相比差異無統計學意義的原因可能與隨訪時間尚短有關。2眼不規則型閉合眼黃斑區的強反射團塊甚至瘢痕修復考慮主要與手術中填塞的內界膜組織堆積、膠質細胞的過度增生有關,這也是術后只能達到解剖愈合, ELM及EZ結構的完整性受到影響及視功能恢復欠佳的重要原因。因此術中應盡量對填塞的ILM加以修剪,與孔徑大小基本相似,避免組織卷曲和堆積,則更有利于術后黃斑結構和功能的恢復。
綜上所述,PPV聯合ILM填塞及鼠NGF注射治療大直徑IMH是安全有效的,進一步證實了NGF與ILM的協同作用大大促進了大直徑IMH的閉合、黃斑微結構的完整性恢復及視功能的改善。但本研究是回顧性分析,且樣本量尚少,缺乏患者主觀滿意度問卷調查,今后臨床中應增加樣本量、延長隨訪時間并進行多中心隨機對照實驗加以驗證,其遠期療效和視功能的恢復仍需要結合多焦視網膜電圖、微視野等檢查進一步評估。

