人類表皮生長因子受體2表達與胃癌組織學的相關性研究
劉江,帕合熱迪尼·玉素甫,李建剛,馬博,李亮,王俊,王彤,阿合提別克
人類表皮生長因子受體2(human epidermal growth factor receptor 2,HER2)表達狀態是評估進展期胃癌和胃食管結合部癌抗HER2治療指征和效果的一個重要生物標記物。目前,普遍認為HER2陽性進展期胃腺癌在診療方案上與HER2陰性胃癌差別明顯[1,2]。不同組織學類型的胃癌其細胞分泌功能、侵襲特點、蛋白基因表達狀況等不同[3,4],導致不同組織類型胃癌對化療、抗HER2靶向治療等輔助治療的效果良莠不齊[1,5,6],并且抗HER2耐藥的尷尬結局為實施規范的臨床診療增加不確定性。基于此,本研究通過初步分析胃癌胃鏡活檢標本HER2表達情況,及HER2表達與胃癌組織學特點的相關性,了解不同胃癌組織的HER2表達差異,為胃癌精準抗HER2治療予以組織學提示。
1 資料與方法
1.1 一般資料
收集2017年1月至2020年1月在新疆醫科大學第二附屬醫院普外科、腫瘤科收治的胃癌患者87例(男性54例,女性33例)作為胃癌組,另選同期在本院消化內科住院治療的慢性淺表性胃炎患者21例(男性13例,女性8例)作為正常胃黏膜組。基線資料:胃癌組年齡均數(57.07±6.91)歲,既往胃鏡檢查(2.41±1.91)次;臨床分期:Ⅰ期+Ⅱ期47例,Ⅲ期+Ⅳ期40例;浸潤深度T1+T2 58例,T3+T4 29例;分化程度:高分化+中分化53例,低分化+未分化34例;有淋巴結轉移50例,無淋巴結轉移37例;Lauren組織學分型:腸型63例,彌漫型24例。正常胃黏膜組年齡均數(58.67±10.62)歲,既往胃鏡檢查(2.14±1.68)次。兩組患者年齡、基礎疾病情況、既往胃鏡檢查次數等臨床資料比較無顯著差異。本研究經新疆醫科大學第二附屬醫院倫理委員會批準。所有胃癌患者均按美國癌癥聯合會(AJCC)第8版胃癌標準進行TNM分期,組織學分類按2010版WHO胃腫瘤組織學分類。納入標準:本院病理證實為胃癌;內鏡檢查前一周內無影響胃黏膜功能藥物用藥史;語言表達能力正常、能配合各項檢查者。排除標準:胃轉移癌;嚴重心、肺、肝等臟器功能不全者;行輔助治療、免疫治療者;凝血功能障礙者。
1.2 方法
所有納入的患者均常規行內鏡檢查獲取內鏡標本,分析內鏡下不同部位取材的標本的HER2表達情況,每個病例取材數不少于5塊,盡量避開壞死部,記錄每個病例的取材部位。IHC檢測:將獲得的胃組織(手術或內鏡標本)在30 min內完成編號、切片等處理,室溫下于新配置的10%中性緩沖福爾馬林溶液內固定,固定時長在12~24 h,完成后續的制片過程后行IHC染色,詳細操作過程及質量控制按所購DAB染色試劑盒[商品名:免疫組織化學試劑盒(兔、小鼠),上海經科化學科技有限公司,生產批號:WB1210-1]的說明書和HER2檢測指南及共識進行[7,8]。HER2評定方法:IHC0或1+分記為HER2陰性,IHC2+或3+記為HER2陽性。HE染色法:將所獲得胃組織制備成5 μm厚石蠟切片,65℃孵育30 min,二甲苯溶液浸泡5 min,新鮮二甲苯溶液再次浸泡脫蠟5 min,100%乙醇浸泡8 min,90%乙醇浸泡2 min,80%乙醇1 min,70%乙醇2 min,PBS溶液沖洗2 min,擦拭干凈后HE染色試劑盒染色(商品名:Solarbio,北京索萊寶科技有限公司,生產批號:G1120)。首先200 μL蘇木素染色液染色15 min,流動水沖洗10 min,PBS沖洗2 min,分化液分化30 s。然后400 μL伊紅染色液染色30 s,流動水沖洗5 min,完成脫水、透明、封固操作后,由兩名高年資病理科醫生獨立交叉閱片。
1.3 觀察指標
兩組患者HER2陽性率;內鏡下不同活檢部位組織HER2的陽性率;病理特征指標包括胃管狀腺癌和其他類型胃癌HER2陽性率,以及鏡下有、無印戒細胞的胃癌的HER2陽性率。
1.4 統計學方法
采用SPSS 23.0進行統計學分析,計數資料用率(%)表示,分類比較采用χ2檢驗或Fisher確切概率法。以P<0.05為差異有統計學意義。
2 結果
2.1 兩組患者HER2表達比較
胃癌組HER2陽性率為17.2%(15/87),明顯高于正常胃黏膜組0.0%(0/21),差異有統計學意義(P<0.05)。
2.2 胃癌中不同活檢部位HER2表達陽性率比較
淺表彌漫部(環瘤體中心周圍的淺表彌漫病變,圖1A)、潰瘍隆起部(瘤體中隆起的潰瘍病變,圖1B)、潰瘍床(瘤體內的潰瘍病變,圖1C)及腫塊突起部(瘤體突起的病變,圖1D)HER2陽性率分別是100%、90%、44%、100%,見表1。
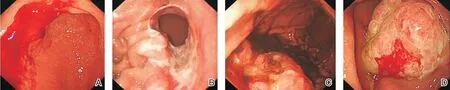
圖1 胃鏡下不同取材部位A:淺表彌漫部;B:潰瘍隆起部;C:潰瘍床;D:腫塊突起部
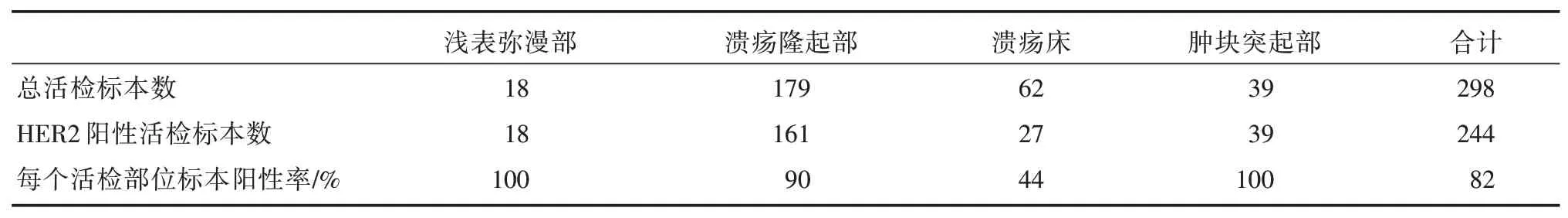
表1 HER2表達與活檢標本部位相關性
2.3 胃癌組中,HER2表達與胃癌組織學相關性分析
鏡下表現為管狀腺癌及不含印戒細胞HER2陽性率明顯高于其他組織學類型胃癌和含印戒細胞,差異有統計學意義(P<0.05)。見表2。
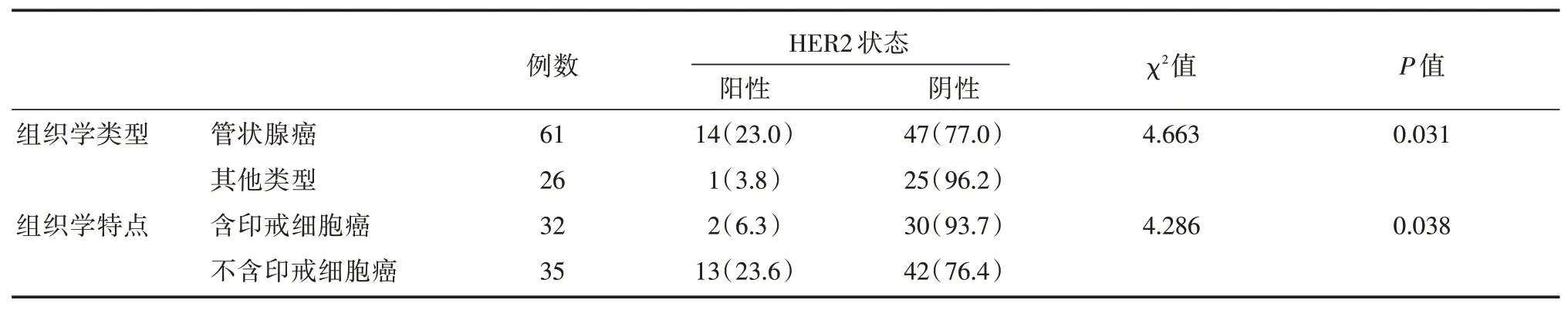
表2 胃癌組HER2表達與胃癌組織類型及特點關系[n(%)]
3 討論
據統計,HER2在腸型、彌漫型和混合型(Lauren分型)胃癌中陽性率為分別為3%~23.5%、0%~6%和0%~20%[9-11]。但具體到不同組織類型中HER2陽性率仍未見一致報道。臨床上,同一胃癌標本中鏡下觀察到兩種以上組織學類型并存的情況常見[12],這使胃癌實施精準抗HER2治療增加不確定性。本研究中胃管狀腺癌中HER2陽性率為23.0%,其他類型胃癌HER2陽性率為3.8%,差異有統計學意義(P=0.031),與之前一些研究報道相近[10,11]。
研究證實內鏡活檢標本在胃癌HER2檢測中能獲得與手術標本相近的結果[13-15]。盡管如此,目前國內在對內鏡活檢標本進行HER2狀態分析仍不及手術標本,部分是由于HER2的異質性表達或受限于內鏡的經驗基礎。本研究中,通過分析胃癌患者內鏡下不同活檢部位的HER2陽性率,結果提示:在腫瘤淺表彌漫部、潰瘍隆起部、潰瘍床及腫塊突起部檢測的HER2陽性率分別是100%、90%、44%、100%,發現HER2在胃癌淺表彌漫部比潰瘍床部陽性率更高。既往有研究認為,在腺體形成區域和異型增生上皮區域中陽性率高于腫瘤侵襲區域[16,17]。當然需要注意的是,Subasinghe等[18]認為胃癌活檢標本中,腫瘤中心與腫瘤外圍組織HER2異質性可達30%以上。因此,指南[3,19]推薦內鏡標本應該在5個以上時可滿足HER2檢測需要,本研究所取的標本數也達到推薦的要求,結果可靠。這提示在內鏡下評估HER2狀態時應該重視腫瘤淺表彌漫部和潰瘍床的組織。
目前,在晚期乳腺腫瘤中以曲妥珠單抗為主的抗HER2靶向藥應用日趨廣泛,HER2靶向治療聯合化療的療效在進展期HER2陽性胃癌中也較可觀,其生存優勢在包括ToGA在內的一些研究中得以證實。本研究結果顯示鏡下未見印戒細胞的胃癌患者中HER2陽性率為23.6%,較含印戒細胞者更高,兩組比較有顯著差異(P=0.038),印戒細胞可能影響胃癌組織中HER2表達水平,這與Machado-Neves等[20]的研究結果一致。由于典型胃印戒細胞癌細胞在胃壁侵襲進展過程可以向低黏性腫瘤細胞轉化[21],而使HER2陽性胃癌病例中不含印戒細胞的病例數相對增加,可能使研究的結果出現放大效應。本研究回顧的病例數相對較少,還需進一步的大樣本研究證實。本研究以慢性淺表型胃炎為對照,雖可以消除HP、慢性黏膜炎癥、腸道菌群微環境等一些混雜因素,但由于慢性淺表型胃炎病變常局限黏膜淺層,對于一些浸潤深度達黏膜肌層或漿膜的癌性病變,上述混雜因素對本研究結果的影響可能難以完全均衡。此為本研究的不足之處。
總之,內鏡活檢標本評估HER2表達時應有針對性地取材,胃癌組織病理中見不到印戒細胞的胃癌組織HER2陽性率可能更高。因此,當病理提示未見印戒細胞而黏膜層存在大量炎性細胞浸潤或黏液細胞時,應該警惕假陰性的可能性,避免影響進一步靶向抗HER2治療。

