2型糖尿病患者外周血單個核細胞miR-18a、miR-125b相對表達水平與糖脂代謝、炎性因子及胰島素抵抗的關系研究*
侯黎明,劉迎見△,舒閃閃
1.新鄉醫學院附屬商丘市第一人民醫院內分泌科,河南商丘 476100; 2.商丘市婦幼保健院檢驗科,河南商丘 476000
2型糖尿病(T2DM)是內分泌科常見的一種代謝性疾病,主要特點為高血糖,病理基礎為胰島素分泌不足、胰島素抵抗,該病危害性較大,可引起神經性病變,增加病死率[1]。T2DM患者的糖代謝紊亂狀態持續存在,長期胰島素抵抗會影響心肌細胞利用葡萄糖,導致心臟所需能量不足,嚴重時可致心功能損害[2];脂代謝異常是糖尿病腎病惡化的影響因素之一[3],在T2DM進展過程中,糖脂代謝異常、炎性因子、胰島素抵抗均會引起T2DM患者病情惡化。近年來,有研究指出,微小核糖核酸(miRNA)參與了β細胞分化、糖尿病腎病等病變的發生、進展過程[4]。有學者發現,miR-125b對胰島細胞凋亡有調節作用[5]。另有研究提示,miR-18a作為miRNA的重要組成部分,參與了多種疾病的慢性應激過程,增加了機體患病風險[6]。單個核細胞包括兩類細胞,分別為淋巴細胞、單核細胞,可吞噬衰老細胞,通過檢測單個核細胞內相關因子表達情況,更能反映機體功能變化[7]。故本研究選取88例T2DM患者作為研究對象,分析T2DM患者外周血單個核細胞miR-18a、miR-125b相對表達水平與糖脂代謝、炎性因子及胰島素抵抗的關系,通過探討相互之間的關系,進一步了解T2DM患者病情,旨在為T2DM治療提供新思路,現報道如下。
1 資料與方法
1.1一般資料 選取2019年5月至2020年6月新鄉醫學院附屬商丘市第一人民醫院收治的T2DM患者88例(T2DM組)作為研究對象,另選取同期于該院體檢的健康志愿者65例作為對照組。兩組性別、年齡比較差異無統計學意義(P>0.05),見表1。研究方案獲該院倫理委員會批準,兩組均對研究內容知情同意。研究對象均符合T2DM診斷標準[8]:出現明顯的糖尿病癥狀,如多食、煩渴多飲、多尿等,且隨機血糖≥11.1 mmol/L;空腹血糖(FPG)≥7.0 mmol/L;口服葡萄糖耐量試驗提示餐后2 h血糖(2 hPG)≥11.1 mmol/L。

表1 兩組一般資料比較
1.2納入、排除標準
1.2.1納入標準 T2DM組:(1)滿足上述關于T2DM的診斷標準;(2)認知狀態、精神狀態正常。對照組:(1)身體健康狀況良好;(2)性別、年齡資料與T2DM組匹配;(3)認知狀態、精神狀態正常。
1.2.2排除標準 (1)出現急性并發癥;(2)腎臟、肝臟、心等臟器嚴重受損;(3)惡性腫瘤;(4)自身免疫性疾病;(5)近6個月內有外科手術史;(6)1型糖尿病或妊娠糖尿病;(7)伴急/慢性感染。
1.3方法
1.3.1樣本采集 兩組于就診或體檢當日,采集5 mL空腹靜脈血,分裝于兩管,一管用于檢測外周血單個核細胞miR-18a、miR-125b,另一管用于檢測糖脂代謝、炎癥指標。
1.3.2外周血單個核細胞miR-18a、miR-125b檢測 采集3 mL空腹肘靜脈血,行抗凝處理,利用密度梯度離心法分離單個核細胞,經Trizol試劑(北京雷根生物技術有限公司,NR0002)對總RNA進行提取,加入Trizol試劑500 μL,充分混合,在室溫下放置5 min,而后加入100 μL氯仿(上海研生生化試劑有限公司,YS-0043B),震蕩混合,放置2 min,使用高速離心機(湘儀集團,H1650)在4 ℃下行離心處理,時間為15 min,12 000 r/min,將上清液棄除。取100 μL異丙醇(西安晉湘藥用輔料有限公司,497-19-8)加入,充分混合后離心處理,將上清液棄除。取75%冰乙醇100 μL加入,離心后棄除上清液。經空氣干燥機(杭州超濾實業有限公司,CLRD-SA/W)干燥5~10 min,去除蛋白及水分。取焦炭酸二乙酯(美國Amresco,E174-5G)20 μL,使RNA完全溶解,存放于低溫冰箱(中科都菱,MPC-5V1500)待測。經紫外分光光度計(上海光譜儀器,SP-2500)對RNA樣品的純度予以檢測,分別在280、260 nm波長處各測1次,明確A260與A280比值,若比值處于1.8~2.1提示滿足檢測標準。各樣本均取RNA 1 ng經反轉錄成cDNA,反應條件設定為16 ℃ 30 min,42 ℃ 30 min,85 ℃ 5 min。熒光定量聚合酶鏈反應(PCR)反應引物序列如下:miR-18a上游引物為5′-GTG CTA AGG TGC ATC TAG CAG-3′,下游引物為5′-GTG CAG GGT CCG AGG T-3′;miR-125b上游引物為5′-GGA TGG TGT TAT AGG AGG TTG TG-3′,下游引物為5′-CTC TTT CCC CCA AAA CAA ATA TAC-3′;以U6為內參基因,上游引物為5′-CTC GCT TCG GCA GCA CA-3′,下游引物為5′-AAC GCT TCA CGA ATT TGC GT-3′。PCR反應條件為預變性95 ℃ 20 s,變性95 ℃ 10 s、退火57 ℃ 20 s、延伸72 ℃ 15 s,共40個循環,檢測儀器為PCR檢測儀(上海科源電子科技,Quick1600),經2-ΔΔCt法表示miR-18a、miR-125b相對表達水平。
1.3.3糖脂代謝及炎性因子檢測 將采集的血樣行離心處理,轉速3 000 r/min,離心時間10 min,離心半徑8 cm,分離血清,經博科生物(山東)BK-200全自動生化分析儀與配套試劑測定血清總膽固醇(TC)、三酰甘油(TG)、低密度脂蛋白膽固醇(LDL-C)、高密度脂蛋白膽固醇(HDL-C)水平。經酶聯免疫吸附試驗法檢測血清白細胞介素(IL)-1β、IL-6、IL-15、腫瘤壞死因子-α(TNF-α)水平,試劑盒購自江萊生物(上海),經放射免疫分析法測定空腹胰島素(FINS),試劑盒購自上海瑞齊生物科技有限公司。經厚美德生物(青島)GLS-77血糖分析儀測定2 hPG、FPG,經涵飛醫療(上海)CS2000糖化血紅蛋白(HbA1c)分析儀測定HbA1c。胰島素抵抗指數(HOMA-IR)=FPG×FINS/22.5。

2 結 果
2.1兩組外周血單個核細胞miR-18a、miR-125b相對表達水平比較 T2DM組外周血單個核細胞miR-18a、miR-125b相對表達水平均高于對照組,差異均有統計學意義(P<0.05),見表2。
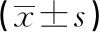
表2 兩組外周血單個核細胞miR-18a、miR-125b相對表達水平比較
2.2兩組血糖及胰島素抵抗指標比較 T2DM組2 hPG、FPG、HbA1c、FINS、HOMA-IR均高于對照組,差異均有統計學意義(P<0.05),見表3。
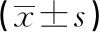
表3 兩組血糖及胰島素抵抗指標比較
2.3兩組脂代謝指標比較 T2DM組TC、TG、LDL-C高于對照組,而HDL-C低于對照組,差異均有統計學意義(P<0.05),見表4。

表4 兩組脂代謝指標比較
2.4兩組血清炎性因子比較 T2DM組血清IL-1β、IL-6、IL-15及TNF-α高于對照組,差異均有統計學意義(P<0.05),見表5。
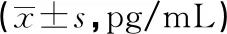
表5 兩組血清炎性因子比較
2.5T2DM患者外周血單個核細胞miR-18a、miR-125b相對表達水平與各指標相關性分析 外周血單個核細胞miR-18a、miR-125b相對表達水平與2 hPG、FPG、HbA1c、FINS、HOMA-IR、LDL-C、IL-1β、IL-6、IL-15、TNF-α呈正相關,與HDL-C呈負相關(P<0.05),但二者與TC、TG無相關性(P>0.05),見表6。

表6 T2DM患者外周血單個核細胞miR-18a、miR-125b相對表達水平與各指標相關性分析
3 討 論
據國際糖尿病聯盟數據顯示,我國2013年T2DM患病率已高達10.4%[9]。該病發病機制比較復雜,臨床上尚未完全明確其特點,既往研究采用血糖、血脂等常規指標評估患者病情,雖然具有一定價值,但僅能反映糖脂代謝、胰島素反應的變化,存在局限性,臨床仍需尋求可靠指標對其病情進展予以判斷,為治療提供依據。既往有學者認為,過表達的miR-18a可能具有擾亂機體蛋白質代謝,削弱腎臟、血管等生理功能的作用[10]。miR-125b表達可能影響血管平滑肌細胞的分化[11]。臨床通過評估T2DM患者外周血單個核細胞miR-18a、miR-125b相對表達水平,可能有利于進一步了解病情,提出針對性干預方案。
本研究結果顯示,T2DM組外周血單個核細胞miR-18a、miR-125b相對表達水平均高于對照組,差異均有統計學意義(P<0.05)。miR-18a是miR-17-29家族的一員,其異常表達與機體免疫存在關聯,在免疫應答、細胞發育中有重要作用[12]。miR-18a可通過調節酪氨酸激酶-轉錄激活因子通路,促進炎癥介質釋放,導致機體炎癥加重,它在低度炎癥進展中發揮了重要作用[13]。基于此,筆者推測miR-18a可能通過其對炎癥介質的調控作用,參與T2DM進展。有學者認為miR-125b過表達對高糖誘導的炎性反應有促進作用,從而加速內皮細胞損傷,影響內皮細胞功能,這可能是其過表達促進糖尿病進展的原因[14]。研究表明T2DM患者的輔助性、調節性T細胞處于不平衡狀態[15]。而高表達的miR-125b則可能通過影響B淋巴細胞誘導成熟蛋白和干擾素調節因子-4的表達,引起輔助性、調節性T細胞失衡[16]。
本研究結果顯示,與對照組相比,T2DM組2 hPG、FPG、HbA1c、FINS、HOMA-IR及TC、TG、LDL-C顯著升高,而HDL-C下降,差異均有統計學意義(P<0.05),提示T2DM患者存在糖脂代謝紊亂與胰島素抵抗。糖尿病患者存在糖脂代謝紊亂,這主要是由于患者的胰島素功能障礙或胰島素分泌不足所致,癥狀包括餐后血糖或FPG上調及血脂代謝異常,引起胰島素抵抗及血糖、血脂指標增高[17]。當人機體持續處于高血糖狀態時,會出現膽固醇累積,導致動脈血管壁脂質沉積速度增快,促進動脈粥樣硬化的發生[18]。血脂代謝異常也與胰島素抵抗有關,隨著病程延長,可能出現心肌代謝障礙,引起心肌缺血,胰島素抵抗貫穿于T2DM發病的整個過程[19]。本研究發現,T2DM組血清IL-1β、IL-6、IL-15及TNF-α高于對照組,差異均有統計學意義(P<0.05),表明患者存在炎癥。持續血糖增高會影響單個核細胞合成功能,促進炎癥介質大量釋放,IL-1β、IL-6、IL-15均為促炎因子,可加重機體炎癥嚴重程度,三者均通過單個核細胞進行釋放,能對趨化蛋白予以介導,對糖尿病患者病情影響較大[20]。TNF-α與糖尿病并發癥發生存在關聯,也可加重糖尿病患者的機體炎癥[21]。基于此,臨床要加強對患者機體炎癥的觀察,以便調整治療方案。本研究最終證實,T2DM患者的外周血單個核細胞miR-18a、miR-125b相對表達水平與2 hPG、FPG、HbA1c、FINS、HOMA-IR、LDL-C、IL-1β、IL-6、IL-15、TNF-α呈正相關,與HDL-C呈負相關,表明患者miR-18a、miR-125b表達與糖脂代謝、炎性因子、胰島素抵抗存在關聯。T2DM患者的糖脂代謝紊亂、炎癥程度、胰島素抵抗相應呈進行性發展,miR-18a可能通過調控炎癥介質促進T2DM進展,miR-125b則可加重高糖誘導的炎性反應程度,引起內皮細胞損害,參與T2DM進展。外周血單個核細胞miR-18a、miR-125b的高表達均可加重T2DM病情,二者相對表達水平越高,意味著血糖控制越差,繼而導致糖脂代謝紊亂、炎性反應與胰島素抵抗進一步加重。
綜上所述,T2DM患者外周血單個核細胞miR-18a、miR-125b表達明顯上調,且這類患者存在糖脂代謝紊亂、炎性反應及胰島素抵抗,而外周血單個核細胞miR-18a、miR-125b表達與上述表現存在相關性。此外,本研究也存在一定的局限性,如樣本量較少,且T2DM發生機制復雜,可能有多個miRNA參與,受研究經費限制本研究僅選擇了miR-18a、miR-125b進行觀察,未來還需加大樣本量對此進行拓展研究。

