內質網應激相關因子在膿毒癥患者外周血單個核細胞中的表達及臨床意義*
盧 玲,姚 偉△,龔光遠
1.重慶醫科大學附屬第三醫院呼吸內科,重慶 401120;2.重慶市綦江區人民醫院重癥醫學科,重慶 401420
目前,膿毒癥是造成我國重癥監護病房患者死亡的主要原因之一。據估計,全世界每年發生1 800萬例膿毒血癥[1]。以炎癥風暴為特征,進而導致多器官功能損傷及衰竭,是膿毒癥發生、發展的病理生理學基礎[2]。盡管針對膿毒癥的相關研究,近些年已取得了一定進展,但有效的診斷和治療方法仍相對欠缺。為了降低膿毒癥及相關并發癥的病死率,更好地明確膿毒癥相關的生物學機制至關重要。內質網是負責蛋白質折疊、組裝的細胞器,參與了眾多生理功能。在應激和炎癥狀態下,內質網功能受損,引起未折疊的蛋白應答激活,以重建細胞穩態[3]。但內質網中未折疊蛋白長期積聚,觸發內質網應激,會引發細胞凋亡。越來越多的證據表明,內質網應激與眾多炎癥性疾病及惡性腫瘤的發生及發展相關[4-5]。本研究擬觀察膿毒癥患者外周血單個核細胞(PBMC)中內質網應激相關因子表達水平,并分析其與患者預后的關系。
1 資料與方法
1.1一般資料 選取2018年1月至2020年8月在重慶醫科大學附屬第三醫院(簡稱本院)就診的膿毒癥患者130例(觀察組)為研究對象。觀察組男75例、女55例,年齡31~72歲、平均年齡(50.5±13.8)歲,體質量指數(25.0±3.1)kg/m2。納入標準:(1)年齡>18~75歲;(2)所有患者均滿足膿毒癥診治指南[6]:對于感染或疑似感染的患者,膿毒癥相關序貫器官衰竭(SOFA)評分較基線上升≥2分。排除標準:(1)數據不完整或不準確的患者;(2)入院24 h內死亡的患者;(3)患慢性疾病的患者如惡性腫瘤、自身免疫性疾病等;(4)近期接受免疫抑制劑治療的患者;(5)未簽署知情同意書的患者。根據觀察組患者預后分為存活組(96例)和死亡組(34例)。另選取50例健康志愿者為對照組,均來自同期同一醫療機構的健康體檢中心,其中男28例,女22例,年齡32~70歲,平均年齡(51.3±14.0)歲,體質量指數(25.2±3.5)kg/m2,觀察組與對照組在性別、年齡、體質量指數等方面比較,差異無統計學意義(P<0.05)。該研究獲得本院倫理委員會批準,并征得患者家屬知情同意。
1.2方法
1.2.1檢測內質網應激相關因子mRNA表達水平 收集所有研究對象外周血3 mL,提取單個核細胞(PBMC),采用實時定量PCR檢測內質網應激相關因子mRNA表達水平。具體檢測方法見相關參考文獻[7],簡要步驟包括設計引物(引物序列見表1)、RNA提取、逆轉錄、擴增等。以甘油醛-3-磷酸脫氫酶(GAPDH)為內參,使用2-ΔΔCt方法計算相對mRNA表達水平。

表1 引物序列
1.2.2檢測內質網應激相關基因蛋白表達水平 提取各組PBMC,在RIPA裂解緩沖液中進行冰育裂解20 min,經離心后收集上清液,BCA法測定蛋白濃度。配置10%電泳液,進行蛋白免疫印跡,檢測內質網應激相關蛋白表達水平。具體操作可見參考文獻[8],簡要步驟如下:每孔加入等量蛋白,經電泳、轉膜、封閉、一抗孵育(抗CHOP抗體和抗ATF-6抗體均為1∶500,抗GAPDH抗體為1∶800)、洗滌、二抗孵育、洗滌及顯影等。以GAPDH為內參,計算內質網應激相關蛋白條帶與GAPDH灰度比值。
1.2.3檢測PBMC中部分炎性和氧化應激指標 收集所有研究對象空腹靜脈血3 mL,經抗凝離心后,獲取血清,采用酶聯免疫吸附試驗(ELISA)法測定不同組間PBMC中部分炎性指標[白細胞介素(IL)-1β、IL-6]和氧化應激指標[超氧化物歧化酶(SOD)、丙二醛(MDA)]水平。具體檢測方法見相關試劑盒說明書,炎性指標試劑盒購自南京建成生物公司,氧化應激指標試劑盒購自武漢博士德生物公司。

2 結 果
2.1對照組與觀察組PBMC中內質網應激相關因子mRNA及蛋白表達水平比較 與對照組比較,觀察組患者PBMC中內質網應激相關因子CHOP和ATF-6 mRNA及蛋白表達水平顯著升高(P<0.05),見表1及圖1。
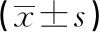
表1 兩組外周血內質網應激相關因子mRNA表達水平比較
2.2對照組與觀察組PBMC中部分炎性及氧化應激指標水平比較 與對照組比較,觀察組PBMC中部分炎性指標IL-1β、IL-6水平和氧化應激指標MDA水平顯著升高,而抗氧化應激指標SOD水平顯著降低,差異均有統計學意義(P<0.05),見表2。
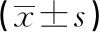
表2 兩組PBMC中部分炎性和氧化應激指標水平比較
2.3不同預后組間PBMC中內質網應激相關因子mRNA和蛋白表達水平比較 與存活組比較,死亡組患者PBMC中內質網應激相關因子CHOP和ATF-6 mRNA及蛋白表達水平顯著升高,差異有統計學意義(P<0.05),見表3。
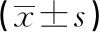
表3 不同預后組PBMC中內質網應激相關因子mRNA和蛋白表達水平比較
2.4不同預后組PBMC中部分炎性及氧化應激指標水平比較 與存活組比較,死亡組PBMC中部分炎性指標IL-1β、IL-6水平和氧化應激指標MDA水平顯著升高,而抗氧化應激指標SOD水平顯著降低,差異均有統計學意義(P<0.05),見表4。

注:與對照組比較,aP<0.05。
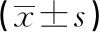
表4 不同預后組PBMC中部分炎性和氧化應激指標水平比較
2.5相關性分析 觀察組PBMC中CHOP和ATF-6 mRNA分別與IL-1β(r=0.450,P=0.019;r=0.493,P=0.017)、IL-6(r=0.413,P=0.025;r=0.445,P=0.019)、MDA(r=0.540,P=0.013;r=0.590,P=0.008)水平呈正相關。而與SOD水平呈負相關(r=-0.514,P=0.016;r=-0.499,P=0.017)。
2.6ROC曲線分析 觀察組PBMC中CHOP和ATF-6 mRNA的ROC曲線下面積(AUC)分別為0.852(95%CI:0.775~0.929)和0.840(95%CI:0.755~0.926),靈敏度分別為77.27%和76.92%,特異度分別為84.91%和79.49%,見圖2。

圖2 ROC曲線分析
3 討 論
膿毒癥引發眾多器官功能不全,造成高致死率,是目前臨床面臨的重大醫學問題。膿毒癥發病機制極其復雜,包括炎性反應、免疫功能障礙、線粒體損傷、神經內分泌免疫網絡異常、自噬及其他病理生理過程,最終導致器官功能障礙[9]。最近研究表明,內質網應激信號與膿毒癥引起的組織細胞死亡有關,在膿毒癥細胞及動物模型中,未折疊或錯誤折疊的蛋白質積聚在內質網中,改變其穩態,導致氧化應激和鈣超載,促進內質網應激通路的激活[10]。抑制內質網應激信號,可顯著降低膿毒癥引起的細胞凋亡,降低炎性反應,改善器官功能[11]。在膿毒癥患者人群中,內質網應激相關因子表達水平如何,并且與預后的關系,目前尚未闡明。
研究顯示,內質網應激信號通路的激活與多種疾病如糖尿病、高血壓、缺血再灌注損傷等發生、發展密切相關[12-14]。抑制內質網應激,可穩定蛋白質構象,促進未折疊或錯誤折疊的蛋白質轉移出內質網,提示抑制內質網應激信號可能是疾病治療的重要靶點[15]。內質網應激主要包含3條信號通路如CHOP的轉錄激活,肌醇酶-1及ATF-6激活。膿毒癥大鼠中,心臟組織內質網應激主要成分CHOP顯著上調,可作用于腫瘤壞死因子受體家族或內質網氧化還原1樣蛋白,引起過量的鈣離子從內質網運輸至線粒體,觸發鈣依賴型細胞凋亡通路[16]。ATF-6作為內質網未折疊蛋白反應中關鍵的應激蛋白,當受到壓力時被切割為具有轉錄因子活性的蛋白,并從高爾基體膜轉位至細胞核中,激活靶基因的表達,從而參與調控內質網應激反應,維持細胞內蛋白質穩態[17]。在內質網應激狀態下,ATF-6過度激活可導致與內質網相互作用的多個膜性細胞器穩態的失衡,包括核膜的皺縮、異染色質的丟失及線粒體結構和膜電勢的紊亂,促進半胱氨酸蛋白酶-3凋亡通路激活[18-20]。本研究結果顯示,與對照組比較,膿毒癥患者PBMC中內質網應激顯著激活,同時下游炎性和氧化應激指標顯著上調,表明內質網應激促進了下游炎癥及氧化應激反應,參與了膿毒癥的發生過程。相關研究顯示,內質網應激可促進炎癥及氧化應激激活,降低大鼠血管舒張反應,升高血壓,而給予內質網應激抑制劑處理,可顯著逆轉上述異常反應[21]。觀察組根據膿毒癥預后進行分組,研究結果提示,死亡組患者內質網應激及下游通路顯著較存活組增強。ROC曲線分析顯示,PBMC中內質網應激相關因子(CHOP和ATF-6 mRNA)對膿毒癥患者預后的評估價值較高,提示這兩項指標具有一定的臨床運用價值。內質網應激的激活參與了膿毒癥的發生、發展過程,其相關標志物不僅可作為評估膿毒癥患者預后的有效指標,還可能為其治療提供有效的靶點。
膿毒癥患者PBMC中內質網應激顯著激活,其相關因子可作為評估膿毒癥患者預后的有效指標,但膿毒癥患者中,內質網應激的上游調控機制尚不清楚,還需動物及細胞實驗進一步探索及驗證。

