全固態鋰離子電池的研究進展與挑戰
宋潔塵,夏青,徐宇興,譚強強
(1 中國科學院過程工程研究所多相復雜系統重點實驗室,北京 100190;2 中國科學院大學化學工程學院,北京100049;3 中科廊坊過程工程研究院,河北 廊坊 065001;4 河北省先進能源材料技術創新中心,河北 廊坊 065001)
隨著能源的不斷消耗和資源的日益短缺,能量儲存與轉換變得愈發重要。作為目前主要的能量儲存與轉換裝置之一,二次電池吸引了眾多的關注與研究。其中,鋰離子電池展現出了工作電壓高、能量密度大、循環壽命長、自放電低和無記憶效應等優點,現已廣泛應用于手機、電腦、無人機、航空航天和新能源汽車等領域[1]。
鋰離子電池的發展備受各國關注與支持。以新能源汽車為例:政策方面,我國頒布的《節能與新能源汽車產業發展規劃(2012—2020年)》與《新能源汽車產業發展規劃(2021—2035年)》為鋰離子電池的發展提供了保障,新能源汽車產業逐步進入快速發展期;市場方面,如圖1所示[2],在2005—2020 年,以鋰離子電池為核心的新能源汽車的全球產量逐漸提升,且提升勢頭至少保持至2050年。可以預見未來在新能源領域,鋰離子電池將具有很強的競爭力和廣闊的發展前景。
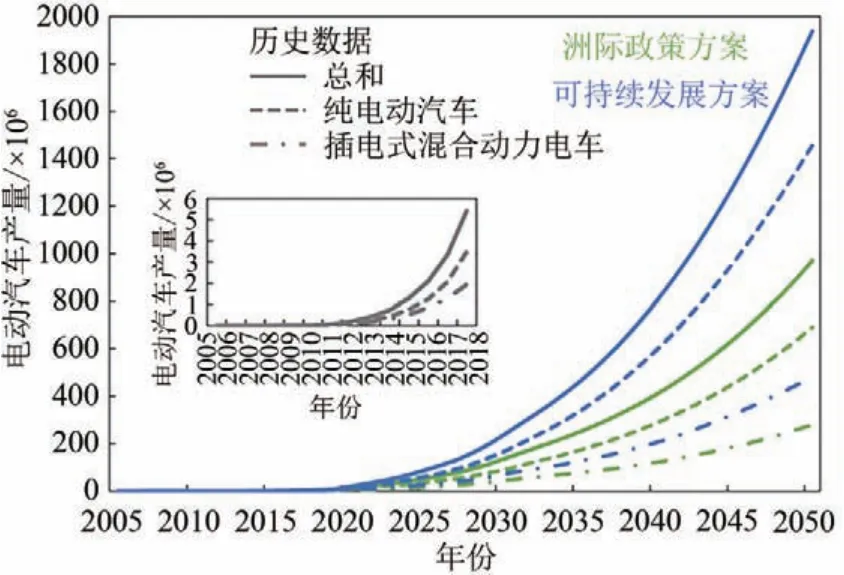
圖1 全球電動汽車產量發展及預測[2]
目前商用的鋰離子電池多采用以有機溶劑和鋰鹽為主的液態電解質,因此存在漏液、易燃易爆等安全性問題,而全固態鋰離子電池以固態物質為電解質,具有不易燃易爆、不會揮發、不漏液等優點,提高了電池的安全性和環境友好性。除此之外,全固態鋰離子電池具有較寬的電化學窗口以及較高的能量密度[3],如圖2 所示,聚合物基固態電解質鋰離子電池和薄膜固態電解質鋰離子電池的能量密度遠高于傳統的鎘基、鎳基和鉛酸電池[4]。
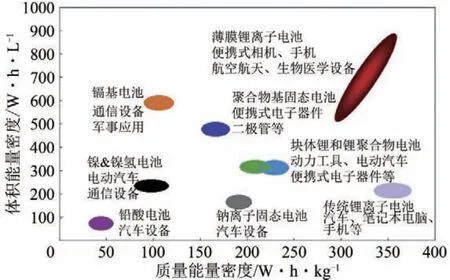
圖2 不同類型的電池容量[4]
雖然全固態鋰離子電池具有上述諸多優點,但是在實際應用過程中存在電極/電解質界面相容性差、離子電導率低等問題[5]。作為全固態鋰離子電池的核心,固態電解質在全固態鋰離子電池的實際應用中發揮著重要作用。本文以固態電解質為研究對象,綜述了全固態鋰離子電池存在的問題和研究進展,并對其未來的發展提出了建議與展望。
1 全固態鋰離子電池的組成
全固態鋰離子電池的內部主要由電極材料和固態電解質組成,結構如圖3 所示[6]。正負極材料涂敷于相應的集流體上,固態電解質(SE)位于正負極之間。電池放電時,電子通過外電路從負極傳輸至正極,鋰離子則通過固態電解質,從負極傳輸至正極;電池充電時,電子和鋰離子的傳輸方向與放電時相反。全固態鋰離子電池在這種電子、鋰離子傳輸機制下完成充放電循環。
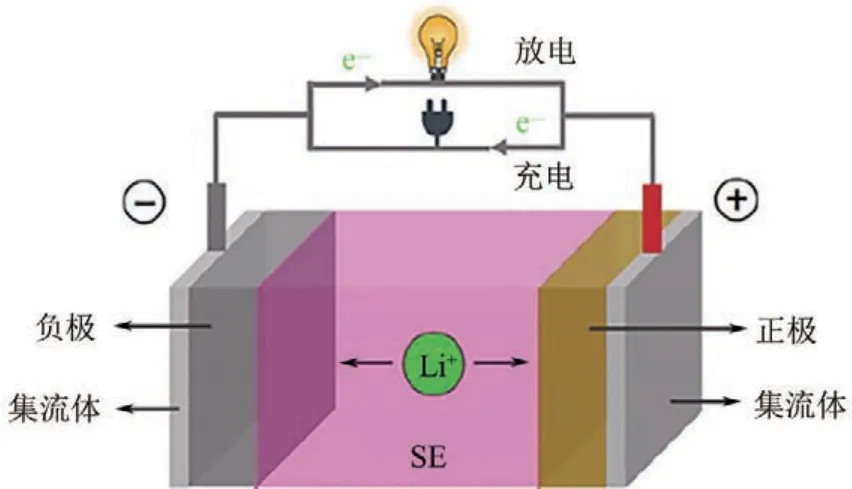
圖3 全固態鋰離子電池結構示意圖[6]
1.1 電極材料
作為電池體系中的鋰離子提供者,正極材料主要有LiCoO2、尖晶石結構的LiMn2O4、橄欖石結構的LiFePO4、LiNi1/3Mn1/3Co1/3O2等三元材料,以及富鋰層狀結構的Li2MnO3·LiMO2(M=Ni、Co、Mn 等過渡金屬)。負極是在電池充電過程中發生鋰化的地方,主要有石墨、金屬鋰及其合金、硅基和錫基材料、金屬氧化物等[7-8]。
1.2 固態電解質
固態電解質在全固態鋰離子電池中起到傳輸鋰離子的作用。固態電解質可分為有機聚合物電解質和無機固態電解質,前者包括固態聚合物電解質(SPE)和凝膠聚合物電解質(GPE),后者包括氧化物基固態電解質(SCOs)和硫化物基固態電解質(SCSs)[9],如圖4所示。
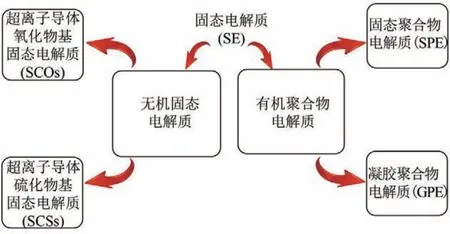
圖4 固態電解質的分類
1.2.1 有機聚合物電解質
固態聚合物電解質主要有聚氧化乙烯(PEO)、聚偏氟乙烯(PVDF)和氯化聚乙烯(PEC)等。其中,PEO受益于其優異的鹽溶性和電極界面相容性,成為了最常用的固態聚合物電解質。凝膠聚合物電解質是向聚合物基體中添加有機液態增塑劑[10],鋰離子在其內部的傳輸機理類似于液態電解質,但是相較于液態電解質,凝膠聚合物電解質可以保證一定的柔韌性,從而實現更高的安全性[11]。常見的凝膠聚合物電解質有聚偏二氟乙烯(PVDF)-六氟丙烯(HFP)、聚甲基丙烯酸甲酯(PMMA)-聚丙烯腈(PAN)等。
1.2.2 氧化物基固態電解質
氧化物基固態電解質包括鈉超離子導體(NASICON)型、鈣鈦礦型以及石榴石型。
NASICON 型化合物的化學通式可以寫為AxMM'(XO4)3,其中A 代表Li、Na、K、Mg 等堿金屬和堿土金屬元素,M 和M'代表Fe、Ti、Zr 等過渡金屬元素,X代表S、P、Si等非金屬元素[12],研究較為廣泛的主要有Li1+xAlxTi2-x(PO4)3(LATP)等。NASICON型化合物的晶體結構如圖5所示[12],其主要由M/M'與O組成的[MO6]和[M'O6]八面體,以及X和O組成的[XO4]四面體組成。

圖5 NASICON六方晶系結構和NASICON單斜晶系結構
在NASICON 結構中,每兩個[MO6]或[M'O6]八面體與三個[XO4]四面體相結合組成一個基本結構單元,根據基本結構單元連接方式的不同,可以將NASICON結構分為六方晶系和單斜晶系。在c軸方向上,基本結構單元取向相同時,形成六方晶系結構,如圖5(a)和(c);基本結構單元取向相對時,形成單斜晶系,如圖5(b)和(d)。這些基本結構單元在c軸上相互連接組成一個條帶,這些條帶在三維空間中不斷擴展,即形成了NASICON晶體結構框架。堿金屬離子或堿土金屬離子A分布在兩個相鄰基本結構單元之間或者兩個相鄰條帶之間,這樣疏松的結構給鋰離子提供了充足的傳輸空間,有利于實現鋰離子的快速遷移。
鈣鈦礦型固態電解質材料的化學通式是ABO3,其中A代表稀土或堿土金屬元素,B代表過渡金屬元素[13],其晶體結構如圖6 所示[14]。ABO3屬于立方晶系,其中B以[BO6]八面體的形式占據立方體的八個角頂位置,A則位于立方體體心位置。

圖6 鈣鈦礦ABO3晶體結構構型[14]
另一種研究較為普遍的氧化物基固態電解質材料具有石榴石構型,目前研究最多的是Li7La3Zr2O12(LLZO)。LLZO晶體結構較為復雜,其存在兩種相態,室溫下為四方相,在100~150℃會發生相變,形成立方相[16]。四方相和立方相的晶體結構示意圖見圖7[17]。兩種相態的基本骨架均由[LaO8]十二面體和[ZrO6]八面體組成,鋰離子填充在八面體和[LaO8]十二面體空隙當中。在兩種相態的LLZO 中,鋰離子在相應的位點之間不斷遷移,實現高效運輸。如圖7(a)、(b)所示,在四方相LLZO 中,紅、橙、黃色的球分別代表處于Li1(8a)位、Li2(16f)位、Li3(32g)位的鋰離子,這些鋰離子兩兩相距較遠,且鋰離子所處的三種位置被完全占據。而如圖7(c)、(d)所示,在立方相LLZO 中,紅、橙兩色分別代表處于Li1(24d)位、Li2(96h)位的鋰離子。由于這些鋰離子相距較近,傳輸距離短,且鋰離子所處的兩種位置并未被完全占據,所以立方相LLZO 具有更高的鋰離子遷移率,導電性能更加優異[18]。
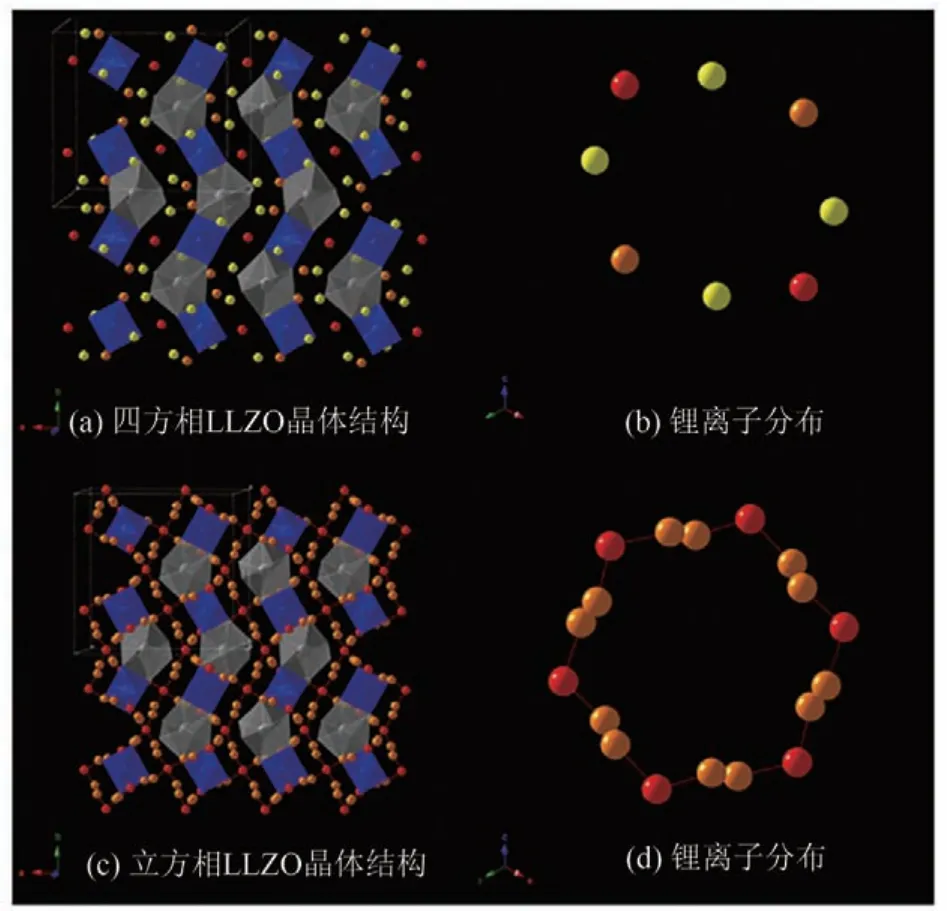
圖7 四方相LLZO晶體結構、鋰離子分布、立方相LLZO晶體結構及鋰離子分布[17]
1.2.3 硫化物基電解質
硫化物基固態電解質可分為非晶態硫化物、晶態硫化物和微晶玻璃硫化物。具有代表性的非晶態硫化物系為xLi2S-(1-x)P2S5和xLi2S-(1-x)SiS2系統;晶態的硫化物固態電解質主要為LISICON[Li14Zn(GeO4)4];微晶玻璃硫化物是由玻璃晶化而成,具有三維框架結構和沿c軸的一維鋰離子傳導路徑。
硫化物基固態電解質可以實現10-6~10-2S/cm的室溫離子電導率。Kanno 等[19]發現晶態硫化物基固態電解質Li9.54Si1.74P1.44S11.7Cl0.3和Li9.6P3S12可以分別實現高達0.025S/cm 的室溫離子電導率和高于95%的庫侖效率。其他晶態硫化物基固態電解質也被研究者們廣泛研究,其電導率隨溫度的分布匯總見圖8[19]。

圖8 晶態硫化物基固態電解質LGPS家族離子電導率分布情況[19]
硫化物基固態電解質雖然具有很高的離子電導率,但是化學穩定性差,在空氣中易與水發生反應,生成H2S;與鋰金屬負極和傳統正極材料在界面處發生副反應、形成空間電荷層(SCL),這成為了制約硫化物基固態電解質發展的重要因素[20]。
根據以上對不同類型的固態電解質的介紹,將固態電解質的類型及優缺點匯總于表1。
從表1中可以看出,有機聚合物電解質一般具有良好的柔韌性和電極界面相容性,且電極/電解質界面阻抗低,但卻存在機械強度低、無法抑制鋰枝晶等問題;無機固態電解質一般具有較高的離子電導率和機械強度,但柔韌性差,電極/電解質界面阻抗高。
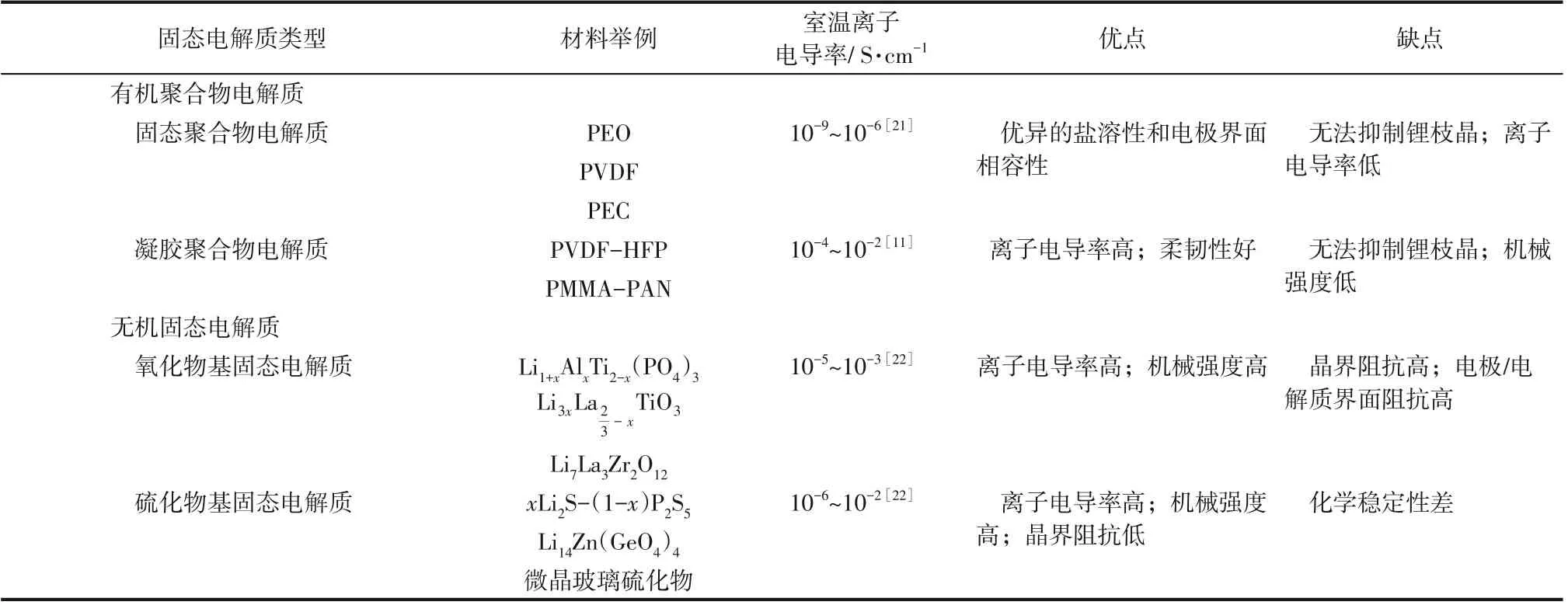
表1 固態電解質類型及優缺點匯總
2 電極/固態電解質界面
全固態鋰離子電池的組成與結構表明,正常的充放電循環依靠鋰離子在固態電解質內部以及電極/固態電解質界面處的傳輸。然而,在電極與固態電解質界面處,存在晶格失配、電極體積變化大、空間電荷層以及鋰枝晶的形成等問題,嚴重影響了鋰離子在界面處的傳輸。通過一定的措施,實現電極與固態電解質良好的接觸,對于提高全固態鋰離子電池的倍率性能、離子電導率和循環穩定性等電化學性能具有重要意義。
2.1 正極與固態電解質界面問題及解決方案
如圖9 所示[23],為了抑制鋰枝晶的生長等問題,固態電解質通常具有一定的機械強度,但這也使得其與正極之間的接觸方式為點對點式,與正極材料相容性較差。
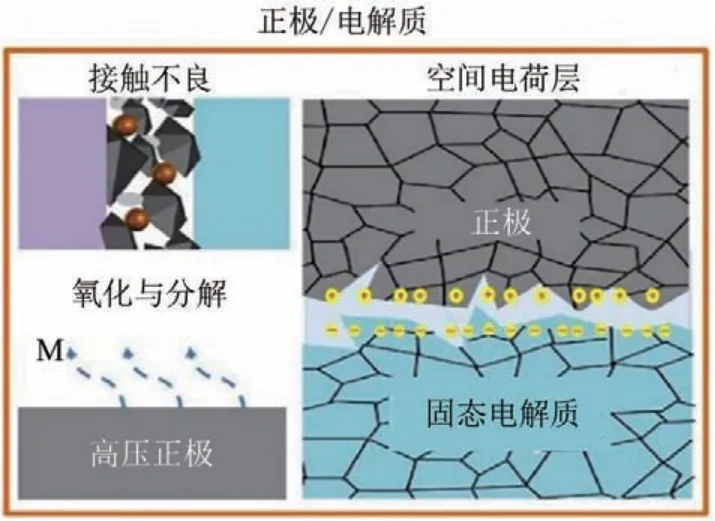
圖9 正極與固態電解質界面相容性問題示意圖[23]
正極與固態電解質的界面問題因固態電解質的種類不同而有所差異。當正極與氧化物基固態電解質接觸時,由于氧化物基固態電解質硬度較大,在循環過程中,會存在晶格失配和電極體積變化大等接觸問題;正極與硫化物基固態電解質相配合時,在界面處易形成空間電荷層,如LiCoO2正極與硫化物基固態電解質相接觸時,由于鈷的氧化物與鋰離子具有較強的鍵合,而含硫的離子與鋰離子之間的鍵合較弱,硫化物中的鋰離子更易進入LiCoO2正極,導致鋰離子濃度在正極一側偏高,在固態電解質一側偏低,形成空間電荷層,使得界面電阻升高[5];氧化物正極與氫化物固態電解質接觸時,易被還原,如當分別使用LiCoO2和LiBH4作為正極和固態電解質時,充電態Li1-xCoO2很容易與LiBH4反應,在LiCoO2/LiBH4界面上生成LiO2、Li2O、Co3O4和CoO(OH)[22]。
針對上述正極與固態電解質的界面接觸問題,有如下改進措施:①通過將正極材料與固態電解質復合以減少界面阻力。如Zhou 等[24]在丁二腈基固態電解質內原位聚合氰乙基聚乙烯醇(PVA-CN),原位聚合的方式保證了復合腈基固態電解質與正極之間優異的黏性,改善了正極與固態電解質的界面接觸性;Wan 等[25]在正極與固態電解質內部加入PEO和雙三氟甲磺酰亞胺鋰LiTFSI,通過加熱熔融PEO的方式,有效提高了正極與固態電解質的界面相容性和穩定性;Chen等[26]將固態電解質直接鑄造到正極層中,以改善正極與固態電解質的潤濕性。②構造三維多孔結構固態電解質,作為基體支撐正極材料,以解決正極與固態電解質界面接觸問題[23]。Xu 等[27]通過流延鑄造法設計了三維多孔-致密-多孔三層石榴石型固態電解質,并作為基體支撐正極材料,提高了全固態鋰離子電池的循環穩定性。③將緩沖層引入固態電解質/正極界面,或者采用無機/聚合物復合電解質[22],充分發揮聚合物電解質優異界面相容性的優勢。Park 等[28]在正極LiCoO2與石榴石型固態電解質LLZO 之間引入Li3BO3中間層,有效抑制LiCoO2與LLZO 在界面處的相互擴散,穩定LLZO 的立方相構型,提高了全固態鋰離子電池的循環穩定性和首次庫侖效率。
2.2 負極與固態電解質界面問題及解決方案
在諸多負極材料中,金屬鋰的理論比容量高達3860mA·h/g,且得益于全固態鋰離子電池的無水環境,金屬鋰在全固態鋰離子電池負極材料中備受關注,但鋰離子易在金屬鋰與固態電解質界面上不均勻沉積,導致鋰枝晶的產生,如圖10 所示[29]。鋰枝晶會使具有熱效應的電流在金屬鋰/固態電解質界面處不均勻分布,從而導致金屬鋰表面溫度梯度的形成,造成電池短路[30-31]。鋰合金的出現可以緩解上述問題,常見的鋰合金有LixM(M=In、B、Al、Ga、Sn、Si、Ge等)[32]。一方面合金原子在主晶格中可以儲存多個鋰原子;另一方面合金原子的加入可以降低鋰金屬的活性,有效抑制鋰枝晶的產生和鋰合金/固態電解質界面處電化學副反應的發生,但是鋰合金會在鋰化過程中產生較大的體積變化,破壞其與固態電解質的界面,導致電池循環穩定性降低。

圖10 鋰枝晶的產生[29]
針對上述問題,選擇合適的電解質與負極配合,可改善負極與電解質界面的接觸性。目前,有如下改進措施:①設計合理的界面層。在負極與固態電解質之間設計一個柔性的、具有快速鋰離子傳輸通道和高鋰離子遷移數的界面層。Dong等[33]在鋰金屬與固態電解質之間加入液態的聚合物基膠水電解質,隨后將其固化,實現了鋰金屬負極與固態電解質界面的低阻抗。Liu等[34]在鋰金屬負極和石榴石型固態電解質之間成功引入凝膠電解質,石榴石型固態電解質/凝膠電解質/鋰金屬界面的建立使得固態電解質與鋰金屬的界面阻抗由1.4×103Ω·cm2減小到214Ω·cm2,大大提高全固態鋰離子電池的循環穩定性。Huo等[35]在鋰金屬與PEO-Li6.4La3Zr1.4Ta0.6O12固態電解質之間引入離子液體[BMIM]TF2N,降低界面阻抗的同時,在20℃下實現2.2×10-4S/cm 的高離子電導率。②通過原位聚合的方式合成固態電解質,改善與負極之間的界面。Ju等[36]通過原位聚合的方式合成了聚氯乙烯醋酸乙烯酯PVCALi10SnP2S12固態電解質,成功改善了其與鋰金屬負極之間的界面接觸問題,使界面阻抗由1292Ω·cm2減小到213Ω·cm2。③通過在固態電解質中加入機械強度高的無機顆粒骨架,或直接設計固態電解質骨架,構建高力學模量的固態電解質,在硬度和柔性之間尋找一個平衡,使電解質既有較高的力學模量來阻止鋰枝晶的生長,又能保證電解質和負極之間有較好的接觸性。Li 等[37]設計了復合LLZO 納米纖維的PVDF-HFP 基固態電解質,展現出優異的力學性能,抑制了鋰枝晶的生長,實現高的循環穩定性和倍率性能。Chen 等[38]合成出(1-x)[PEO8-LiTFSI]-xLLZTO 復合固態電解質,通過改變LLZTO 的質量分數,構造“聚合物中的陶瓷”和“陶瓷中的聚合物”。結果表明前者具有更好的柔韌性和較低的成本,后者具有更高的力學性能和安全性,兩者均改善鋰金屬與固態電解質界面,使全固態鋰離子電池展現出較好的循環穩定性。Zeng等[39]通過PEO 和支鏈丙烯酸酯的光聚合,合成具有互穿性聚(醚-丙烯酸酯)(ipn-PEA)網絡的新型固態聚合物電解質,展現出0.22mS/cm的高室溫離子電導率以及優異的力學性能,實現剛性和塑性的結合。④使用自愈合的電解質。自愈合的電解質具有很好的黏彈性,可承受負極體積變化,同時還能避免充放電過程中裂紋引起的接觸失效。Whiteley等[40]將自愈合聚合物基體聚亞胺顆粒加入固態電解質77.5%Li2S-22.5%P2S5中,通過外界施壓,使自愈合聚合物基體發生可逆交聯作用,為固態電解質提供力學保障,進一步提高了全固態鋰離子電池的離子電導率和循環穩定性。⑤使用彈性電解質。在循環過程中彈性電解質可以與負極始終保持良好的接觸,同時其較高的彈性,可以保護電池免于沖擊力的攻擊。Wei 等[41]制備出具有環氧乙烷支鏈的“蜈蚣狀”PEOB,形成具有良好網絡拓撲結構的鋰離子導電彈性體,組裝的LiFePO4/SE/Li 電池具有優異的室溫離子電導率和循環穩定性。
3 PEO固態聚合物電解質存在問題及解決方案
固態聚合物電解質中,PEO 由于具有安全性好、成本低、易制備、能量密度高、電化學穩定性好、與鋰鹽相容性好等優點,已成為了固態電解質的研究焦點[42],但是其離子電導率低,無法滿足實際應用要求。本節以PEO固態聚合物電解質為例,概述了固態電解質離子電導率問題及解決方案。
如圖11 所示,PEO 具有高分子長鏈結構,內部包含晶體部分和非晶體部分。研究表明,晶體部分會減緩PEO的鏈段運動[43],而鋰離子的傳輸依靠PEO的鏈段運動,所以過高的晶區比例不利于鋰離子的傳輸,因此PEO 固態聚合物電解質的改進一直圍繞著抑制PEO 結晶,增加非晶區比例來進行。

圖11 聚氧化乙烯PEO的形貌示意圖
通常利用PEO 與鋰鹽優異的相容性,將LiClO4、LiTFSI、LiPF6、LiAsF6、LiBF4等鋰鹽加入PEO 中,但鋰鹽填充的PEO 基固態電解質在室溫下離子電導率僅為10-9~10-6S/cm[21],達不到固態電解質商業化應用要求(不低于10-4S/cm)[44]。目前提高PEO 固態聚合物電解質室溫離子電導率的方法主要有添加增塑劑[45-49]、添加無機陶瓷填料[50-56]、制備聚合物共混物[57-60]、構造嵌段共聚物[61-65]等。
3.1 添加增塑劑
加入鋰鹽的PEO 基固態電解質主要依靠PEO的非晶區傳輸鋰離子,鋰離子通過與PEO 的醚氧鍵發生類似于與有機碳酸鹽絡合的配位,在鏈內部或鏈間不斷遷移,實現自身的快速傳導。
增塑劑的添加可降低PEO 的結晶度,提高其離子電導率。Niedzicki 等[45]發現將低分子量的PEO類似物聚乙二醇PEG 加入到PEO-LiTf 固態電解質中后,在鹽濃度為0.1~1mol/m3的范圍內,復合固態電解質的室溫離子電導率可以達到10-3~10-4S/cm,并實現高于0.5 的鋰離子遷移數。Vignarooban 等[46]通過將碳酸亞乙酯(EC)加入到TiO2納米顆粒填充的PEO-LiTf 固態電解質中,將30℃下的離子電導率從4.9×10-5S/cm 提高到1.6×10-4S/cm。結果證明,EC 的加入可降低PEO 的結晶度,提高其電導率。 Echeverri 等[47]構 造 了PEO-LiTFSI/琥 珀 腈(SCN)混合物,使用交流阻抗譜法確定其室溫離子電導率,發現可達2.9×10-3S/cm。Kumar等[48]報道了用離子液體1-乙基3-甲基咪唑基三氟甲烷磺酸鋰(EMITf)作為增塑劑,加入到PEO-LiTf固態電解質中,在添加量為40%時,實現了3.0×10-4S/cm的室溫離子電導率,同時此復合電解質具有寬的電化學窗口和良好的熱穩定性。Choi等[49]將離子液體1-丁基-3-甲基咪唑雙(三氟甲烷磺酰基)酰亞胺(BMITFSI)加入PEO-LiTFSI 中,在室溫下實現3.2×10-4S/cm 的離子電導率,并展現出良好的電化學穩定性。
作為一種較為傳統的提高PEO 固態聚合物電解質離子電導率的方法,增塑劑的添加已經取得一定的效果。但是增塑劑多為有機液相物質,即使是固態的增塑劑,如琥珀腈(SCN),也會在室溫下溶解鋰鹽形成溶液[42],這會使全固態鋰離子電池高安全性大打折扣。
3.2 添加無機陶瓷填料
通過添加無機陶瓷填料,構造PEO 基復合固態電解質,可以有效提高其離子電導率。添加的無機陶瓷填料包括惰性無機陶瓷填料和離子導體無機陶瓷填料。惰性無機陶瓷填料多指SiO2、Al2O3、TiO2、MgO、ZnO、ZrO2等不含鋰離子的氧化物;離子導體無機陶瓷填料則主要為無機固態電解質,包括氧化物基固態電解質和硫化物基固態電解質。無機陶瓷填料的添加除了可以降低PEO的結晶度,增加其非晶區域所占比例外,還可以通過與PEO和鋰鹽相互作用,間接或直接實現對鋰離子遷移率的影響,進而提高PEO 固態聚合物電解質的離子電導率。
3.2.1 惰性無機陶瓷填料
惰性無機陶瓷填料一方面可以與PEO 和鋰鹽中的氧原子形成氫鍵,使聚合物鏈段發生彎曲形變,促使其結晶度降低[55];另一方面也可以通過與鋰鹽陰離子作用,促進鋰鹽分解,釋放鋰離子,提高鋰離子遷移數[66];還可以作為物理交聯中心,與PEO和鋰鹽相互作用,改變鏈段結構狀態,降低其結晶度,優化鋰離子傳輸路徑[67]。
研究者們對惰性無機陶瓷填料的種類和形貌進行了較多的探索,以實現更高的離子電導率。Capiglia 等[50]向PEO8-LiN(CF3SO2)2中添加納米SiO2顆粒,發現當SiO2添加量為5%時,復合固態電解質的室溫離子電導率可達1.4×10-4S/cm,當添加量增加到10%時,鋰離子遷移數從0.1左右增加到0.2左右,幾乎實現了翻倍。Lin等[51]采用原位水解法,在PEO-LiClO4中原位合成出直徑為12nm的單分散SiO2微球,如圖12(a)所示。此種微球相比于單個的納米SiO2顆粒,與PEO鏈之間的相互作用更強,在60℃下,實現1.2×10-3S/cm 的離子電導率,同時獲得高達5.5V 的電化學窗口。Croce 等[52]將粒徑為13nm的TiO2和5.8nm的Al2O3粉末分別混合入PEOLiClO4固態電解質中,離子電導率在50℃和30℃下,可分別達到10-4S/cm 和10-5S/cm,進一步證實惰性無機陶瓷填料的添加可以較好地提高PEO 基固態電解質的室溫離子電導率。Kumar等[53]將15nm的MgO顆粒加入到PEO-LiBF4固態電解質中,發現在溫度從0℃升至100℃時,PEO-LiBF4(8∶1)-MgO(20%)復合電解質的離子電導率從4.0×10-6S/cm提高到7.9×10-4S/cm,其中在20℃時,可以得到2.8×10-5S/cm 的離子電導率,同時也提出體系中的[O]與[Li]之比會影響固態電解質的離子電導率。Banitaba 等[54]采用靜電紡絲技術,分別將TiO2和ZnO 納米纖維加入PEO-LiClO4中,并在體系中加入EC作為增塑劑,所得復合纖維形貌如圖12(b)所示。實驗研究了兩種納米纖維占比分別為0.07%、0.21%和0.35%時,復合固態電解質的電化學性能,發現在300~315K 溫度范圍內,溫度越高,復合固態電解質電導率越高。TiO2和ZnO 摻雜量為0.21%時,復合纖維離子電導率最高,分別為0.045mS/cm 和0.035mS/cm,這表明納米纖維結構對于提高固態電解質離子電導率具有重要作用。同年,Banitaba 等[55]再次采用靜電紡絲技術,研究了SiO2和Al2O3納米纖維對于PEO-LiClO4-EC固態電解質離子電導率的影響,在溫度為300~315 K下,分別獲得0.033mS/cm和0.059mS/cm的離子電導率。

圖12 PEO上原位生長SiO2納米顆粒示意圖[51]、TiO2和ZnO納米纖維SEM圖[54]及PEO/AgSCN/SiO2復合固態電解質室溫離子電導率隨SiO2加入量的變化[68]
惰性無機陶瓷填料的添加可以在一定程度上提高PEO固態聚合物電解質的離子電導率,但當其加入量達到一定值時,隨著加入量的提高,離子電導率反而呈現下降趨勢。如圖12(c)所示,Sekhon等[68]將SiO2納米顆粒添加入PEO-AgSCN聚合物基體中,組成的復合固態電解質在SiO2加入量達到20%時,最高具有3×10-5S/cm的室溫離子電導率,遠高于純PEO固態聚合物電解質的室溫離子電導率,但當加入量超過20%時,室溫離子電導率出現下降,可能是由于SiO2納米顆粒出現了團聚現象,阻礙了鋰離子在PEO 內部的遷移。Sugumaran 等[56]將ZrO2顆粒加入到PEO-LiCF3SO3固態電解質中,并加入聚乙二醇PEG 作為增塑劑。實驗結果表明,3%的ZrO2可以使復合固態電解質獲得5.24×10-3S/cm的室溫離子電導率,但是高于3%時,出現離子電導率下降的現象。
3.2.2 離子導體無機陶瓷填料
在離子導體無機陶瓷填料中,氧化物基固態電解質具有較為優異的化學與電化學穩定性。研究氧化物基固態電解質作為填料與PEO 固態聚合物電解質的復合,構造PEO-氧化物基復合固態電解質,是改善固態電解質離子電導率的重要研究方向。
3.2.2.1 PEO-氧化物基復合固態電解質
NASICON 型和鈣鈦礦型固態電解質內部具有豐富的鋰離子遷移位點,有利于形成鋰離子傳輸網絡,同時其組分不與空氣中的水等成分發生化學反應,在空氣中穩定性良好[69],這使得NASICON 型、鈣鈦礦型固態電解質與PEO 組成的復合固態電解質,具有較高的離子電導率和優異的電化學穩定性。Wu等[70]研發出一種新型NASICON 氧化物固體材料LiZr2(PO4)3,將其加入[EO]/[Li+]為10 的PEOLiTFSI 固態電解質中,在30℃下獲得1.2×10-4S/cm的高離子電導率。同時,LiZr2(PO4)3可以與負極鋰發生原位反應生成穩定的固體電解質界面膜(SEI膜),降低電極與電解質界面電阻。Liu等[71]合成出三維立體結構的PEO/PEO-LLTO/PEO 固態電解質,該結構避免了LLTO 與金屬鋰負極的直接接觸,實現1.6×10-4S/cm 的室溫離子電導率。這種復合固態電解質與鋰組裝的對稱電池循環400h 后仍沒有短路,組成的Li/復合固態電解質/LiFePO4在2C 的放電倍率下仍能達到135.0mA·h/g 的容量,展現出優異的循環穩定性和電化學穩定性。
雖然PEO-NASICON 型或鈣鈦礦型復合固態電解質具有上述優點,但存在Ti4+還原問題[74]。金屬Li具有較強的還原性,當含有Ti4+的鈣鈦礦型LLTO或NASICON型LATP與金屬鋰接觸時,處于高價態的Ti4+很容易被還原為Ti3+或Ti2+,價態的降低會帶來晶格結構的惡化,使內部鋰離子的傳輸通道發生改變,導致鋰離子的傳輸能力下降,離子電導率降低。目前,解決方案主要是通過在固態電解質與鋰金屬負極之間添加包覆層,抑制Ti4+與鋰金屬的接觸,從而限制其還原。Liu 等[72]采用原子層沉積,在NASICON 型固態電解質LATP 表面涂覆Al2O3包覆層,如圖13(a)所示。LATP/Al2O3表面的Ti價態分布圖[圖13(b)]證實,Al2O3包覆LATP后,Ti3+的特征譜峰僅存在于0~16nm 范圍內。Ti4+的特征譜峰在16nm處被檢測到,小于未包覆Al2O3的LATP中Ti4+特征譜峰的檢測深度,表明Ti4+的還原已經被抑制。除此之外,NASICON 型或鈣鈦礦型固態電解質晶粒之間排列紊亂,取向不規則,從而使相鄰晶粒之間鋰離子傳輸通道存在錯配,鋰離子在晶界處遷移活化能較高,導致晶界電阻大[75-76]。針對此問題,可以從固態電解質制備方法出發,控制晶粒大小,保證優異的電化學性能,如通過使用高溫燒結制備LATP,可以在一定程度上降低晶界電阻,改善其電化學性能[77]。
石榴石型固態電解質LLZO 具有較低的晶內電阻和晶界電阻,可實現鋰離子在晶粒間的快速傳輸;LLZO 組分中不含氧化性強的元素,所以不易被金屬鋰還原,對金屬鋰穩定性好[77];LLZO具有較大的電化學窗口[15],可與高壓正極相配合。Zhang等[44]提出了將立方相石榴石構型的Li6.4La3Zr1.4Ta0.6O12(LLZTO)與PEO 混合制備復合固態電解質,電化學性能優于摻入鋰鹽LiTFSI 的PEO-LLZTO。此種無鋰鹽的PEO-LLZTO 復合固態電解質可以在30℃下實現2.1×10-4S/cm 的離子電導率,電化學窗口高于4.7V,鋰離子遷移數可達0.46。Fu等[21]首次提出了一種基于石榴石構型Li6.4La3Zr2Al0.2O12(LLZO)鋰離子導體的三維導電陶瓷網絡,如圖13(c)所示。這種三維網絡結構以摻入LiTFSI 的PEO 為基體,可以提供連續的鋰離子傳輸通道,在室溫下可以實現2.5×10-4S/cm的高離子電導率。
雖然石榴石型固態電解質具有優異的電化學性能,但是其對水分、CO2敏感,暴露于空氣中,表面會形成Li2CO3鈍化層,導致與金屬鋰之間界面電阻增大。有報道稱厚度為10~100nm 的Li2CO3層可將界面電阻提高一個數量級[78]。針對Li2CO3鈍化層問題,可以通過在石榴石型固態電解質表面涂覆液態金屬等包覆層、酸洗以及在其與金屬鋰負極表面包覆MnO2、Co3O4、SnO2等親鋰性材料的方法,實現鈍化層的碎裂、清除。Meng等[73]通過在石榴石型LLZO 表面涂覆液態金屬Ga,使其在空氣中形成Ga2O3層[圖13(d)],實現LLZO 與金屬鋰的良好潤濕性。同時液態金屬的滲透,使得LLZO 表面的Li2CO3鈍化層碎裂,減小鈍化層對鋰離子傳輸的阻礙作用,鋰化的液態金屬也成為了良好的鋰離子傳輸載體。如圖13(e)所示,形成的全固態鋰離子電池在60℃、0.15mA/cm2的電流密度下循環440 圈,仍保持著130mA·h/g 的高比容量和近100%的庫侖效率。
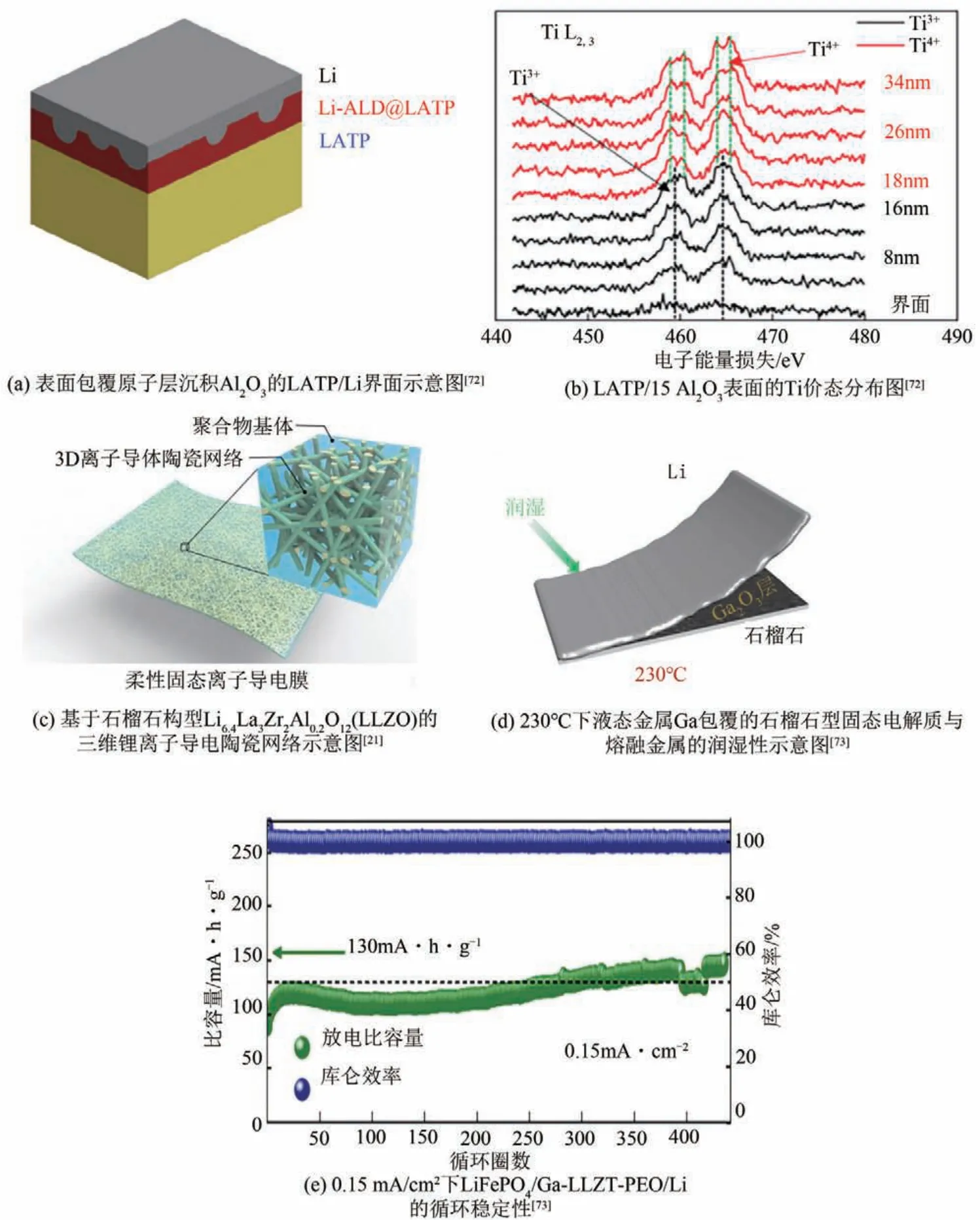
圖13 表面包覆原子層沉積Al2O3的LATP/Li界面示意圖[72]、LATP/15 Al2O3表面的Ti價態分布圖[72]、基于石榴石構型Li6.4La3Zr2Al0.2O12(LLZO)的三維鋰離子導電陶瓷網絡示意圖[21]、230℃下液態金屬Ga包覆的石榴石型固態電解質與熔融金屬的潤濕性示意圖[73]及0.15 mA/cm2下LiFePO4/Ga-LLZT-PEO/Li的循環穩定性[73]
3.2.2.2 PEO-氧化物基復合固態電解質鋰離子傳導機理
將氧化物基固態電解質加入到PEO/鋰鹽中,形成復合固態電解質,可以提高離子電導率,究其原因,可以歸納為以下幾點[79-80]:
(1)PEO 中鋰離子的傳輸大都發生在其非晶區,氧化物基陶瓷材料的加入降低PEO的結晶度,對鋰離子的遷移起到促進作用;
(2)氧化物基固態電解質材料可形成滲透網絡,為鋰離子的快速遷移提供新的通道;
(3)提供可導鋰離子的無機物/PEO 界面,拓寬鋰離子的遷移通道。
鋰離子在PEO-氧化物基復合固態電解質中的傳導機理,可歸納為以下幾點:
(1)在PEO 基體中傳導,包括PEO 鏈內遷移和PEO鏈間遷移[42];
(2)通過氧化物基固態電解質內部進行傳導;
(3)在PEO 和氧化物基固態電解質之間的界面上進行傳導。
研究石榴石型、NASICON 型或鈣鈦礦型氧化物基固態電解質與PEO 復合而成的固態電解質內部鋰離子傳導機理,需要依靠特定的表征技術。固態鋰核磁共振波譜目前被認為是研究鋰離子所處的局部結構環境和動力學的有力工具。
對于PEO-石榴石型氧化物基復合固態電解質來說,可以構建6Li/PEO-LiClO4- Li7La3Zr2O12/6Li 來研究鋰離子傳輸路徑。金屬鋰負極中的鋰采用6Li標記,復合固態電解質中的鋰采用7Li 進行標記。發生電化學反應時,負極中的6Li 會經過固態電解質內部取代7Li。通過檢測6Li 的核磁共振波譜,可得到6Li 的位置,從而推斷鋰離子的遷移路徑。6Li的交叉極化核磁共振譜圖如圖14(a)所示[81]。
從圖14(a)中可以看出,譜圖可以拆分為三種類型的譜峰,分別對應LLZO 中的鋰離子、LLZO 與PEO 界面上的鋰離子以及鋰鹽LiClO4中的鋰離子。從各個譜峰占比情況可知,在遷移過程中,大部分的鋰離子存在于LLZO 中,其次是鋰鹽LiClO4中,最后是LLZO與PEO界面上。界面上的鋰離子的譜峰比其余兩個峰要寬得多,說明界面處鋰離子分布更加無序。將組裝好的6Li/PEO-LiClO4-LLZO/6Li對稱電池進行充放電循環,并對循環前后電池進行交叉極化核磁共振譜測試,結果如圖14(b)[81]所示,可以發現,LLZO 譜峰明顯增強,而其余兩個位置的峰在循環后變化不明顯,證實鋰離子在PEOLiClO4-LLZO 固態電解質中主要是沿著LLZO 內部進行遷移。
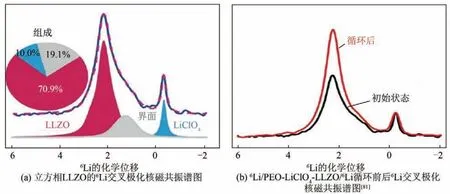
圖14 交叉極化核磁共振譜圖[81]
鋰離子在PEO-NASICON型復合固態電解質中的傳導機理,可通過研究PEO-LiTFSI-Li1.3Al0.3Ti1.7(PO4)3復合固態電解質的相關電化學性質來確定。
對PEO-LiTFSI-Li1.3Al0.3Ti1.7(PO4)3復合固態電解質進行交叉極化核磁共振譜測試,其中鋰離子被標記為7Li,結果如圖15(a)~(c)所示。圖15(a)[82]說明在室溫下LATP內部存在兩種位置的鋰離子,圖15(b)和(c)[82]為室溫下PEO/LATP 和PEO-LiTFSI/LATP的7Li 核磁共振譜圖。對比圖15(a)和(b)可以發現,室溫下PEO/LATP 的室溫7Li 核磁共振譜與LATP 譜圖非常相似,說明在PEO/LATP 體系中,PEO的加入對于鋰離子位置的影響不大,鋰離子主要位于LATP 組成的滲透網絡中。而圖15(c)中出現新的譜峰3,對比圖15(b)可知,譜峰3來自于加入的鋰鹽LiTFSI。
對于PEO-鈣鈦礦型復合固態電解質,有報告采用6Li 作為對稱電極組成6Li/PEO-LiTFSILGSM/6Li,通過固態鋰核磁共振研究鈣鈦礦型La0.8Sr0.2Ga0.8Mg0.2O2.55(LGSM)的鋰離子傳導機理,結果如圖15(d)[83]所示。其中綠色區域代表復合固態電解質中可以自由移動的鋰離子,紅色區域代表與PEO的醚氧配位的鋰離子。在循環之后,可以明顯看出綠色區域面積有所下降,證明固態電解質中更多自由移動的7Li被6Li取代,鋰離子更傾向于在基體內部自由移動,而不是在PEO鏈內或鏈間跳躍,同時LiTFSI 的加入也帶來更高密度的鋰離子及氧空位,可以提高復合固態電解質電導率。通過密度泛函理論計算發現,鋰鹽陰離子與LGSM相的氧空位結合,釋放出Li+,提高復合固態電解質內部自由移動的鋰離子濃度,改變鋰離子的分布。

圖15 魔角旋轉核磁共振波譜圖[81-83]
通過使用固態鋰核磁共振波譜技術,對常見的PEO-石榴石型、NASICON 型或鈣鈦礦型復合固態電解質內部鋰離子傳輸路徑分析得出,鋰離子主要在氧化物基固態電解質內部傳輸,部分也通過與PEO的醚氧相配位的方式實現離子傳輸,但是在氧化物基固態電解質與PEO 界面上進行傳輸的證據尚不充分。
鑒于上述討論,離子導體無機陶瓷填料加入PEO 固態聚合物電解質后,除了會與PEO 和鋰鹽作用,降低PEO 結晶度外,更重要的是可以提供自由移動的鋰離子,增大鋰離子遷移數。未來,進一步研究鋰離子在復合固態電解質內部的傳輸機理,構建一維納米線、二維層狀結構、三維網絡結構或其他可提供連續鋰離子傳輸通道的特殊結構,設計可以快速傳輸鋰離子的界面緩沖層以改善固態電解質與電極界面接觸性,是PEO-氧化物基復合固態電解質發展的重要方向。
3.3 制備聚合物共混物
受限于PEO 的鏈段運動,在只有PEO 存在的條件下,鋰離子電導率較低,而PEO 固態聚合物電解質的非晶區所占比例越大,傳輸鋰離子能力越強。因此可通過向PEO中添加其他種類的聚合物,制備PEO 基聚合物共混物固態電解質,降低PEO的結晶度,提高PEO 固態聚合物電解質的離子電導率。
聚合物共混物的制備主要集中于尋找最佳聚合物組合及其與鋰鹽的最佳搭配。PEO基聚合物共混物固態電解質性能見表2。
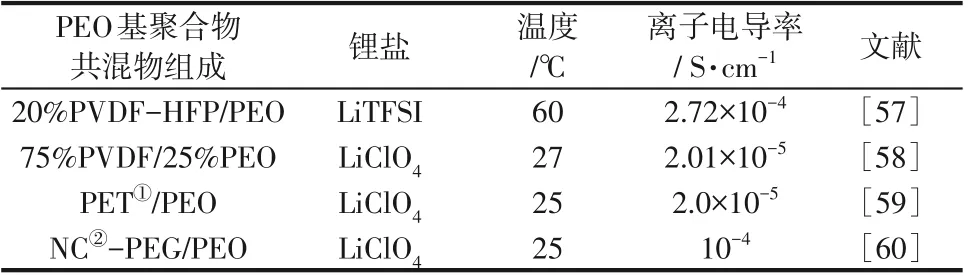
表2 PEO基聚合物共混物固態電解質性能
3.4 構造嵌段共聚物
不同于聚合物共混物,嵌段共聚物是通過某種工藝,將兩種或兩種以上性質不同的聚合物鏈段連在一起,制備而成的特殊聚合物,同樣可使PEO結晶度降低,增加其非晶區比例,提高離子電導率。
基于以上機理,嵌段共聚物的構造也吸引了不少科研工作者研究,并取得了一定的成果。目前部分已報道的PEO 基嵌段共聚物固態電解質性能見表3。

表3 PEO基嵌段共聚物固態電解質性能
根據上述分析,PEO固態聚合物電解質在室溫下離子電導率較低,尚未達到固態電解質商業化應用要求。現將PEO 固態聚合物電解質離子電導率改善方案匯總于表4。
表4中涉及的方案,均通過降低PEO結晶度的方式,提高固態電解質的離子電導率。除此之外,離子導體無機陶瓷填料的添加,還可以提供額外的鋰源,進一步提高PEO 固態聚合物電解質的離子電導率。未來,仍需進一步研發新的、具有特殊結構的填料,這有助于固態電解質離子電導率的提高。
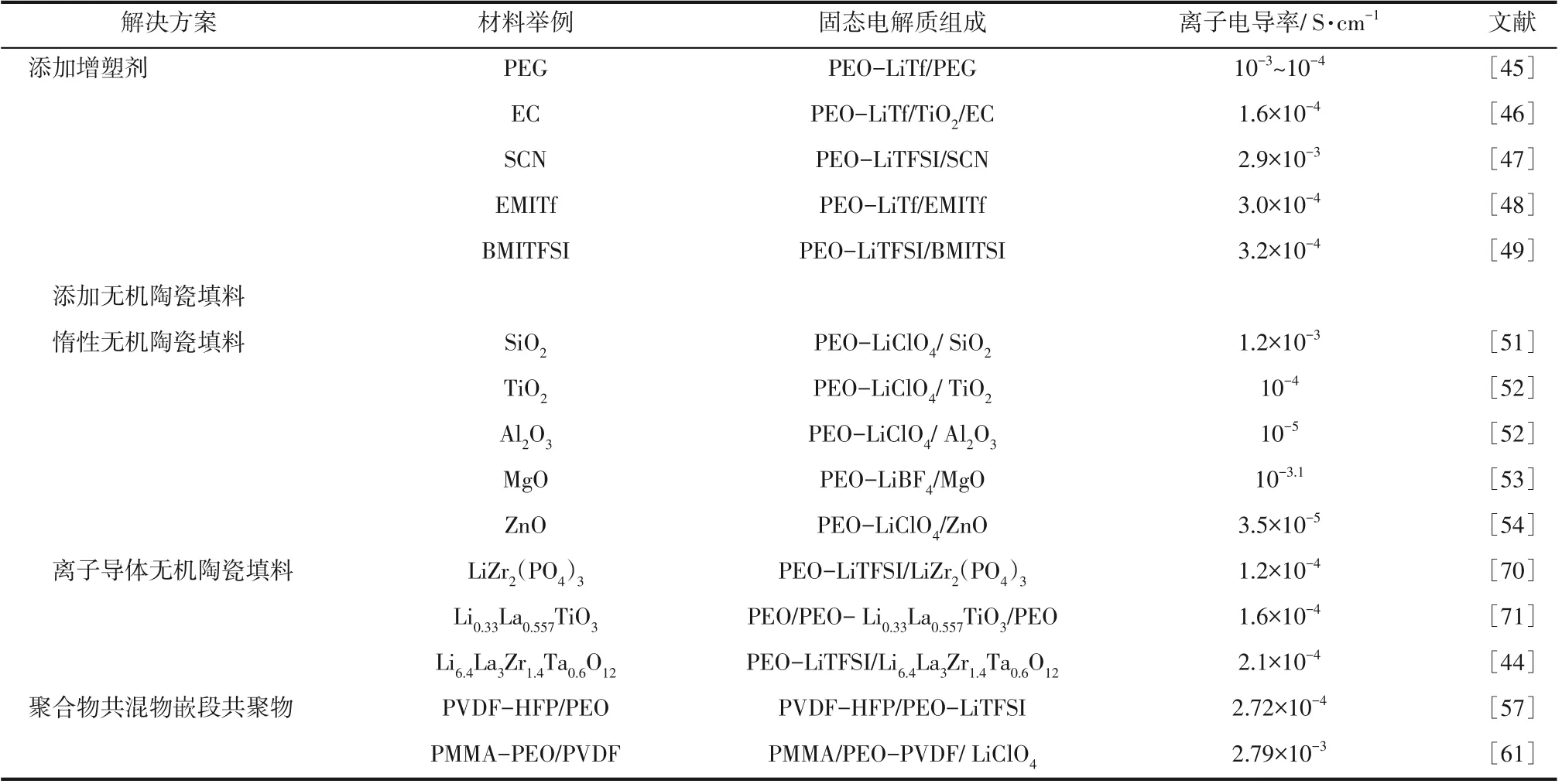
表4 PEO基固態聚合物電解質離子電導率改善方案匯總
4 結語
固態電解質是全固態鋰離子電池的核心,制備具有寬電化學窗口、高離子電導率、低電極/固態電解質界面接觸電阻和高鋰離子遷移數的固態電解質具有重要意義。本文從正負極與固態電解質的界面以及固態電解質離子電導率入手,綜述了全固態鋰離子電池存在的主要問題以及已有的解決方案。重點闡述了PEO 固態聚合物電解質的基本結構、改性方法,以及PEO-氧化物基固態電解質的導電機理。
全固態鋰離子電池在實際應用過程中,仍需要進一步研究以下問題。
(1) 特殊結構正極材料的構建。解決正極與固態電解質界面問題,可以從正極材料入手。結構決定性能,高鋰離子遷移數的正極要求材料內部有一定量的鋰離子附著位點和連續的傳輸通道,如何通過制備技術,制備具有特殊結構的正極材料,增加電化學反應位點,從而實現正極的高鋰離子電導率、低鋰離子活化能,是未來研究的重點之一。
(2) 負極與固態電解質界面層的設計。在負極一側,研發具有高鋰離子電導率和高鋰離子遷移數的界面層,促進鋰離子快速遷移,從而抑制鋰枝晶的的產生與生長,如添加鋰合金界面層、聚合物柔性界面層或者人工固態電解質界面層,綜合考量界面層的安全性、厚度和導電性。
(3) 相界面問題。相界面包括固態電解質內部相與相之間,以及電極與固態電解質之間的界面,是影響鋰離子傳輸的關鍵因素之一。相界面阻抗應盡可能低,以降低鋰離子在相界面之間傳輸的障礙。研究相界面上鋰離子傳輸機理對于實現低界面阻抗具有重要意義。可通過原位測量、固體核磁共振、中子衍射、同步輻射X 射線技術、高分辨TEM、盧瑟福背散射光譜、操作性X射線技術、視覺圖像技術等表征技術,結合第一性原理計算、DFT與分子動力學、有限元模擬等理論計算模擬方法,對界面上鋰離子所處的環境以及傳輸路徑等做更深層次的分析,為固態電解質材料的選取和結構的設計提供理論依據。
(4) 高鋰離子電導率的復合固態電解質的構建。對于復合固態電解質中的無機固態電解質填料來說,在優化已研發的無機固態電解質的尺寸、濃度和形貌的基礎上,尋找新的納米填料,研究新的形貌,如定向1D 結構、2D 納米片狀結構或3D 多孔結構,以構建互連的鋰離子傳輸網絡,同時增強無機固態電解質在聚合物基體中的分散性,是提高復合固態電解質離子電導率的一個重要手段。對于復合固態電解質中的聚合物基體來說,設計高度交聯結構或支鏈結構、引入單離子導體、降低玻璃化轉變溫度Tg均為提高聚合物基體電導率的方式。同時,尋找聚合物基體與無機固態電解質填料的最佳配比,使有機、無機組分協同作用最大化,實現復合固態電解質的高離子電導率。
(5) 微觀結構設計。固態電解質的微觀結構決定了其性能,通過建模和實驗建立固態電解質微觀結構和電化學性能之間的構效關系,可對固態電解質結構進行有效調控。合適的力學性能是實現電極與固態電解質良好接觸的保障,建立固態電解質力學性能和電化學性能的關系也具有研究意義。
(6) 性能評價體系的建立。關于全固態鋰離子電池的鋰離子電導率、鋰離子遷移數、電化學窗口、能量密度以及循環穩定性等指標標準的評價體系還需要建立與完善,以滿足實際應用要求,推動全固態鋰離子電池向中型或大型應用規模方向發展。
(7) 發展輕量化固態電解質。作為新一代實用型能量儲存與轉換裝置,鋰離子電池應該具備高能量密度、高安全性的特點,這需要進一步研發更輕薄、更安全的固態電解質,可以考慮通過濺射、流延和3D打印等技術來實現這一目標。

