miR-190通過調(diào)控細胞因子信號轉(zhuǎn)導(dǎo)抑制因子5促進肝細胞癌發(fā)生的機制
王運九 孫健 李玲霞 郭金虎 張玨

【關(guān)鍵詞】肝細胞癌;微核糖核酸-190;細胞因子信號轉(zhuǎn)導(dǎo)抑制因子5;增殖
肝細胞癌(HCC)是全球最常見的惡性腫瘤之一,也是導(dǎo)致癌癥死亡的第二大原因,占原發(fā)性肝癌的80%,嚴重威脅人類健康[1-2]。隨著對HCC分子生物學(xué)研究的不斷深入,已鑒定出與該疾病有關(guān)的不同基因和途徑。為了更好地理解HCC發(fā)生、發(fā)展的分子機制,亟待發(fā)現(xiàn)更精準(zhǔn)的預(yù)后標(biāo)志物及有效的治療策略。張春艷等(2016年)認為作為一類非編碼單鏈RNA分子,微RNA(miR)與肝癌的發(fā)生、發(fā)展過程密切相關(guān)。miR-144的高表達可明顯抑制裸鼠肝癌形成[3]。近期研究表明,miR-190可以通過抑制ZEB2的表達來抑制膠質(zhì)瘤細胞的生長和遷移[4]。然而,miR-190在HCC中的表達、潛在作用和機制仍不清楚。本研究探討miR-190通過調(diào)控細胞因子信號轉(zhuǎn)導(dǎo)抑制因子5(SOCS5)參與HCC發(fā)生與發(fā)展過程的關(guān)鍵作用與機制。
材料與方法
一、研究對象
選取2019年5月至2019年12月在上海中醫(yī)藥大學(xué)附屬曙光醫(yī)院接受手術(shù)切除且病理確診為HCC的患者84例,其中男58例、女26例,年齡(63±5)歲。收集HCC癌組織及對應(yīng)的癌旁組織(距腫瘤邊緣≥2cm)。患者均簽署知情同意書,研究方案經(jīng)上海中醫(yī)藥大學(xué)附屬曙光醫(yī)院倫理委員會審核通過。
二、細胞、動物及主要試劑
SNU398和HepG2細胞均購于中國科學(xué)院上海細胞研究所。24只雌性無胸腺裸鼠,4~6周齡,購自中國醫(yī)學(xué)科學(xué)院實驗動物中心。SOCS5、β-actin抗體購自Sigma公司;miR-190模擬物/抑制物和Dharmafect1購自Dharmacon公司;靶向SOCS5的psiCHECK-2載體購自上海聯(lián)邁生物工程有限公司;Lipofectamine3000轉(zhuǎn)染試劑、TRIzol試劑、miR定量試劑盒購自ThermoFisherScientific公司;Transwell小室購自Corning公司;Mgteigel基質(zhì)膠購自BD公司。
三、細胞培養(yǎng)與轉(zhuǎn)染
SNU398和HepG2細胞分別用含10%胎牛血清、100U/ml青霉素、100μg/ml鏈霉素的RPMI1640或DMEM培養(yǎng)基于5%CO2、37°C恒溫培養(yǎng)箱中培養(yǎng)。在轉(zhuǎn)染前將細胞接種于12孔板中,待細胞達到每孔150000個細胞的密度時,根據(jù)說明書將miR-190模擬物/抑制物或SOCS5siRNA(siSOCS5)及各自的陰性對照(模擬物NC/抑制物NC或siNC)分別用Dharmafect1和Lipofectamine3000轉(zhuǎn)染至細胞。
四、細胞活力
根據(jù)細胞計數(shù)試劑盒(CCK-8)說明書測定細胞活力。將轉(zhuǎn)染細胞按1×103個/孔接種于96孔板,每孔加入10μlCCK-8溶液,在37℃下孵育2h。用酶標(biāo)儀檢測450nm波長下細胞的吸光度。
五、Transwell侵襲與遷移實驗
取100μl基質(zhì)膠稀釋液鋪于Transwell小室上室,含胎牛血清的常規(guī)培養(yǎng)基加入下室,細胞置于37℃、5%CO2培養(yǎng)箱內(nèi)繼續(xù)培養(yǎng)24h。擦去上室細胞與基質(zhì)膠,4%多聚甲醛固定,1%結(jié)晶紫染色,顯微鏡下觀察并計算侵襲細胞數(shù)。遷移實驗無需鋪膠,其余操作同侵襲實驗。
六、裸鼠異種移植腫瘤
于裸鼠腹側(cè)皮下接種1.5×106個用siNC或siSOCS5轉(zhuǎn)染的SNU398或HepG2細胞。對腫瘤生長進行長達18d的監(jiān)測,并通過以下公式計算腫瘤體積:體積=(L×W2)/2,其中L為腫瘤的長度,W為腫瘤的寬度。
七、RNA提取和實時熒光定量PCR(RT-PCR)
采用TRIzol法提取HCC組織、癌旁組織、轉(zhuǎn)染后的SNU398或HepG2細胞中的總RNA。根據(jù)miR逆轉(zhuǎn)錄試劑盒說明書進行逆轉(zhuǎn)錄,隨后,使用7900HT快速實時PCR系統(tǒng)(ThermoFisherScientific)進行RT-PCR。miR-190以U6為內(nèi)參,SOCS5以β-actin為內(nèi)參,采用2-ΔΔCt方法計算結(jié)果。引物序列見表1。
八、蛋白免疫印跡法
利用RIPA裂解液提取細胞蛋白,并用Bradford法測定蛋白質(zhì)濃度。將10μg總蛋白上樣后,進行SDS-PAGE電泳,并轉(zhuǎn)移至PVDF膜上。封閉2h后,加入SOCS5抗體(1∶1000)或β-actin抗體(1∶2000),4℃孵育過夜。TBST沖洗3次后,加入二抗,室溫孵育lh,洗膜后用ECL化學(xué)發(fā)光試劑盒顯影。
九、熒光素酶測定
構(gòu)建野生型和突變型基因靶點SOCS5的3′UTR-熒光素酶表達載體(SOCS5-Wt和SOCS5-Mut),使用Lipofectamine3000將其與miR-190模擬物和陰性對照同時分別轉(zhuǎn)染。轉(zhuǎn)染72h后,使用雙熒光素酶報告系統(tǒng)(上海吉馬生物制藥有限公司)連續(xù)測量螢火蟲-海腎熒光素酶的活性。
十、統(tǒng)計學(xué)處理
應(yīng)用GraphPadPrism8.0分析數(shù)據(jù),正態(tài)分布定量資料以表示,定性資料以例表示。采用配對t檢驗分析癌組織和癌旁組織間的差異,獨立樣本t檢驗分析體外定量數(shù)據(jù),兩因素重復(fù)測量方差分析轉(zhuǎn)染時間與分組間的差異,χ2檢驗分析miR-190表達與臨床特征的關(guān)系。生存曲線采用Kaplan-Meier法,log-rank檢驗進行比較。α=0.05。
結(jié)果
一、miR-190是HCC中潛在的癌基因
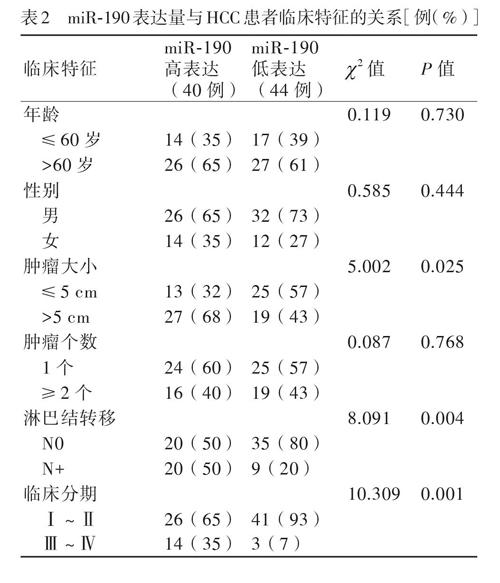
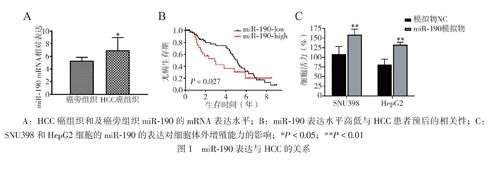
與來自同一HCC患者的癌旁組織相比,HCC癌組織中miR-190水平上調(diào)(t=6.849,P<0.001,圖1A)。將84例HCC組織以miR-190的中位表達水平分為高表達組(>中位數(shù),40例)和低表達組(≤中位數(shù),44例),分析miR-190的表達量與HCC患者臨床特征的關(guān)系。結(jié)果顯示,miR-190的表達量與腫瘤大小、淋巴結(jié)轉(zhuǎn)移和臨床分期有關(guān)(P均<0.05),見表2。
miR的高水平與HCC患者的預(yù)后不良有關(guān)(HR=0.656,95%CI0.352~0.933,P=0.027,圖1B)。miR-190的過表達提高SNU398和HepG2細胞的體外增殖能力(t=4.465,P<0.001;t=2.824,P=0.005,圖1C)。
二、下調(diào)miR-190的表達抑制肝癌細胞侵襲及遷移能力
下調(diào)miR-190處理SNU398和HepG2肝癌細胞后,發(fā)現(xiàn)下調(diào)miR-190的表達抑制了肝癌細胞的侵襲(t=13.120,P<0.001;t=7.398,P=0.002)及遷移能力(t=5.587,P=0.005;t=4.082,P=0.015),見圖2。
三、miR-190直接靶向SOCS5
借助生物信息學(xué)數(shù)據(jù)庫StarBase3.0對miR-190的靶基因進行預(yù)測,發(fā)現(xiàn)SOCS5可能是miR190的潛在靶點(圖3A)。為了驗證該假設(shè),我們通過RT-PCR和蛋白免疫印跡法檢測了miR-190對SOCS5轉(zhuǎn)錄和蛋白質(zhì)水平的影響。結(jié)果顯示,miR-190的過表達導(dǎo)致SNU398和HepG2細胞中SOCS5mRNA(t=3.212,P=0.033;t=3.597,P=0.023,圖3B)和蛋白(t=2.895,P=0.044;t=2.813,P=0.048,圖3D)表達減少,而抑制miR-190導(dǎo)致SOCS5mRNA(t=8.249,P=0.001;t=3.865,P=0.018,圖3C)和蛋白表達(t=3.098,P=0.036;t=8.835,P=0.001,圖3E)的增加。
當(dāng)miR-190與SOCS5-Wt共同轉(zhuǎn)染到SNU398細胞中時,熒光素酶活性下降(t=5.983,P=0.004),SOCS53UTR結(jié)構(gòu)中的點突變可消除這種效應(yīng)(t=0.676,P=0.536,圖3F)。在HepG2細胞中也獲得了類似的結(jié)果(圖3G)。
四、SOCS5是HCC的腫瘤抑制因子
靶向siRNA可有效下調(diào)SNU398和HepG2細胞中的SOCS5水平(t=3.342,P=0.028;t=9.887,P=0.001,圖4A)。
在體外,兩因素重復(fù)測量方差分析顯示SNU398和HepG2細胞的增殖隨時間變化呈上升趨勢(F時間=277.7和233.3,P均<0.001,圖4B),siSOCS5組增殖能力高于siNC組(F組間=36.6和34.2,P均<0.001),分組與時間有交互效應(yīng)(F=15.4和9.656,P均<0.001)。此外,轉(zhuǎn)染siSOCS5的細胞遷移(t=2.946,P=0.042;t=7.258,P=0.002)和侵襲能力(t=2.876,P=0.045;t=8.764,P=0.001)均增強(圖4C)。我們在異種移植腫瘤模型中進一步評估了SOCS5基因敲除對HCC細胞腫瘤發(fā)展過程中的作用。與陰性對照相比,SOCS5基因敲除導(dǎo)致SNU398和HepG2細胞的異種移植腫瘤體積(t=2.829,P=0.047)和質(zhì)量(t=7.635,P=0.002)增加(圖4D)。
討論
Xue等(2016年)研究顯示,HCC是癌癥相關(guān)死亡的第二大原因,分子異質(zhì)性的存在和生物標(biāo)志物的缺失可導(dǎo)致晚期患者預(yù)后不良,從而影響癌癥的治療效果。因此,尋找預(yù)后標(biāo)志物及新的分子靶點是該疾病面臨的主要挑戰(zhàn)之一。miR在腫瘤分類和預(yù)后方面發(fā)揮重要作用,其異常的表達可作為肝癌的標(biāo)志。近年來,大量研究在肝癌中發(fā)現(xiàn)了與肝癌風(fēng)險增加、腫瘤發(fā)生發(fā)展、晚期和血管浸潤相關(guān)的miR信號,并將miR作為治療靶標(biāo)[1,3]。
有研究顯示在侵襲性神經(jīng)母細胞瘤和前列腺癌中miR-190表達減少,而在快速生長的腫瘤中其過度表達會抑制腫瘤生長和轉(zhuǎn)移,miR-190還調(diào)節(jié)上皮間質(zhì)轉(zhuǎn)化抑制乳腺癌轉(zhuǎn)移[5]。相反,Jia等(2016年)研究顯示miR-190在胃癌組織中表達上調(diào),并促進胃癌的進展。這提示miR-190可能在不同的腫瘤環(huán)境和腫瘤發(fā)展的不同階段發(fā)揮不同的作用。而關(guān)于miR-190在肝癌中的作用的研究目前較少,如Hung等(2014年)發(fā)現(xiàn)miR-190b的上調(diào)對誘導(dǎo)人HCC胰島素抵抗的IGF-1降低起作用。本研究首先發(fā)現(xiàn)miR-190在HCC腫瘤中上調(diào),且miR-190高表達與HCC患者的不良預(yù)后有關(guān),提示其可能在HCC發(fā)展過程中起促進作用。此外,我們檢測了miR-190過表達對HCC細胞生長的影響,結(jié)果發(fā)現(xiàn)miR-190過表達能促進細胞增殖,而下調(diào)miR-190抑制了肝癌細胞的侵襲及遷移能力,表明miR-190通過促進HCC細胞增殖、侵襲和遷移等來發(fā)揮其促癌作用。這些結(jié)果與在胃癌中的觀察結(jié)果相一致。
當(dāng)miR-190過表達時,SOCS5在HCC細胞系中下調(diào),由此我們推測SOCS5是miR-190的潛在靶點。SOCS5在人類癌癥中的作用已被研究,在前列腺癌和肝癌中已經(jīng)檢測到SOCS5的下調(diào)[6]。據(jù)報道,抑制miR-18a-5p促進SOCS5而誘導(dǎo)骨肉瘤細胞凋亡[7]。隨后,我們使用熒光素酶檢測法證明了它確實是miR-190的靶點,同時,miR-190還能調(diào)節(jié)其轉(zhuǎn)錄和蛋白水平。有趣的是,SOCS基因是JAK/STAT通路中負反饋回路的一部分[8]。眾所周知,JAK/STAT途徑可激活細胞的增殖、遷移、分化、凋亡以及抑制劑的失調(diào),導(dǎo)致包括肝癌在內(nèi)的人類疾病[9]。Yuan等[10]研究發(fā)現(xiàn),miR-30a靶向SOCS-1,并通過JAK/STAT信號通路抑制膿毒癥大鼠的肝細胞增殖和促進細胞凋亡。Wang等[11]發(fā)現(xiàn)了板藍根多糖通過激活JAK/STAT信號通路來發(fā)揮對HBV的體外抗病毒作用。考慮到目前SOCS5與肝癌的相關(guān)研究較少,我們進行了額外實驗來驗證SOCS5在肝癌中的作用,結(jié)果證明了SOCS5在體內(nèi)和體外都可作為HCC的腫瘤抑制因子。以上結(jié)果表明,在HCC中,由miR-190介導(dǎo)的SOCS5下調(diào)將導(dǎo)致JAK/STAT通路的激活,進而促進細胞增殖、侵襲和遷移。有研究報道m(xù)iR-885-5p上調(diào)通過靶向抑制SOCS5促進大腸癌細胞增殖和遷移,我們的研究結(jié)果與其一致[12]。
綜上所述,我們驗證了細胞因子家族抑制因子之一的SOCS5作為miR-190在肝癌中的真實靶點,并證明了SOCS5在肝癌中的抑瘤作用。此外,我們強調(diào)了miR190的抑制作用在恢復(fù)SOCS5水平方面的潛在用途,從而降低肝癌細胞的致瘤特性。這項研究強調(diào)了miR-190在肝癌研究中的重要性,不僅是作為潛在的生物標(biāo)志物,而且有可能成為待開發(fā)潛在藥物的新的分子靶標(biāo)。

