基于3D Slicer軟件鞍底重建在經鼻蝶垂體瘤切除術中的指導意義
師忠杰,李玉魁,高鑫,周立偉,朱宏偉,譚國偉,王占祥
垂體腺瘤是神經外科比較常見的神經內分泌腫瘤,目前外科治療的方法主要包括內鏡和顯微鏡下經鼻蝶入路病灶切除和傳統顯微鏡下開顱病灶切除術;手術目的是到達鞍區并切除鞍區病變結構,緩解腫瘤等對視路結構、垂體、垂體柄等周圍結構的壓迫[1-2]。其中,相比傳統的顯微鏡下開顱手術,內鏡下經鼻蝶手術入路有許多優點,內鏡可提供一個全景手術野,具有良好的照明和放大效果,縮短患者的住院時間,減少術后并發癥等[3]。同時,帶角度的內鏡實現了病變側方術野的可視性,在探查海綿竇內側壁時,無需過多的分離和牽拉即可實現。近年來隨著影像學技術的不斷提高,可以從形態結構、質地等不同角度了解腫瘤性質,為臨床治療提供更多有價值的信息[4-5]。本研究對廈門大學附屬第一醫院神經外科2020年1月—10月行經鼻蝶入路手術的12例垂體腺瘤患者,將其完整的影像數據導入3D Slicer軟件進行多模態融合及三維模型重建,實現術前可視化及手術入路模擬,輔助手術規劃制定,指導術中病灶切除,獲得了較為滿意的效果。現報告如下。
1 資料與方法
1.1 軟件版本及計算機系統介紹 3D Slicer(www.slicer.org)是一款由美國哈佛大學、麻省理工學院、美國國立衛生研究院歷時近二十年聯合開發的影像后處理軟件,具有強大的3D建模、多模態影像配準融合、模型分割、內鏡模擬等功能,為臨床醫生、科研人員提供了強大的醫學圖像處理、可視化和數據分析的便捷,可以在Windows、Linux、Mac多系統上運行,應用于醫學影像分析、 導航手術和微創手術等[6]。研究中使用的3D Slicer版本為最新穩定版(version 4.10),電腦系統為Windows 7 專業版64位。
1.2 一般資料 12例經鼻蝶入路手術治療的垂體占位患者,影像數據資料均完整,其中男5例,女 7例;年齡22~64 歲,平均年齡43.4 歲;病程1~48 個月,平均病程13個月;腫瘤直徑11~38 mm,平均25.5 mm;術后病理報告為垂體腺瘤10例,垂體囊腫2例。
1.3 影像學檢查及3D重建過程 影像重建過程中由副主任及其以上級別的醫師協助結構辨別,影像數據包括顱腦CT、CTA、MRI、MRA、增強MRI等。影像學檢查采用飛利浦3.0 T 磁共振掃描儀進行MRI檢查,顱腦CT或CTA掃描層厚為1 mm。通過醫院影像歸檔通訊系統(picture archiving and communication systems,PACS)獲取患者全部原始DICOM格式影像數據[7-8]。分別將患者不同模態的原始DICOM格式數據導入到3D Slicer軟件中。骨性結構如鞍底,主要通過CT或者CTA數據進行重建,血管主要通過CTA或者MRA、增強MRI進行重建,視神經主要通過CT或MRI進行重建;同時使用不同的顏色進行標記。重建過程中使用的3D Slicer工具主要集中在Volume Rendering和Segment Editor模塊里面,包括Paint、Grow from Seeds、Threshold等[9],影像配準使用的是General Registration(Elastix) 模塊。重建完成以后的3D模型,通過與2D影像融合,初步驗證3D影像重建的準確度。完成鞍底及其周圍血管神經等重建以后,調整模型觀察角度,獲得與以鼻尖至鞍底連線垂直的平面視角,實現手術視角的模擬,并將模型導出為STL格式備用。整個重建流程見圖1。
1.4 手術過程 選擇單側鼻孔或雙鼻孔入路,并在蝶篩隱窩內找到蝶竇開口后用磨鉆擴大蝶竇開口;依次打開蝶竇前壁,磨除蝶竇分隔,并顯露鞍底、斜坡隱窩等結構。磨鉆磨開鞍底下部骨質,進一步顯露鞍底硬腦膜,以十字形切開硬腦膜,顯露腫瘤。腫瘤切除后,使用腦膜補片聯合生物蛋白膠修補硬膜及密封鞍底。術中留存手術錄像備用。
2 結 果
2.1 影像重建結果 本組12例垂體占位患者均順利完成鞍底重建。重建的3D模型正確顯示了病變及其周圍不同結構的相對空間位置,與術中所見吻合度較高,結果滿意。
2.2 手術結果 本組患者術前均按照重建模型成功進行了手術入路模擬和規劃,并按照計劃順利完成了手術;術后1例患者出現腦脊液漏,予以保守治療后痊愈;其余患者均未出現腦脊液漏、視力下降等并發癥。所有患者術后24 h內復查顱腦CT示鞍底骨窗位置滿意,手術區域未見新增出血。
2.3 典型病例 患者女,54歲,以“左側視力下降2年余,加重2個月”于2020年3月入院。患者病后無其他不適。入院后顱腦CTA、MRI檢查示:垂體前后葉間囊樣占位并突入鞍上,偏左并壓迫視交叉。術前將患者CTA聯合增強MRI數據進行3D重建(圖2)。完善術前檢查后,行經鼻蝶入路垂體占位切除術,手術過程順利;術中所見與3D重建模型高度吻合(圖3)。術后病理診斷:垂體囊腫。
3 討 論
目前神經內鏡下經鼻蝶入路已逐漸成為垂體腺瘤的首選術式[2],如果在術前能夠對復雜的鼻蝶竇內解剖結構進行熟悉和了解,勢必可以提高手術的安全性及手術效率。隨著影像學技術的不斷發展,顱腦CT、CTA、MRI等已成為了鞍區病變患者的常規檢查,并且通過醫院影像系統可以實現簡單的3D重建。但是這種影像重建基本上由放射科醫生完成,因此對于手術過程中外科醫生關注的側重點把握并不十分準確,重建模型也很難達到手術醫生所期望的理想狀態。此外,在大部分醫院PACS系統,無法將不同模態影像的重建結果放置于同一空間進行觀察。對于專業的神經外科醫生,在將神經影像檢查作為診斷手段的同時,更希望將影像檢查作為輔助手術治療的工具,而不再局限于疾病的診斷。顱腦CT掃描可以更好地顯示鞍底的骨性輪廓、蝶竇分隔、視神經管等;顱腦MRI的掃描可以更好地顯示垂體腺瘤大小、質地以及頸內動脈等。利用3D Slicer將兩種模態影像進行成功配準后,在同一空間下,分別使用顱腦CT進行鞍底骨性輪廓、蝶竇分隔、視神經及視神經管重建,使用顱腦MRI進行垂體腺瘤及頸內動脈重建,充分結合了兩種不同影像模態的各自優勢,實現鞍底的立體可視化,使之更加直觀。另外,使用CTA與MRI組合同樣可完成各結構的重建。
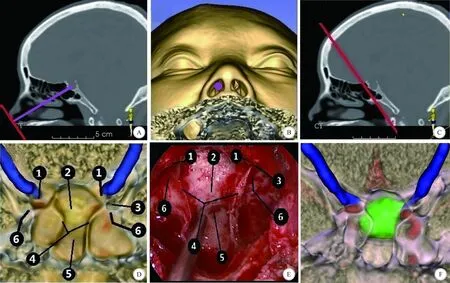
A、B:調整模型角度,使觀察平面與鞍底至鼻尖連線(紫色線)垂直; C:逐層推進觀察平面(紅色線)至蝶竇內; D:觀察鞍底結構(1-視神經隆突;2-鞍底;3-視神經-頸內動脈隱窩;4-蝶竇分隔;5-斜坡隱窩;6-頸內動脈隆突); E:術中內鏡下所見鞍底各部分結構(1-視神經隆突;2-鞍底;3-視神經-頸內動脈隱窩;4-蝶竇分隔;5-斜坡隱窩;6-頸內動脈隆突,以上結構與模型高度吻合); F:進一步將骨性結構半透明化,顯露內部結構,確認D中各結構位置準確圖3 模擬手術及3D模型與術中所見對比
通過多模態三維重建,不僅可以為外科醫生提供術中解剖信息,還可以直接任意調整3D模型模擬手術視角,預測術中可能出現的情況及手術難點,并制定相應的應對措施和計劃,最大程度提高手術治療的安全性。與建立在二維影像基礎上制定的手術計劃相比較,采用3D Slicer軟件制作的3D立體模型更加直觀、準確,組織結構層次更加清晰明了,并且與術中可見的真實解剖結構具有較高的吻合度,在一定程度上可以減少術中因組織結構識別有誤而造成的不必要損傷[10]。
本研究中通過3D Slicer重建了鞍底、頸內動脈、視神經、蝶竇分隔等,通過調整模型透明度及角度可以清晰地顯示不同結構的空間位置以及腫瘤位置,并且在模型中可以使用不同的顏色進行結構標記,使各部分結構更加清晰明了。通過術前對三維模型的反復觀察熟悉,使得術者在手術過程中對頸內動脈隆突、視神經隆突、斜坡隱窩等的位置判斷更為準確。如本研究中的典型病例,術前通過3D Slicer將患者原始影像數據進行配準后,完成3D模型重建,通過調整模型角度,成功模擬了術中內鏡視角,同時確定了以鞍底為中心的周圍各結構的相對位置;在模型中可以清晰地識別出蝶竇分隔、鞍底、斜坡、頸內動脈隆突等周圍結構,實現了術前手術區域解剖結構的立體可視化,手術過程中術者通過內鏡到達蝶竇之后,觀察到了蝶竇分隔,其走行和3D模型所示完全吻合。通過觀察模型并結合術中所見,使得術中各解剖結構更加明確,進而很容易確定鞍底及斜坡隱窩位置,術中仔細操作,避免了頸內動脈、視神經等重要結構的損傷;術后通過回看手術錄像,結合模型進一步評估模型的應用價值及手術操作中的不足。另外,由于部分患者的頸內動脈隆突并不是非常明顯,術前通過觀察蝶竇分隔模型,將其作為解剖學參考標志指導術中結構識別,不失為一種好的方法[11]。本研究典型病例的蝶竇分隔比較突出,通過分析模型可知,其兩側蝶竇分隔的中間區域即為鞍底和斜坡隱窩,按照內鏡視角方位,其中蝶竇左側分隔的上方起始部即為左側頸內動脈隆突位置和左側視神經管隆突的位置,蝶竇右側分隔的上方起始部外側即為右側頸內動脈隆突的位置。
根據病變特點,外科醫生將影像數據選擇性地進行解剖結構3D重建,處理后的3D影像模型不僅可以導入到移動設備中,隨時隨地查看,還可以直接用于3D打印[12]。另外關于3D Slicer軟件的應用,除了本研究采用的經鼻蝶手術模型制作,還包括大腦其他腫瘤模型制作、腦血腫及垂體瘤體積計算、神經纖維束示蹤、影像組學研究等[13-15]。近幾年,虛擬現實及人工智能技術在醫療領域的應用逐漸普及,越來越多的機構以此進行醫學教學、手術輔助等[16],而這一切都是建立在影像3D可視化的基礎之上。盡管神經導航等技術聯合內鏡可提高腫瘤全切率,降低手術風險[17-18],但是在一些基層醫院由于條件限制,神經導航、神經外科手術機器人等[19-21]并不能得到廣泛應用,因此第三方影像可視化處理軟件會成為最佳選擇。
另外,本研究亦有一些不足之處,主要體現在以下兩個方面:(1)由于樣本量小,利用3D Slicer輔助術前規劃能否縮短整體手術時間,有待進一步證實;(2)影像重建使用的是原始DICOM格式數據,模型的重建效果很大程度受限于所使用的數據質量,因此使用3D Slicer必須和影像科醫生相互溝通合作。盡管如此,這并不影響3D Slicer在經鼻蝶入路手術中的重要使用價值。
綜上所述,在不增加醫療資源消耗和患者經濟負擔的前提下,利用3D Slicer軟件聯合現有的影像檢查數據,實現多模態影像的三維重建,使得病變解剖結構3D可視化,可以幫助醫生制定更完善的術前計劃。另外,3D模型還可以作為醫療團隊之間、醫患交流和術前談話的媒介工具,清晰、易懂,值得提倡和推廣。盡管垂體瘤等鞍區病變的外科治療任重道遠,但是相信隨著經驗的積累和技術的進步,治療手段將會更加完善。

