術前NLR水平與原發性肝癌患者肝切除術后肝衰竭的相關性
朱翊 趙萍 李杰珍 冉博
中性粒細胞/淋巴細胞比值(neutrophil/lymphocyte ratio,NLR)主要受中性粒細胞(neutrophils,NE)、淋巴細胞(lymphocyte,LY)水平的影響,能夠顯著反映機體免疫功能[1]。研究表明,腫瘤組織可分泌白細胞介素-1及腫瘤壞死因子,致使體內NE過表達,而NE過表達又可改變腫瘤組織的生長環境,使環境更利于腫瘤生長[2]。且有諸多報道顯示,LY可間接或直接殺死腫瘤,是維持機體免疫功能的重要因子之一,能夠激活腫瘤免疫;同時,LY低表達可為腫瘤浸潤提供[3-4]。研究指出,NE、LY的絕對值能夠作為炎癥反應的標志物進行研究,但NE、LY的絕對值具有不穩定性,故臨床上多通過易檢測、可重復且價格低廉的NLR作為炎癥反應檢測指標[5]。且有相關研究表明,術前NLR表達情況可能是子宮內膜癌患者術后發生病死的影響因素之一[6]。故推測術前NLR水平對原發性肝癌患者肝切除術后發生肝衰竭有影響,但相關研究較少。本研究主要觀察原發性肝癌肝切除術后發生肝衰竭患者術前NLR表達情況,并分析NLR與原發性肝癌肝切除術后肝衰竭的關系。
資料與方法
一、一般資料
回顧性分析,收集2017年3月至2019年11月期間新疆醫科大學第一附屬醫院完成肝切除術治療與術后隨訪的274例原發性肝癌患者作為肝癌組,并收集同期醫院完成治療與隨訪并經組織病理證實為肝臟良性腫瘤的67例患者作為對照組。肝癌組中男性146例,女性128例;年齡48~69歲,平均年齡(59.24±3.74)歲;γ-谷氨酰轉肽酶水平400~501 IU/L,平均γ-谷氨酰轉肽酶水平(469.85±16.49)IU/L;堿性磷酸酶水平313~389 IU/L,平均堿性磷酸酶水平(367.13±9.52)IU/L;乳酸脫氫酶水平314~386 IU/L,平均乳酸脫氫酶水平(346.89±13.05)IU/L;α-L-巖藻糖甘酶水平65~90 IU/L,平均α-L-巖藻糖甘酶水平(71.35±5.12)IU/L;甲胎蛋白水平456~576 IU/L,平均甲胎蛋白水平(465.15±5.24)IU/L。對照組中男性39例,女性28例;年齡47~70歲,平均年齡(58.98±3.56)歲;γ-GT水平393~512 IU/L,平均γ-GT水平(468.97±16.52)IU/L;ALP水平312~388 IU/L,平均ALP水平(366.99±9.48)IU/L;LDH水平313~387 IU/L,平均LDH水平(345.96±13.24)U/L;AFU水平66~91 IU/L,平均AFU水平(72.03±5.06)IU/L;AFP水平454~575 IU/L,平均AFP水平(466.11±5.03)IU/L。統計學對比兩組一般資料,差異無統計學意義(P>0.05),具有可對比性。
納入標準:①原發性肝癌患者經組織病理確診;②肝臟良性腫瘤經組織病理證實為良性;③預計生存時間>3個月;⑥臨床資料保存完整。排除標準:①合并心功能、腎功能衰竭的患者;②合并其他惡性腫瘤的患者;③合并嚴重傳染性疾病或感染性疾病的患者;④合并免疫系統性疾病的患者。
四、研究方法
(一)NE、LY及NLR水平檢測 分別于患者入院第二天早晨,空腹抽取患者靜脈血4 mL,使用南京貝登醫療股份有限公司提供的型號為BC-5000全自動血細胞分析儀檢測患者的NE、LY水平,并計算NLR水平。
(二)肝衰竭發生情況 記錄原發性肝癌患者肝切除術后肝衰竭發生情況,肝衰竭診斷標準參照《肝衰竭診療指南》[7]。
五、統計學分析
結 果
一、肝癌組與對照組術前NE、LY及NLR水平比較
肝癌組術前NE及NLR水平均高于對照組,LY水平低于地對照組,差異有統計學意義(P<0.05)。見表1。
表1 肝癌組與對照組術前NE、LY及NLR水平比較(,×109/L)
二、肝衰竭發生情況
274例原發性肝癌患者中,肝切除術后發生肝衰竭的患者有32例,占比為11.68%(32/274);未發生肝衰竭的患者有242例,占比為88.32%(242/274)。
三、發生肝衰竭組與未發生肝衰竭組術前NE、LY及NLR水平比較
發生肝衰竭組術前NE、NLR水平均高于未發生肝衰竭組,LY水平低于未發生肝衰竭組,差異有統計學意義(P<0.05)。見表2。
四、術前NLR水平對原發性肝癌患者肝切除術后發生肝衰竭的影響分析
將原發性肝癌患者術前NLR水平作為協變量,肝切除術后發生肝衰竭作為因變量(1=發生,0=未發生),經二元Logistic回歸分析結果顯示,術前NLR過表達是原發性肝癌患者肝切除術后發生肝衰竭的影響因素(OR>1,P<0.05)。見表3。
五、術前NLR水平預測原發性肝癌患者肝切除術后發生肝衰竭的價值分析
將原發性肝癌患者術前NLR水平作為檢驗變量,肝切除術后發生肝衰竭作為狀態變量(1=發生,0=未發生),經ROC曲線分析結果顯示,術前NLR水平預測原發性肝癌患者肝切除術后發生肝衰竭的AUC為0.812,>0.80,預測價值較理想。見圖1。AUC的95%CI為0.703~0.921,標準誤0.055,P<0.001,最佳閾值2.034,特異度0.988,靈敏度0.875,約登指數0.863。
討 論
研究指出,原發性肝癌患者中有80%~90%的人合并不同程度的肝硬化,肝硬化可降低患者肝臟組織再生能力,進而增加肝衰竭風險[8]。合并肝硬化的原發性肝癌患者在肝切除術后可出現肝衰竭,致使肝細胞生長因子低表達,減少肝臟再生體積,增加原發性肝癌患者術后病死風險[9]。
表2 發生肝衰竭組與未發生肝衰竭組術前NE、LY及NLR水平比較()

表3 術前NLR水平對原發性肝癌患者肝切除術后發生肝衰竭的影響分析
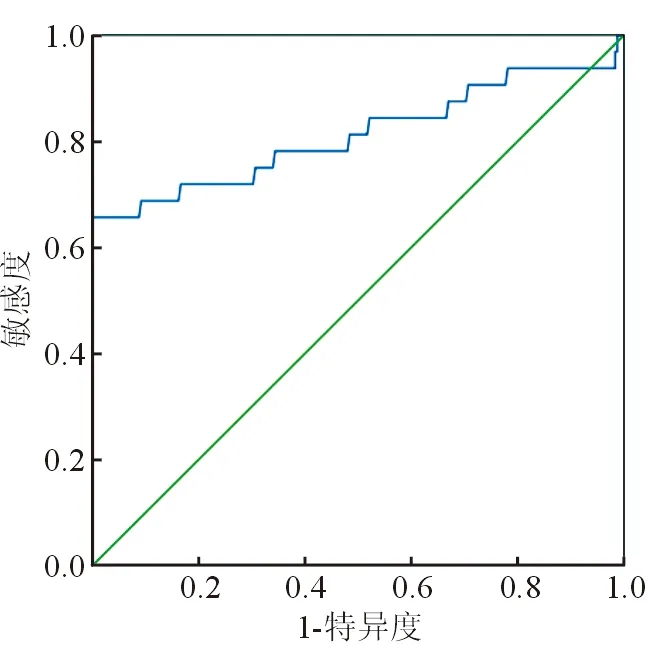
圖1 術前NLR水平預測原發性肝癌患者肝切除術后發生肝衰竭的ROC曲線圖
研究表明,原發性肝癌的發生、發展與全身或局部炎癥反應密切相關,炎癥反應的發生不僅可促使大量新血管生成,也可阻止細胞凋亡,損壞脫氧核糖核酸(deoxyriboNucleic acid,DNA),進而促進肝臟癌變程度進一步發展[10]。NE經酶的作用可分泌大量激素物質,這些激素物質不僅能夠有效調節血管口徑,提高血管通透性,且可引發炎癥反應及疼痛,進而影響凝血功能[11]。研究指出,NE是炎癥反應發生與發展的主要因子之一,NE可直接影響宿主細胞免疫功能,進而降低宿主細胞抗癌能力;同時,NE可釋放大量血管內皮生長因子,促使毛細血管增生,為腫瘤組織的生長及轉移提供有利條件[12]。LY作為體積最小的白細胞,是機體免疫應答功能的重要細胞成分,可主導淋巴系統內的大部分免疫功能[13]。報道顯示,LY能夠顯著阻止腫瘤細胞發生增殖及遷移,繼而發揮抗腫瘤作用[14]。相關文獻指出,LY低表達能夠降低機體的抗癌能力,且LY與機體免疫反應有關,能夠直接殺滅腫瘤細胞[15]。NLR表達情況受NE與LY表達影響,研究指出,NLR可有效反映機體炎癥反應發生程度,且效果分別優于NE、LY單一指標[16]。術前NLR過表達已被研究證實是腎癌患者不良預后的獨立危險因素,可顯著提高腎癌患者病死風險[17]。此外,NLR水平是非小細胞肺癌獨立預后因素[18]。相關研究證實,肝衰竭的發病基礎是大量肝臟細胞發生壞死,炎性細胞浸潤,進而引發多種炎癥反應,促使肝臟發生缺血性損傷,引發肝功能障礙。故推測NLR也可能參與了原發性肝癌患者肝切除術后發生肝衰竭的發病過程,可能對早期評估原發性肝癌患者肝切除術后發生肝衰竭有一定價值。
本次研究結果顯示,肝癌組術前NE及NLR水平均高于對照組,LY水平低于地對照組,初步表明術前NLR異常表達可能參與了原發性肝癌的發生,該結果也可能提示了術前NLR對患者肝切除術后發生肝衰竭的預測價值。進一步比較不同肝衰竭原發性肝癌患者術前NE、LY及NLR水平,結果顯示,發生肝衰竭組術前NE、NLR水平均高于未發生肝衰竭組,LY水平低于未發生肝衰竭組,進一步表明術前NLR異常表達與原發性肝癌患者術后肝切除術后肝衰竭的發生有一定內在聯系。做二元Logistic回歸分析結果顯示,術前NLR過表達是原發性肝癌患者肝切除術后發生肝衰竭的影響因素;最后繪制ROC曲線發現,術前NLR水平預測原發性肝癌患者肝切除術后發生肝衰竭的AUC為0.812,>0.80,預測價值較理想。上述結果均證實,術前NLR表達與原發性肝癌患者肝切除術后肝衰竭有關,可作為患者術后肝衰竭發生風險預測指標。但本研究仍存在較多不足之處,如本研究采取回顧性分析,回顧性分析在搜集患者臨床資料時,具有諸多不可控制的因素,符合條件的樣本數量較少、典型案例較少、研究數據不具有代表性等。鑒于此,希望未來能夠開展多中心、大樣本的前瞻性研究,加以佐證本次研究數據,以提高其可信度,旨在為未來臨床該類患者的治療提供科學依據。

