阿膠中牛皮源成分補充檢驗方法的改進
魯 輝,閔春艷,黃逸文,錢 巖,邢以文
(蘇州市藥品檢驗檢測研究中心,江蘇 蘇州 215104)
阿膠為馬科動物驢Equus asinusL.的干燥皮或鮮皮經(jīng)煎煮、濃縮制成的固體膠,始載于《神農(nóng)本草經(jīng)》。阿膠作為藥品使用已有2500多年的歷史,《中國藥典》(2020年版)一部中明確規(guī)定阿膠應(yīng)以驢皮熬制[1]。近年,隨著阿膠需求的迅猛增加,其原料驢皮也愈加緊俏,價格連連攀升,這就造成了不少企業(yè)為了降低生產(chǎn)成本在生產(chǎn)阿膠時以牛、豬等的皮熬制的膠類冒充阿膠或以動物骨、舊皮革等制成的偽品膠冒充阿膠[2-4],此類行為極大損害了消費者的利益并影響人民群眾的用藥安全。為了有效控制阿膠藥材的質(zhì)量,國家食品藥品監(jiān)督管理局于2012年發(fā)布了“阿膠中牛皮源含量的補充檢驗方法”(標準編號2012001)[5]。此后,為了有效控制以阿膠為君藥的中成藥質(zhì)量,國家食品藥品監(jiān)督管理總局又于2018年發(fā)布了阿膠補血膏(標準編號:BJY201804)[6]及阿膠補血口服液(標準編號:BJY201805)[7]中牛皮源成分檢查項的補充檢驗方法。上述方法均以m/z641.3(雙電荷)→726.2和m/z641.3(雙電荷)→783.3提取的多反應(yīng)監(jiān)測(MRM)色譜峰作為牛皮源成分的特征肽段峰,并規(guī)定樣品中不得同時檢出;若同時檢出,則要求樣品中m/z641.3(雙電荷)→726.2提取的MRM色譜峰面積不得超過對照溶液中相應(yīng)的峰面積。上述補充檢驗方法結(jié)合《中國藥典》(2020年版)一部品種項下相應(yīng)標準作為日常監(jiān)管手段,較好地控制了阿膠原藥材及其中成藥的質(zhì)量。
上述補充檢驗方法的色譜分析時間均為40 min,不利于日常監(jiān)管快速分析。同時,阿膠原藥材(供試品稱樣量0.1 g)和阿膠補血膏及阿膠補血口服液等中成藥(供試品稱樣量相當于阿膠原藥材0.1 g)牛皮源檢查分別采用濃度為0.3 μg/ml的牛皮特征肽A對照品溶液和100 μg/ml的黃明膠對照藥材溶液作為牛皮源成分的對照溶液。監(jiān)管中發(fā)現(xiàn)兩種不同的對照溶液其m/z641.3(雙電荷)→726.2和m/z641.3(雙電荷)→783.3提取的MRM色譜峰面積值差異較大,這會導(dǎo)致阿膠原藥材與阿膠類中成藥牛皮源成分檢查結(jié)果判定標準產(chǎn)生差異。本文旨在進一步優(yōu)化補充檢驗方法的色譜系統(tǒng),考察并比較用于制備牛皮源成分參比溶液的牛皮特征肽A對照品與黃明膠對照藥材之間的差異,改進阿膠中牛皮源成分補充檢驗方法,為更合理有效的監(jiān)管提供支持。
1 儀器與材料
1.1 儀器
Waters Acquity 型超高效液相色譜儀-Xevo TQ-S三重四級桿質(zhì)譜儀(美國Waters公司);XS205 DU型電子天平(Mettler Toledo儀器有限公司)。
1.2 藥品與試劑
胰蛋白酶(批號:140615-200206),牛皮特征肽A對照品(批號:111941-201804,含量93.8 %),阿膠對照藥材(批號:121274-201703),黃明膠對照藥材(批號:121695-201301,中國食品藥品檢定研究院);乙腈(LC-MS級,賽默飛世爾);碳酸氫銨(分析純,國藥集團);水為超純水。
2 方法與結(jié)果
2.1 色譜條件
色譜柱為Waters BEH C18柱(2.1 mm×50 mm,1.7 μm);流動相為乙腈(A)-0.1 %甲酸溶液(B),梯度洗脫:0~10 min,5 %A~11 %A;10~11 min,11 %A~80 %A;11~13 min,80 %A;13~13.01 min,80 %A~5 %A;13.01~15 min,5 %A;流速為0.3 ml/min;柱溫為30 ℃;進樣體積為5.0 μl。
2.2 質(zhì)譜條件
采用電噴霧正離子模式,監(jiān)測模式:MRM,選擇牛皮特征多肽m/z641.3(雙電荷)→726.2和m/z641.3(雙電荷)→783.3作為檢測離子對,噴霧電壓3.5 kV,錐孔電壓30 V,脫溶劑溫度350 ℃,脫溶劑氣體流量1000 L/min。
2.3 溶液的制備
2.3.1 牛皮特征肽A對照品溶液的制備 取牛皮特征肽A對照品16 mg,精密稱定,置50 ml量瓶中,加1 %碳酸氫銨溶液使溶解并稀釋至刻度,搖勻;精密量取1 ml,置100 ml量瓶中,加1 %碳酸氫銨溶液稀釋至刻度,搖勻;精密量取1 ml,置10 ml量瓶中,加阿膠基質(zhì)溶液(取阿膠對照藥材粉末0.1 g,置50 ml量瓶中,加1 %碳酸氫銨溶液40 ml,超聲處理30 min,加1 %碳酸氫銨溶液稀釋至刻度,搖勻,即得)稀釋至刻度,搖勻(每1 ml含牛皮特征肽A 0.3 μg),取該溶液于10 000 r/min離心10 min,取上清300 μl,置1.5 ml離心管中,加胰蛋白酶溶液(1 mg/ml)30 μl,搖勻,37 ℃恒溫酶解12 h,即得。
2.3.2 黃明膠對照藥材溶液的制備 稱取黃明膠對照藥材粉末0.1 g,置50 ml量瓶中,加1 %碳酸氫銨溶液40 ml,超聲處理30 min,加1 %碳酸氫銨溶液稀釋至刻度,搖勻,精密量取0.5 ml,置10 ml量瓶中,加阿膠基質(zhì)溶液稀釋至刻度,搖勻(每1 ml含黃明膠對照藥材 100 μg),10 000 r/min離心10 min,取上清300 μl,置1.5 ml離心管中,加胰蛋白酶溶液(1 mg/ml)30 μl,搖勻,37 ℃恒溫酶解12 h,即得。
2.3.3 阿膠對照藥材溶液的制備 稱取阿膠對照藥材0.1 g,加1 %碳酸氫銨溶液50 ml,超聲處理30 min,10 000 r/min離心10 min,取上清300 μl,置1.5 ml離心管中,加胰蛋白酶溶液(1 mg/ml)30 μl,搖勻,37 ℃恒溫酶解12 h,即得。另取0.1 ml超純水替代阿膠對照藥材,同法制備空白溶液。
2.4 方法學(xué)考察
2.4.1 專屬性 分別取空白溶液、阿膠對照藥材溶液、牛皮特征肽A對照品溶液及黃明膠對照藥材溶液,以牛皮特征肽段m/z641.3(雙電荷)→726.2和m/z641.3(雙電荷)→783.3作為檢測離子對進行測定,結(jié)果牛皮特征肽A對照品溶液及黃明膠對照藥材溶液在保留時間3.5 min檢出相應(yīng)的色譜峰,而空白溶液和阿膠對照藥材溶液的提取離子流色譜圖中均無相應(yīng)的色譜峰。因此空白和阿膠對照藥材對牛皮源成分的檢測不構(gòu)成干擾,表明方法的專屬性較好,詳見圖1 A~D。
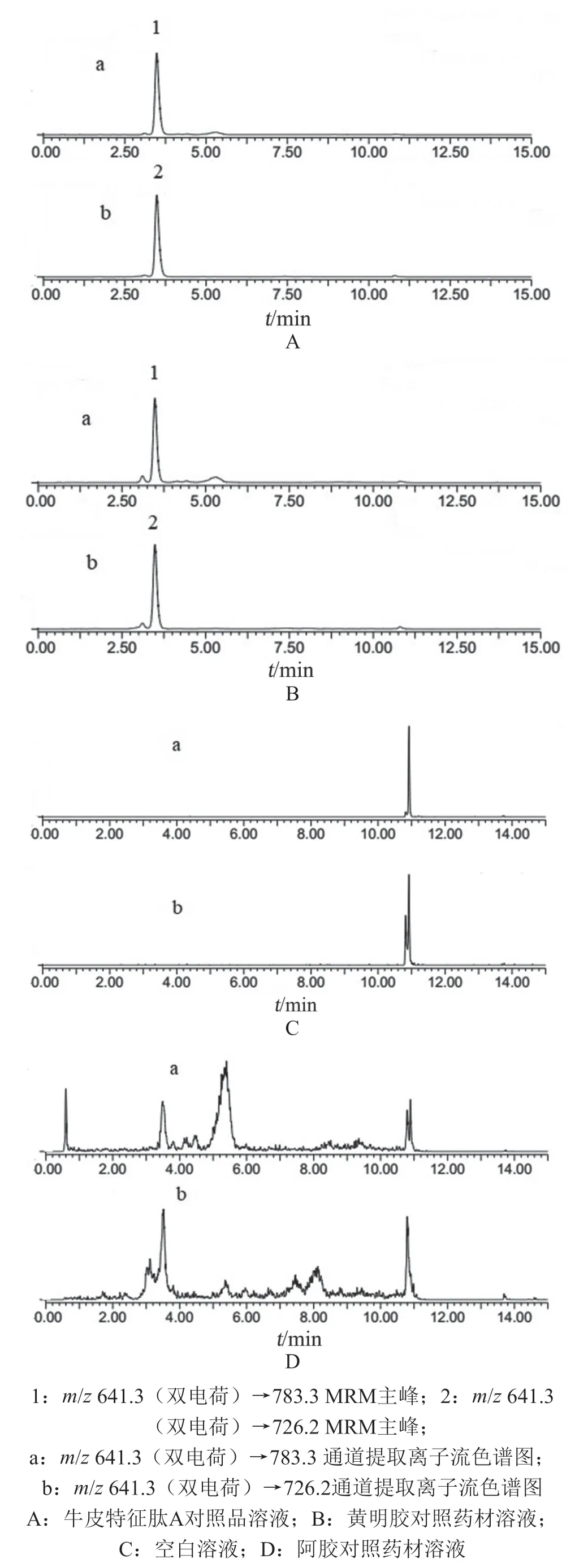
圖1 專屬性試驗中牛皮源成分的提取離子流色譜圖
2.4.2 重復(fù)性 按2.3.1和2.3.2項下方法分別制備牛皮特征肽A對照品溶液及黃明膠對照藥材溶液各6份,進樣測定。結(jié)果牛皮特征肽A對照品m/z641.3(雙電荷)→783.3和m/z641.3(雙電荷)→726.2 MRM色譜峰面積的平均值(n=6)分別為108 839和130 251,RSD分別為1.1 %和1.5 %;黃明膠對照藥材溶液MRM色譜峰面積的平均值(n=6)分別為58 234和69 905,RSD分別為2.6 %和2.1 %。結(jié)果表明重復(fù)性較好,0.3 μg/ml牛皮特征肽A對照品溶液MRM色譜峰面積的平均值約為100 μg/ml黃明膠對照藥材溶液的1.9倍。
2.4.3 線性關(guān)系考察
2.4.3.1 牛皮特征肽A對照品 取牛皮特征肽A對照品16 mg,精密稱定,置50 ml量瓶中,加1 %碳酸氫銨溶液使溶解并稀釋至刻度,搖勻;精密量取1 ml,置100 ml量瓶中,加1 %碳酸氫銨溶液稀釋至刻度,搖勻;精密量取0.05,0.1,0.2,0.5,1.0,2.0 ml,分別置10 ml量瓶中,加阿膠基質(zhì)溶液釋至刻度,搖勻,按2.3.1項下方法酶解處理并進樣測定。以牛皮特征肽A對照品的濃度(C,μg/ml)為橫坐標,以m/z641.3(雙電荷)→726.2通道的MRM色譜峰面積(Y)為縱坐標,進行線性回歸,結(jié)果線性方程為Y=436 508.5C-57.0,相關(guān)系數(shù)r為1.0000,表明在0.016~0.65 μg/ml的濃度范圍內(nèi),線性關(guān)系良好。
2.4.3.2 黃明膠對照藥材 取黃明膠對照藥材約100 mg,精密稱定,置50 ml量瓶中,加1 %碳酸氫銨溶液40 ml,超聲40 min,放冷,加1 %碳酸氫銨溶液稀釋至刻度,搖勻;精密量取0.1,0.2,0.3,0.5,1.0 ml,分別置10 ml量瓶中,加阿膠基質(zhì)溶液釋至刻度,搖勻,按2.3.2項下方法處理并進樣測定。以黃明膠對照藥材的濃度(C,μg/ml)為橫坐標,以m/z641.3(雙電荷)→726.2通道的MRM色譜峰積(Y)為縱坐標,進行線性回歸,結(jié)果線性方程為Y=688.2C-193.6,相關(guān)系數(shù)r為0.9996,即在20.83~208.26 μg/ml的濃度范圍內(nèi)線性關(guān)系良好。
2.5 模擬樣品的檢測
稱取阿膠對照藥材0.1 g,精密加入黃明膠對照藥材7.5 mg,按2.3.3項下方法處理,平行制備6份含牛皮源成分的供試品溶液,進樣測定。結(jié)果發(fā)現(xiàn)6份供試品溶液中均檢出m/z641.3(雙電荷)→783.3和m/z641.3(雙電荷)→726.2 MRM色譜峰,其峰面積的平均值(n=6)分別為86 291和102 871,RSD為3.4 %和4.6 %。
3 討論
3.1 色譜系統(tǒng)的優(yōu)化
阿膠中牛皮源含量補充檢驗方法的色譜洗脫時間為40 min,加上色譜系統(tǒng)的再平衡時間,整個采集時間近45 min。本研究采用柱長為50 mm、填料粒徑為1.7 μm的超高效色譜柱替代原標準的柱長為100 mm、粒徑為1.8 μm的色譜柱。基于替換的色譜柱其柱長更短、粒徑更小,在保證方法分離效果的基礎(chǔ)上,經(jīng)不斷調(diào)整梯度洗脫程序,最終將補充檢驗方法的梯度洗脫程序由“0~25 min,5 %A~20 %A;25~40 min,20 %A~50 %A”改為“0~10 min,5 %A~11 %A;10~11 min,11 %A~80 %A;11~13 min,80 %A;13~13.01 min,80 %A~5 %A;13.01~15 min,5 %A”,A為乙腈,B為0.1 %甲酸溶液,將總采集時間控制為15 min,有效縮短了分析時間,方法學(xué)考察結(jié)果也表明方法的專屬性強、精密度、重復(fù)性較好,線性關(guān)系良好,可用于牛皮源成分的快速分析。
3.2 阿膠原藥材與含阿膠中成藥中牛皮源成分判定標準問題
阿膠原藥材(取樣0.1 g)采用0.3 μg/ml的牛皮特征肽A對照品,而阿膠補血膏和阿膠補血口服液(相當于阿膠原藥材0.1g)則采用100 μg/ml的黃明膠對照藥材。重復(fù)性試驗發(fā)現(xiàn),以m/z641.3(雙電荷)→726.2提取的MRM色譜圖中,牛皮特征肽A對照品溶液MRM色譜峰面積約為黃明膠對照藥材溶液的1.9倍。即阿膠原藥材中牛皮源成分限度要求比阿膠補血膏及阿膠補血口服液等中成藥明顯寬松。模擬供試品溶液中均檢出牛皮源成分,其m/z641.3(雙電荷)→726.2提取的MRM色譜峰面積值均低于牛皮特征肽A對照品溶液中相應(yīng)的峰面積值,但卻高于黃明膠對照藥材制備的牛皮源成分對照溶液相應(yīng)的峰面積值,依據(jù)標準,前者應(yīng)判定為未檢出牛皮源成分,而后者則判定為檢出牛皮源成分。因此有必要將阿膠原藥材與阿膠中成藥中牛皮源成分的判定標準進行統(tǒng)一。建議將阿膠藥材中牛皮特征肽A對照品的濃度降低1.9倍,亦或采用100 μg/ml的黃明膠對照藥材作為牛皮源成分的對照溶液。
3.3 阿膠與其他膠類藥材牛皮源成分判定標準問題
阿膠原藥材(取樣0.1 g)采用0.3 μg/ml的牛皮特征肽A對照品作為牛皮源成分對照溶液,而龜甲膠(標準編號:2014013)[8]和鹿角膠(標準編號:2014014)[9]等膠類原藥材(取樣0.1 g)中牛皮源成分補充檢驗方法則采用100 μg/ml的黃明膠對照藥材作為牛皮源成分的對照溶液,即阿膠原藥材中牛皮源成分限度比龜甲膠、鹿角膠等膠類藥材更為寬松,本著合理監(jiān)管的角度,建議阿膠中牛皮源成分的限度從嚴控制,從而與其他膠類藥材的判定標準統(tǒng)一。
3.4 不同牛皮源成分參比品的比較
牛皮特征肽A對照品屬于多肽類產(chǎn)品,穩(wěn)定性較差,需要在-20 ℃以下冷凍保存,日常使用中運輸要求較高且對照品的價格較為昂貴,而黃明膠對照藥材在室溫下即可穩(wěn)定保存且價格較便宜。本著穩(wěn)定性、易獲得性和經(jīng)濟性的考慮,建議“阿膠中牛皮源含量的補充檢驗方法”修訂為采用黃明膠對照藥材制備牛皮源成分參比溶液。
4 結(jié)論
本文對阿膠原藥材及含阿膠中成藥中牛皮源成分檢查補充檢驗方法進行了優(yōu)化,將分析時間由40 min縮短至15 min,有效提高了分析速度。同時對阿膠原藥材標準中采用的牛皮特征肽A對照品和阿膠補血膏及阿膠補血口服液中采用的黃明膠對照藥材進行了考察,結(jié)果表明二者的m/z641.3(雙電荷)→726.2 MRM色譜峰面積值相差約1.9倍。相同樣品量下將會導(dǎo)致阿膠原藥材與中成藥中牛皮源成分的判定標準不統(tǒng)一,本著嚴格監(jiān)管的原則,同時從對照品的穩(wěn)定性和經(jīng)濟性上考慮,建議阿膠中牛皮源檢查補充檢驗方法修訂為采用100 μg/ml的黃明膠對照藥材制備牛皮源成分的參比溶液。

