剖宮產后子宮瘢痕憩室治療方式的研究進展
生蓉,汪希鵬
子宮瘢痕憩室(cesarean scar diverticula,CSD)又稱剖宮產后子宮切口瘢痕缺損,是指剖宮產術后的子宮切口由于愈合不良出現的與宮腔相通的一個凹陷(切口處子宮肌層分離)。近年世界范圍內剖宮產率增加[1],雖然剖宮產在醫學上可以作為挽救生命的干預措施,但也增加子宮破裂、胎盤異常、異位妊娠、死產和早產的風險[2],而CSD 也是剖宮產術的主要遠期并發癥,可引起異常子宮出血、經期延長、不孕、慢性盆腔痛和瘢痕妊娠等[3],嚴重影響婦女生活質量。臨床上治療CSD 包括保守治療及手術治療[4],不同的治療方式有不同的臨床效果。保守治療主要為口服避孕藥、左炔諾孕酮宮內節育器及中藥等,目前治療方法以手術為主,手術治療包括宮腔鏡、腹腔鏡、宮腹腔鏡聯合及經陰道修復(transvaginal repair,TVR)等,但藥物治療的效果、手術方式的選擇等方面仍存在爭議,有待進一步研究。另外,CSD 發病機制尚待研究,臨床癥狀和輔助檢查無特異性,診療方式尚無統一標準。現綜述國內外研究中剖宮產后CSD 的不同治療方式及預后進展,以期為臨床治療方案選擇及制定提供參考。
1 CSD 保守治療
1.1 激素治療主要采取口服避孕藥治療。口服短效避孕藥經外源激素作用使宮腔和CSD 內的內膜同步發育、脫落,可同時調節內膜雌激素受體、孕激素受體和血管內皮生長因子的表達,修復子宮內膜及止血。在Tahara 等[5]的研究中,11 例CSD 患者通過口服避孕藥治療,有10 例月經淋漓癥狀明顯減輕,表明短期內激素治療可有效緩解CSD 月經淋漓癥狀,但可能出現乳房脹痛及惡心等藥物不良反應。
1.2 宮內節育器置入左炔諾孕酮宮內節育器是一種長效避孕工具,其可以通過不間斷釋放左炔諾孕酮,直接作用于子宮內膜引起子宮內膜變薄及間質萎縮,避免經血潴留所致陰道出血,從而避免月經方式改變。Chen 等[6]的研究中共有6 例與CSD 相關月經經期延長的絕經前患者置入左炔諾孕酮宮內節育器進行保守治療,并隨訪至術后12 個月。在此研究中,6 例患者中有1 例宮內節育器脫落,有2 例在置入后6 個月后出現閉經,3 例的隨訪結果顯示置入1 個月后就能有效縮短月經經期并且緩解癥狀能維持至術后12 個月。
1.3 中藥治療中草藥是傳統中醫治療中最常見的方法之一。研究表明,中草藥與西藥聯合或與外科手術聯合比單獨使用西藥或外科手術能更好地緩解臨床癥狀并且提升生活質量[7]。呂霄等[8]將106 例患者隨機分組,通過對照短效避孕藥(優思悅,40 例)及消炎止血藥(頭孢呋辛酯+氨甲環酸,23 例),研究以活血為主的中藥周期療法(治療組43 例)對CSD的療效,結果顯示用藥1 個月后短效避孕藥組總有效率高于中藥治療組及消炎止血藥組(P<0.05),用藥3 個月后短效避孕藥組與中藥治療組總有效率比較差異無統計學意義(P>0.05),均高于消炎止血藥組,停藥3 個月后中藥治療組、短效避孕藥組和消炎止血藥組總有效率分別是51.16%、36.11%、15.00%,復發率分別是18.52%、37.50%、60.00%,結果表明中藥周期療法具有安全性高、臨床療效較好和不良反應小等遠期療效優勢。中醫治療雖能有效縮短月經經期時間,改善患者的臨床癥狀,但由于憩室的存在,仍易導致陰道反復出血,再次妊娠仍存在風險[9]。
目前對于臨床癥狀較輕、無生育要求的女性可以采取上述保守治療,但需注意的是因上述療法未使CSD 恢復原有的解剖結構,故雖在一定程度上能緩解月經經期延長的癥狀,但遠期效果不理想,長期服藥不良反應明顯,部分患者用藥依從性不足,停藥后相關癥狀也會再次出現。放置宮內節育器可導致患者長期月經量減少易引發閉經,不適合育齡期女性尤其是有再次生育要求的女性[10]。
2 CSD 手術治療
2.1 宮腔鏡手術宮腔鏡檢查可以改善宮腔環境、通過移除憩室瘢痕上下瓣促進憩室血腫的清除,能一定程度上緩解CSD 患者月經淋漓的癥狀[11],通過改善宮腔環境可以增加不孕患者的再次妊娠率[12],且相對手術簡單、住院時間短、費用成本低,但其未在解剖上修復憩室,CSD 患者的瘢痕部位子宮殘余肌層厚度未改善,再次妊娠時仍存在子宮破裂、憩室妊娠的風險。Shapira 等[13]對67 例CSD 患者行宮腔鏡廣泛CSD 切除,其中有42 例(63.4%)患者表示月經經期延長癥狀獲得明顯改善或完全緩解。另一項研究結果表明,與腹腔鏡手術相比,宮腔鏡手術治療CSD 平均手術時間明顯縮短(71.0 min vs.30.9 min,P<0.001),術中出血量和住院時間明顯減少(P<0.001)[14]。對于月經經期延長癥狀較嚴重、殘余子宮肌層厚度較厚(>3 mm)、無生育要求的女性可選擇宮腔鏡治療。
該手術步驟:手術前1 天可陰道后穹隆置入0.4 mg 米索前列醇軟化宮頸。手術前患者排空膀胱后行膀胱截石位,采取全身麻醉或硬膜外麻醉。手術中,首先使用外徑4.5~5 mm 的宮腔鏡觀察整個宮腔,確定子宮瘢痕憩室位置,隨后使用8 mm 電切鏡切割環電極切除憩室上部或(和)下部邊緣的瘢痕瓣,暴露整個憩室底部,通過球形電極電凝憩室內殘留的內膜組織。具體手術方式可參考Sanders 等[15]的視頻演示。見圖1。

圖1 宮腔鏡治療CSD 的手術步驟示意圖
Zeller 等[16]在宮腔鏡治療過程中使用干燥棒切除CSD 纖維或炎性組織后,繼續將CSD 整個表面進行干燥,另外,使用的擴張液是具有雙極性能量的等滲鹽水。Zou 等[17]的宮腔鏡治療選擇連續灌注宮腔鏡,使用5%甘露醇在80~100 mmHg(1 mmHg=0.133 kPa)的擴張壓力下進行,擴張后使用8 mm 電切鏡切除瘢痕組織并修剪下緣組織以促進血液流動,通過宮腔鏡使用球形電極對子宮表面整個憩室部位進行淺表燒灼。Casadio 等[18]在宮腔鏡治療中使用16 Fr迷你電切鏡,可在不進行宮頸擴張術且無解剖學缺陷畸變的情況下進行手術,從而降低了并發癥的風險。該研究對比了154 例使用16 Fr 迷你電切鏡(研究組)和155 例使用26 Fr 電切鏡(對照組)治療CSD的手術效果,結果顯示,與對照組相比,16 Fr 迷你電切鏡的總手術時間較短,術后并發癥發生率較低(P=0.01),且研究組患者術后滿意度顯著高于對照組(P<0.001)。
2.2 腹腔鏡手術對于月經經期延長癥狀較嚴重、殘余子宮肌層厚度較薄(≤3 mm)、有生育要求的女性,腹腔鏡手術是有效的修復方法。腹腔鏡治療可以在解剖上修復CSD,既能緩解患者月經淋漓癥狀,又能增加子宮殘余肌層厚度,從而提高不孕患者術后妊娠率。腹腔鏡術中視野暴露充分,更易找到子宮下段憩室薄弱處,但具體定位憩室、精準切除相對困難,有時需結合宮腔鏡輔助,可能存在瘢痕憩室切除不完全、手術修復效果不佳的風險,另外相對住院時間延長、手術費用增加、手術并發癥發生的風險增加。Donnez 等[3]對38 例子宮肌層厚度<3 mm 有癥狀的CSD 患者進行腹腔鏡修復,結果顯示經腹腔鏡修復后33 例臨床癥狀明顯緩解,18 例不孕患者中8 例(44%)再次妊娠。
該手術步驟:確定關鍵的解剖標志,暴露手術區域。經臍孔置鏡,建立人工氣腹,腹腔鏡下打開峽部區域的臟腹膜層,形成膀胱子宮腔,并從膀胱的下邊緣將膀胱向下推至少2 cm,從而分離子宮和膀胱之間的粘連,使膀胱遠離子宮,以便更好地暴露憩室。隨后腹腔鏡下完整切除憩室部分并進行縫合。具體手術方式可參考Setúbal 等[19]的手術視頻演示。見圖2。
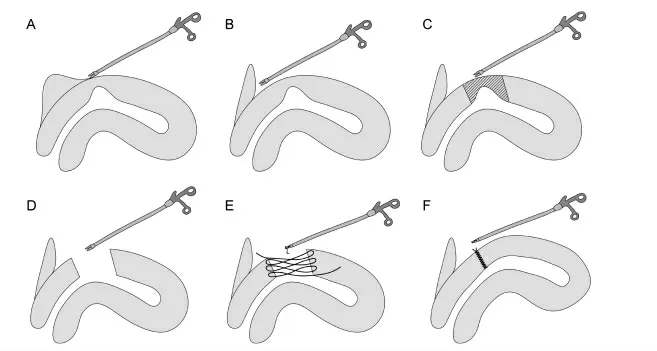
圖2 腹腔鏡治療CSD 的手術步驟示意圖
Zhao 等[20]使用Foley 導管輔助腹腔鏡修復CSD,可以更好地幫助識別和定位CSD,有助于降低腹腔鏡修復CSD 產生的并發癥和出血的風險。近年單孔腹腔鏡技術日趨成熟,可應用于多種婦科手術。Ma等[21]通過單孔腹腔鏡修復CSD,通過臍部單切口進入腹腔,分解膀胱腹膜反折粘連確定CSD 位置后,使用剪刀切除CSD 瘢痕組織,避免使用熱能以防止損傷,患者月經經期延長及骨盆疼痛癥狀明顯緩解,臍部傷口愈合良好,美容效果良好。
2.3 TVR近年研究發現經陰道修復CSD 可成為最可行、安全、有效的手術方式,其微創、手術效果佳、手術創面小,能準確定位CSD 位置并完整切除[22],能在解剖上修復憩室部位,有效改善子宮殘余肌層厚度,為女性提供再次生育的可能性。另外其設備簡單、住院費用較低、患者恢復快,可降低腹盆腔其他臟器的手術受損風險,對于月經經期延長癥狀較嚴重、殘余子宮肌層厚度較薄(≤3 mm)、有生育要求的女性,經陰道修復CSD 可成為首選手術方式。Zhang等[23]對67 例CSD 患者(31 例行TVR,36 例腹腔鏡修復)進行手術后研究發現,與腹腔鏡修復后比較,TVR后月經持續時間明顯縮短(P<0.001)、術后殘余肌層厚度均明顯增加(P<0.001),TVR 組的手術時間和醫療費用均低于腹腔鏡修復組(P<0.001)。在另一項對51 例殘余肌層厚度<3 mm 且不孕的CSD患者的研究中,有26 例(50.98%)成功妊娠,其中6例流產,20 例成功分娩健康嬰兒,表明TVR 可以達到令人滿意的產科預后[24]。
該手術步驟:患者排空膀胱后行膀胱截石位,采取全身麻醉和(或)硬膜外麻醉。將小陰唇固定在兩側的外側皮膚上,置入陰道拉鉤,充分暴露宮頸,宮頸鉗鉗夾宮頸上唇,充分暴露陰道前穹隆部位。在膀胱下切一個0.5 cm 的帶狀切口,并將陰道壁切開,分離膀胱和子宮頸之間的空間,直到膀胱腹膜反折(嚴重粘連的患者可開放腹膜)。子宮峽部可見上次剖宮產切口瘢痕,5 號宮頸擴張棒或探針用作引導物,同時另一根手指觸摸憩室缺損有凹陷感處,考慮為CSD 位置。將CSD 在最薄的區域垂直打開直至宮腔內,切除瘢痕組織,清除凝血塊和血液,在探針引導下縫合切口。手術完成后,放置碘仿紗布條,留置導尿管。見圖3。

圖3 經陰道修復CSD 的手術步驟示意圖
Deng 等[25]手術中暴露宮頸后,在3 點鐘和9 點鐘宮頸和陰道交界處的膀胱橫溝水平位置注射稀釋的腎上腺素鹽水,施加的水壓有助于分離并擴大陰道黏膜和膀胱之間的間隙,從而推動膀胱的下緣。另外,腎上腺素可誘導局部小血管收縮,降低了陰道黏膜切口的出血風險。該研究共183 例患者接受了TVR,月經狀況改善率為82.41%,骨盆疼痛緩解率為81.08%,124 例術后成功受孕,表明TVR 可有效改善癥狀并增加成功妊娠的可能性。
2.4 宮腹腔鏡聯合治療Lu 等[26]和Vigueras Smith等[27]展示了通過宮腹腔鏡聯合治療CSD 的手術視頻。主要手術步驟為腹腔鏡分離膀胱子宮粘連并下推膀胱暴露憩室后,降低腹腔鏡照明強度,通過宮腔鏡光源直接指向憩室頂端來定位憩室位置,確定憩室瘢痕的上下邊緣,隨后在腹腔鏡下切除所有瘢痕組織及邊緣后進行縫合,完成憩室切除修補手術。宮腹腔鏡聯合可以通過2 個手術視野精確定位,完全暴露CSD 并移除,但相對手術時間長、手術費用高。
Zhao 等[28]通過宮腔鏡透射率測試和Foley 導管輔助使用腹腔鏡治療CSD。使用宮腔鏡透射率測試確定CSD 的部位和大小,將Foley 導管通過宮頸管插入憩室中,既可以標記切除部位,也可以通過局部壓縮來止血。隨后腹腔鏡下沿外緣切除憩室,進行縫合,最后進行第2 次宮腔鏡透射率測試以驗證修復效果。這種輔助方式可完全切除憩室,并且縫合準確,適用于憩室壁薄和憩室腔大的患者。Guan 等[29]的研究中,機器人技術在宮腔鏡輔助CSD 切除中具有一定的優勢,機器人的使用使得該操作更容易。
2.5 宮腔鏡輔助TVRCandiani 等[22]先使用宮腔鏡確認CSD 的位置,并評估病變的大小和形態。取出宮腔鏡后,進行經陰道修復CSD 手術,切口縫合后再次通過宮腔鏡探查,觀察是否殘存憩室。Zhou 等[30]對比了63 例CSD 患者(28 例采用宮腔鏡電灼修復CSD,35 例采用宮腔鏡輔助經陰道修復CSD)手術效果,宮腔鏡輔助TVR 組術后子宮殘余肌層厚度明顯大于宮腔鏡電灼組[(9.8±1.0)mm vs.(3.3±0.7)mm,P<0.05],宮腔鏡輔助TVR 組術后患者再生育足月活產率明顯高于宮腔鏡電灼組(92% vs.46%,P<0.05)。
2.6 單孔腹腔鏡輔助TVRZhang 等[31]的研究中使用單孔腹腔鏡輔助TVR,首先在單孔腹腔鏡下分離子宮和膀胱之間的粘連,然后將膀胱沿宮頸向下推至宮頸外部的邊緣,最后進行陰道手術。該研究對74 例患者(37 例作為研究組行單孔腹腔鏡輔助TVR,37 例作為對照組行單純TVR)進行手術效果研究,發現2 組的排氣時間(P=0.012)、住院時間(P=0.019)和并發癥(P=0.039)差異有統計學意義,術中對照組發生并發癥4 例,均為膀胱損傷。可見,單孔腹腔鏡可在直視下分離粘連,避免了陰道手術的弱點,降低了膀胱損傷的風險,適用于合并子宮與周圍臟器重度粘連的患者。
目前影響手術治療CSD 效果的因素尚不明確[32],有研究表明子宮位置對于TVR 的手術效果有明顯影響,子宮后位的CSD 患者可獲得更好的手術效果[33]。Xu 等[34]研究發現無論是通過腹腔鏡手術還是經陰道手術,重復剖宮產是瘢痕修復效果差的危險因素(OR=9.75,95%CI:2.30~41.36,P=0.002)。Sammour等[35]研究發現α-硫辛酸(alpha lipoic acid,ALA)具有抗氧化和抗炎作用,剖宮產術后6 周內口服ALA 可促進子宮瘢痕愈合,降低CSD 的發生率。未來需要進一步研究來證實影響手術修復效果的因素,從而提高手術修復CSD 成功率,為患者制定個體化手術方案提供理論依據。
3 結語
隨著世界范圍內剖宮產率的增加,剖宮產術后CSD 不僅影響患者的生活質量,還增加了再次妊娠的風險,同時可能引起繼發性不孕,影響了育齡期女性生殖健康。目前對于CSD 的治療尚無統一標準,對于癥狀較輕或無生育要求的女性可采取藥物或宮內節育器保守治療,對于臨床癥狀較嚴重且有生育要求的女性,可選擇手術修復包括宮腔鏡、腹腔鏡、TVR、宮腹腔鏡聯合、宮腔鏡輔助TVR 和腹腔鏡輔助TVR 等。由于CSD 發病原因及機制尚在研究中,患者臨床癥狀存在差異,為此需結合患者的癥狀、病史和經濟條件等采取合理的治療方式,從而提高女性生殖健康水平。

