羥氯喹對類風濕關節炎患者血糖影響的研究進展
胡冬霞,姚瑤,葛衛紅*,于鋒(.中國藥科大學南京鼓樓醫院,南京 20008;2.中國藥科大學基礎醫學與臨床藥學學院,南京 20009)
羥氯喹(hydroxychloroquine)是一種弱堿性的4-氨基喹啉化合物[1],于1944年首次合成[2],與氯喹化學結構相似,但不良反應明顯減少,1955年經美國食品藥品監督管理局批準用于臨床[3],最初作為抗瘧藥物使用。在第二次世界大戰中發現羥氯喹對風濕病具有緩解癥狀的作用[4],此后廣泛用于治療風濕免疫疾病,如類風濕關節炎(rheumatoid arthritis,RA)、系統性紅 斑狼 瘡(systemic lupus erythematosus,SLE)等。《2018 中國類風濕關節炎診療指南》[5]建議將羥氯喹與其他改善病情的抗風濕藥物(diseasemodifying antirheumatic agents,DMARDs)聯 合使用治療RA;國內一項大型多中心回顧性研究顯示,羥氯喹在RA 患者中療效顯著,且總體不良反應發生率低[6]。隨著科學研究的發展,人們發現除抗炎、免疫調節作用外,羥氯喹還具有降低血糖的作用:1999年Shojania 等[7]首次報道羥氯喹在關節炎患者中可引起低血糖反應,自此,羥氯喹對RA 患者血糖的影響逐漸進入研究者視野。本文就羥氯喹對RA 患者血糖代謝影響的研究進展進行綜述。
1 RA 患者血糖代謝異常的原因和機制
1.1 危險因素
1950年Jarvinen[8]首次研究RA 與糖尿病之間的關系,此后多項研究顯示RA 患者血糖異常發病率高于一般人群:加拿大一項大型研究顯示RA 患者的糖尿病發病率為0.86%,是一般人群的1.5 倍[9];墨西哥一項研究顯示RA 患者胰島素抵抗發病率顯著高于一般人群(50.5%vs10.0%,P<0.001)[10];意大利一項研究顯示RA 患者空腹血糖受損、糖尿病發病率均顯著高于一般人群(20.4%vs12.4%,P=0.001;13.6%vs8.4%,P=0.01)[11];美國一項研究顯示RA 患者高血糖、胰島素抵抗、糖尿病發病率均高于一般人群(35%vs22%,P=0.11;58%vs19%,P<0.001;12%vs4%,P=0.10)[12]。其中RA 患者新發糖尿病風險不僅與年齡、肥胖、吸煙、飲酒、缺乏運動、糖尿病家族史等傳統危險因素有關,還與全身炎癥、疾病活動度、糖皮質激素(以下簡稱“激素”)及DMARDs 的使用密切相關[13-14]。
1.2 RA 致高血糖的機制
RA 致高血糖可能與炎癥狀態引起胰島素抵抗有關[15]。RA 病理特征為關節滑膜慢性炎癥性增生,關節液和滑膜中有大量的自身反應性T細胞和炎癥細胞浸潤,自身反應性T 細胞在外周由外源性抗原或改變的自身抗原所活化,從而導致促炎細胞因子如白介素-1(IL-1)、白介素-6(IL-6)、腫瘤壞死因子-α(TNF-α)分泌增多[16]。研究表明,在RA 患者中穩態模型胰島素抵抗指數(homeostasis model assessment of insulin resistance,HOMA-IR)與IL-6(r=0.63,P<0.001)、TNF-α(r=0.50,P<0.001)、C反應蛋白(r=0.29,P=0.001)、紅細胞沉降率(r=0.26,P=0.002)成顯著正相關,提示IL-6、TNF-α水平升高與胰島素抵抗密切相關[17]。
1.2.1 IL-6 與胰島素抵抗 IL-6 可能通過以下作用機制促進胰島素抵抗:① 通過Janus 激活蛋白激酶/信號傳導子及轉錄激活子(Janus-activated protein kinase/signal transducer and activator of transcription,Jak/STAT)途徑激活胰島素信號通路的抑制劑(suppressor of cytokine signalling,SOCS),從而抑制胰島素受體-1(insulin receptor substrate-1,IRS-1)的酪氨酸磷酸化;② 降低葡萄糖轉運蛋白(glucose transporter 4,GLUT4)表達;③ 通過急性轉化逆轉錄病毒/哺乳類雷帕霉素靶蛋白(acute transforming retrovirus thymoma/mammalian target of rapamycin,Akt/mTOR)途徑使IRS-1 的絲氨酸磷酸化,導致細胞產生胰島素抵抗和胰島素信號傳導受損;④ 降低脂肪細胞胰島素敏感性脂肪因子——脂聯素的表達[18]。
1.2.2 TNF-α與胰島素抵抗 TNF-α可能通過以下作用機制促進胰島素抵抗:① 誘導合成SOCS;② 降低IRS-1 和GLUT4 的表達;③ 刺激脂肪組織脂解,并增加游離脂肪酸的濃度,從而抑制胰島素的細胞作用;④ 降低脂聯素的循環水平;⑤以肌肉為代價增加脂肪量,從而促進胰島素抵抗的發展[14]。
1.3 治療RA 相關藥物對血糖的影響及機制
治療RA 藥物主要包括以下幾類:激素、DMARDs、非甾體抗炎藥、生物靶向制劑、植物藥,其中激素、環孢素、他克莫司有升高血糖的作用;羥氯喹、甲氨蝶呤、來氟米特、柳氮磺吡啶、TNF-α抑制劑、IL-1 受體拮抗劑、IL-6 受體拮抗劑有降低血糖的作用。
1.3.1 藥物升高血糖的作用機制 一項納入41 例早期活動性RA 患者的隨機、對照、單盲試驗表明接受大劑量激素治療1 周后,新發2 型糖尿病患者的人數從7% 增加到24%[19]。一項納入3267 名RA 患者的關于他克莫司安全性和有效性的上市后監測研究顯示:糖尿病是他克莫司常見的不良反應之一(1.5%)[20]。一項關于使用DMARDs 與風濕病患者新發糖尿病風險之間的相關性研究表明:環孢素的使用可增加RA 患者新發糖尿病風險(HR=1.14,95%CI0.77~1.70)[21]。
激素導致高血糖的主要機制包括:誘導β細胞衰竭、減少外周組織攝取葡萄糖、增加胰島素抵抗和糖異生以及抑制胰島β細胞生成和分泌胰島素[22]。他克莫司影響血糖的機制可能包括:與FKBP12(FK506-binding protein 12)及Ryanodine受體結合,阻斷胰島β細胞中的鈣調磷酸酶,影響胰島素合成、葡萄糖刺激的胰島素分泌以及β細胞存活[23]。環孢素對胰島細胞的影響較輕,它影響血糖的機制可能包括:減少胰島素mRNA 表達;抑制胰島素分泌;誘導胰島素抵抗,從而損害β細胞功能[24-25]。
1.3.2 藥物降低血糖的作用機制 來氟米特[26]、柳氮磺吡啶[26]、IL-6 受體拮抗劑(如托珠單抗)[27]和IL-1 受體拮抗劑(如anakinra)[28]可以改善RA患者的血糖;而生物制劑TNF-α抑制劑(如英夫利昔單抗、阿達木單抗、依那西普)[29-30]、甲氨蝶呤[31]及羥氯喹不僅可改善血糖,還可以減少2 型糖尿病的發病風險[32]。
上述藥物影響血糖的機制各不相同:① 來氟米特、甲氨蝶呤、TNF-α拮抗劑通過增加組織對葡萄糖的攝取來降低血糖[33-34];② 柳氮磺吡啶[35]、IL-6 受體拮抗劑[27]、IL-1 受體拮抗劑[28]通過改善胰島素抵抗來降低血糖;③ 羥氯喹則是通過抑制胰島素代謝、延長胰島素作用時間、增加胰島素敏感性、抑制肝臟糖異生來降低血糖[36-37]。
綜合上述因素,RA 患者并發高血糖的風險增加,經常需要合用降糖藥物,增加了患者的經濟負擔及聯合用藥的風險,而羥氯喹在上述降低血糖的DMARDs 中因其安全、價廉的特點,作為一種輔助藥物可能有助于改善RA 聯合糖尿病患者的血糖水平[38],因此研究羥氯喹對RA 患者的血糖代謝調節作用具有重要意義。
2 羥氯喹的降糖作用及機制
2.1 羥氯喹對無糖尿病RA 患者血糖的影響
研究指出羥氯喹可導致無糖尿病RA 患者出現低血糖不良反應,但此類報道較少[39-40]。一項橫斷面研究表明,在非糖尿病RA 女性患者中,經校正傳統心血管風險因素、疾病活動度及激素使用后,使用羥氯喹的患者空腹血糖低于未使用羥氯喹的患者(82.5 mg·dL-1vs86.6 mg·dL-1,P=0.05)[41]。同時,一項涉及4905 例RA 患者的前瞻性多中心觀察性研究表明:與未使用羥氯喹患者相比,使用羥氯喹患者糖尿病發生風險降低38%(HR=0.62,95%CI0.42~0.92);而使用羥氯喹超過4年的患者糖尿病發生風險降低77%(HR=0.23,95%CI0.11~0.50)[42]。研究進一步顯示,在RA 患者中,相比TNF-α拮抗劑與甲氨蝶呤,羥氯喹可顯著降低新發糖尿病風險[43],而且羥氯喹合用TNF-α拮抗劑后預防糖尿病效果增加(HR=0.49,95%CI0.36~0.66)[21]。
2.2 羥氯喹對有糖尿病患者血糖的影響
羥氯喹同樣可導致有糖尿病RA 患者出現低血糖不良反應,但此類報道較少[8]。馮樂恒等[44]研究顯示,相比胰島素聯合甲氨蝶呤治療RA 組,羥氯喹聯合胰島素、甲氨蝶呤治療RA 組空腹血糖、餐后2 h 血糖、糖化血紅蛋白、HOMA-IR 值顯著下降,穩態模型胰島素分泌指數(homeostasis model assessment of estimatedsteady-state beta cell function,HOMA-β)值顯著升高。杭元星等[45]研究顯示,相比二甲雙胍聯合甲氨蝶呤治療RA 組,羥氯喹聯合二甲雙胍、甲氨蝶呤治療RA 組空腹血糖、餐后2 h 血糖、糖化血紅蛋白均顯著降低,且呈現劑量依賴性。研究進一步顯示,與甲氨蝶呤相比,羥氯喹可顯著降低RA 患者糖化血紅蛋白水平(-0.66%vs-0.11%,P=0.041),且羥氯喹合用甲氨蝶呤、柳氮磺吡啶后,降低糖化血紅蛋白作用增強[46]。近年有多項研究表明,在難治性2 型糖尿病患者原有胰島素或口服降糖藥治療方案中加用羥氯喹后,空腹血糖、餐后血糖、糖化血紅蛋白均顯著下降,表明羥氯喹具有作為三線藥物治療血糖控制不佳2 型糖尿病患者的潛力。綜上,在使用胰島素或口服降糖藥基礎上,合用羥氯喹可輔助降低RA 合并糖尿病患者的血糖水平[47-49]。
2.3 羥氯喹對使用/未使用激素患者血糖的影響
多項研究表明羥氯喹在使用/未使用激素RA患者中都表現出降低血糖、糖化血紅蛋白,升高HOMA-β的作用,且羥氯喹在使用激素RA 患者中可顯著降低空腹血糖,而在未使用激素RA 患者中可顯著升高HOMA-β[41](見表1)。這提示在RA 患者使用激素的同時加用羥氯喹,可能有助于減少激素所致高血糖的不良反應,但仍需進一步研究證實。
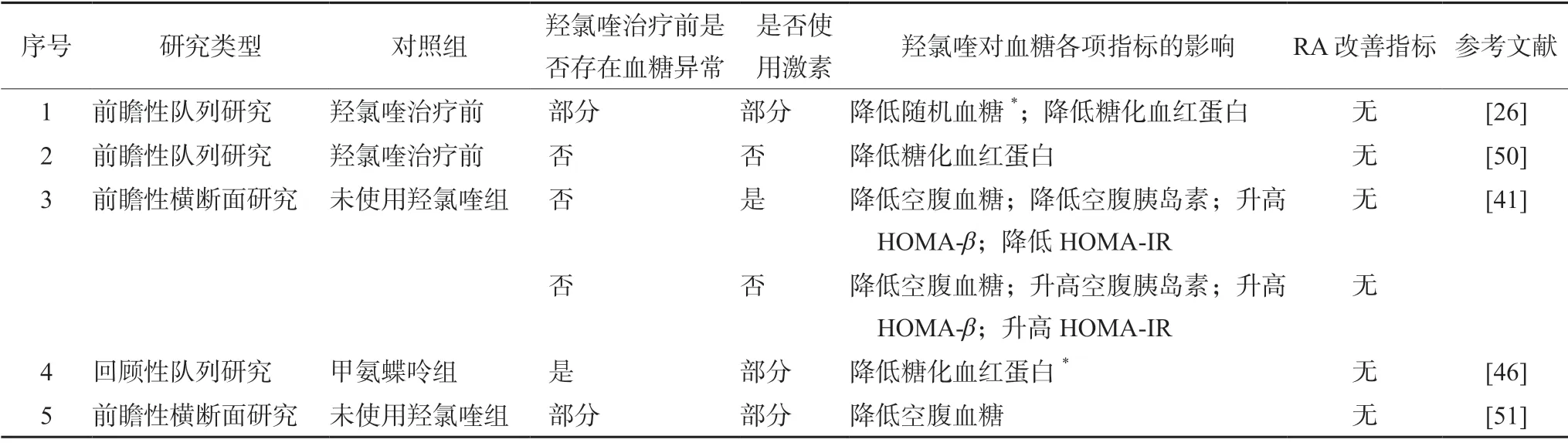
表1 羥氯喹對使用/未使用激素RA 患者血糖的影響Tab 1 Effect of hydroxychloroquine on blood glucose in RA patients with or without glucocorticoid
2.4 羥氯喹降血糖的作用機制
2.4.1 增加胰島素水平 一項隨機、雙盲、對照試驗[52]表明羥氯喹可以通過增加糖尿病前期患者的血清胰島素水平來有效降低血糖水平。另有研究發現羥氯喹以濃度依賴方式增加糖尿病大鼠體內胰島素濃度,降低血糖水平,其機制可能與羥氯喹抑制大鼠肝細胞胞漿胰島素代謝酶從而減少胰島素代謝有關[37,53]。由此可見,羥氯喹增加胰島素水平可能與胰島素代謝減少有關。
2.4.2 減少胰島素抵抗
① 增加IRS-1 和Akt 的磷酸化:胰島素可通過激活其受體的酪氨酸激酶活性,從而使包括IRS-1 在內的各種底物磷酸化;磷酸化的IRS-1與其他蛋白質相互作用,通過蛋白激酶B(Akt)的磷酸化觸發胰島素信號傳導途徑,從而刺激細胞生長、葡萄糖轉運、糖異生、糖原合成和蛋白質合成。動物研究表明羥氯喹可顯著增加高脂飲食大鼠肝組織中IRS-1 和Akt 的磷酸化[54],因此,推測羥氯喹改善胰島素抵抗可能與增加IRS-1 和Akt 的磷酸化有關。
② 增加脂聯素水平:脂聯素是一種表達豐富的脂肪因子,可以抑制肝臟糖異生;調節食物攝入量和能量消耗;刺激胰島素分泌;刺激骨骼肌中的葡萄糖攝取。它通過結合脂聯素受體1(AdipoR1)和脂聯素受體2(AdipoR2)發揮胰島素增敏作用。在肥胖相關的胰島素抵抗中,脂聯素和脂聯素受體均被下調,而羥氯喹可升高肥胖和胰島素抵抗的動物模型中下調的脂聯素水平[55]。除此之外,一項隨機、雙盲、對照試驗也發現羥氯喹可顯著升高胰島素抵抗的非糖尿病個體的脂聯素水平[42]。因此,推測羥氯喹可能通過增加脂聯素水平來改善胰島素抵抗。
③ 降低IL-6、TNF-α水平:RA 患者中導致胰島素抵抗的主要炎癥因子是血清IL-6 和TNF-α[56],而羥氯喹可降低多種炎性細胞因子的水平,包括單核細胞分泌的IL-1、IL-2、IL-6 和TNF-α[57]。因此,推測羥氯喹可以通過降低IL-6、TNF-α水平來改善胰島素抵抗。
④ 調節內皮功能障礙和脂肪因子的平衡:除上述機制外,也有研究表明羥氯喹改善胰島素抵抗的作用可能與調節內皮功能障礙和脂肪因子的平衡有關:與未使用羥氯喹高脂飲食小鼠相比,使用羥氯喹高脂飲食小鼠空腹血糖、HOMA-IR水平均顯著下降(P<0.05),其機制可能與羥氯喹降低高脂飲食小鼠的內皮黏附因子[包括可溶性E 選擇素(sE-selectin)、可溶性細胞間黏附分子-1(sICAM-1)和可溶性血管細胞黏附分子-1(sVCAM-1)]在血清中的水平及脂肪細胞因子(包括瘦素、抵抗素、內脂素、脂蛋白-2)在血清和內臟脂肪組織中的水平有關[57],但是具體機制尚需進一步研究確證。
3 結語
對糖尿病或非糖尿病RA 患者,羥氯喹都表現出改善血糖的作用,且表現出以下特點:① 對于RA 合并糖尿病患者,羥氯喹與胰島素或口服降糖藥合用可改善血糖控制;② 與甲氨蝶呤、TNF-α拮抗劑相比,羥氯喹可顯著改善血糖,與甲氨蝶呤、TNF-α拮抗劑合用后降糖效果增加;③ 羥氯喹在使用/未使用激素RA 患者中均具有降低血糖及糖化血紅蛋白水平的作用,提示在RA 患者使用激素的同時加用羥氯喹,可能有助于減少激素所致的高血糖不良反應。因此在沒有禁忌證的情況下,推薦合并糖尿病或使用激素的RA 患者合用羥氯喹,以增加血糖代謝益處。

