黃芩苷改善慢性腦低灌注大鼠認知障礙的作用及機制研究
陳景,楊磊,左亞杰,張琴,彭詞艷(.湖南省中醫藥大學第一附屬醫院制劑部,長沙 40007;2.中南大學湘雅二醫院藥學部,長沙 400)
慢性腦低灌注(chronic cerebral hypoperfusion,CCH)又稱為慢性腦缺血,它是指由各種原因引發的長期腦血流灌注不足。CCH 可導致腦關鍵部位(尤其是海馬CA1 區)缺血缺氧,誘發遲發性神經元損害,進而引起認知障礙[1]。因此,CCH被認為是造成血管性癡呆(vascular dementia,VaD)的一個主要誘因[2]。VaD 是繼阿爾茨海默癥之后最常見的一種癡呆類型,目前尚無有效的治療藥物[3]。借助CCH 模型,大量研究對VaD 的發生發展進行了探討,但其詳細機制仍未完全闡明。因此,通過CCH 模型研究VaD 的發病機制、尋找有效的治療藥物仍是一個亟待解決的問題。
黃芩苷是從黃芩干燥根中提取分離出來的一種黃酮類化合物,在中樞神經系統中顯示出多種藥理活性[4]。動物研究顯示黃芩苷對局灶性腦缺血損傷具有保護作用,其機制主要是通過抗氧化實現的[5]。然而,黃芩苷能否改善CCH 所致的認知損傷,以及其所涉及的分子機制,目前尚未見報道。因此,本研究擬觀察黃芩苷對CCH 所致認知障礙的作用,并探討其機制,從而為VaD 的臨床治療提供可靠依據。
1 材料
1.1 動物
SD 雄性大鼠90 只,體質量180~200 g [湖南斯萊克景達實驗動物有限公司,許可證號:SCXK(湘)2016-0002,質量合格證號:43004700042552]。大鼠自由飲水攝食,隨機分籠飼養。飼養環境溫度(25±2)℃,光照遵循明暗交替12/12 h 的節律。所有實驗操作均遵循國際衛生研究機構關于動物使用倫理學方面的原則。
1.2 試藥及儀器
黃芩苷(批號:021608102,Sigma 公司,純度≥95%)。水合氯醛(批號:20170302,天津市科密歐化學試劑有限公司),烏拉坦(批號:51-79-6,上海山浦化工有限公司)。神經元核(NeuN)抗體(批號:ab177487)、突觸素(SYP)抗體(批號:ab32127)(Abcam 公司),磷酸化核因子E2相關因子2(p-Nrf2)抗體(批號:LM-2013R,上海聯邁生物工程有限公司),血紅素加氧酶-1(HO-1)抗體(批號:10701-1-AP,Proteintech),內參甘油醛-3-磷酸脫氫酶(GAPDH)抗體(批號:cw0100,Cwbiotech 公司)。谷胱甘肽過氧化物酶(GSH-Px)試劑盒、超氧化物歧化酶(SOD)試劑盒、丙二醛(MDA)試劑盒(南京建成生物工程研究所)。水迷宮實驗記錄分析系統(MT-200,成都泰盟科技有限公司),電生理在體場電位記錄分析系統(RM6240BD,成都儀器廠),凝膠電泳儀(DYY-8C,北京六一儀器廠)。其余試劑均為市售分析純。
2 方法
2.1 CCH 模型建立
采用雙側頸總動脈結扎手術建立大鼠CCH模型。術前大鼠禁食12 h,禁食后大鼠腹腔注射350 mg·kg-1水合氯醛麻醉,小心分離雙側頸總動脈,剝離迷走神經。用手術線分別在雙側頸總動脈的遠心端與近心端進行雙結扎,將兩個結扎點之間血管剪斷。假手術組大鼠不結扎和剪斷血管,其他操作同上。整個實驗過程中保持大鼠體溫在36~38℃。手術過程中,大鼠的雙側頸總動脈血管被剪斷,故最終納入觀察的大鼠均默認為缺血成功。
2.2 動物分組及給藥
18 只大鼠在雙側頸總動脈結扎造模后死亡。剩余大鼠按隨機數字表法分為6 組,即假手術組、模型組、缺血+黃芩苷低劑量組(50 mg·kg-1)、缺血+黃芩苷中劑量組(100 mg·kg-1)、缺血+黃芩苷高劑量組(200 mg·kg-1)、假手術+黃芩苷組(100 mg·kg-1),每組12 只。黃芩苷溶液用生理鹽水配制,于造模1 周后開始灌胃給藥,給藥劑量參考文獻方法[6],每日一次,持續給藥2 周。
2.3 水迷宮實驗
在造模后的第14~19日采用水迷宮實驗評價大鼠的空間學習記憶。將大鼠置于水迷宮中進行連續5 d 的定位航行訓練讓其尋找平臺,每日4 次,每次間隔約10 min。每次實驗大鼠共游泳60 s 來尋找隱藏的平臺,若大鼠在60 s 內找到平臺,記錄該時間為逃逸潛伏期,并讓其在平臺上停留10 s;若大鼠在60 s 未找到平臺,其逃逸潛伏期默認為60 s,并人工誘導大鼠至平臺上停留10 s。于第6日將平臺移去進行探索實驗,記錄大鼠60 s 內在目標象限所待的時間。逃逸潛伏期用以評價大鼠的學習能力,目標象限所待時間用以評價大鼠的記憶功能。
2.4 新事物認知實驗
在造模后的第20日采用新事物認知實驗評價大鼠的非空間學習記憶。實驗裝置由一個開口木制敞箱(50 cm×50 cm×90 cm)組成。在實驗前一日,將大鼠放置木箱中探索5 min 以適應環境。第2日為正式實驗,由間隔1 h 的兩個階段組成。第一階段,將一個棕色木制正方體(邊長5 cm)與黑色橡膠圓錐體(底面直徑5 cm,高5 cm)分別放置敞箱的兩個對角。將大鼠從敞箱中間位置放入,讓其自由探索兩個物體。探索行為定義為:大鼠鼻尖接觸物體或鼻尖指向物體且距離小于1 cm。第一階段實驗中,當大鼠累積探索時間達到20 s 時,將大鼠取出。在第二階段實驗,將黑色橡膠圓錐體(舊事物)換成一個直徑5 cm 的藍色玻璃球(新事物),記錄5 min 內大鼠探索兩個物品各自的時間。數據分析采用分辨指數對各組大鼠進行比較。分辨指數=(探索新事物的時間-探索舊事物的時間)/(探索新事物的時間+探索舊事物的時間)。
2.5 電生理長時程增強(long-term potentiation,LTP)記錄
新事物認知實驗后的第2日,大鼠用1.5 g·kg-1烏拉坦腹腔注射麻醉后進行海馬Schaffer側枝-CA1 區LTP 的記錄。刺激電極定位:前囟后3.7 mm;旁開3.2 mm;硬膜下2.0 mm;記錄電極定位:前囟后3.3 mm;旁開2.2 mm;硬膜下1.8 mm。選擇誘發最大興奮性突觸后電位(EPSPs)幅度40%所對應的電壓強度作為基礎刺激,刺激間隔30 s,頻率0.3 Hz。記錄基線20 min 后,采用高頻高強刺激誘導LTP,參數為:連續4 串脈沖,每串脈沖間隔5 min,每串脈沖持續1 s,頻率100 Hz;刺激強度為最大EPSPs 幅度80%所對應的電壓強度。高頻高強刺激后休息5 min,然后將刺激參數調為與基礎刺激一致,繼續記錄1 h。將高頻高強誘導后的EPSPs 平均值與誘導前基線平均值進行標準化,比較標準化后各組間誘導后的平均值。
2.6 大鼠海馬CA1 區NeuN 及SYP 的表達
大鼠LTP 記錄完成后,立馬斷頭取腦分離出海馬CA1 區組織備用。將其中6 只大鼠的組織分別提取總蛋白后,取等量蛋白進行凝膠電泳,電泳分離完成后轉印至PVDF 膜上。經脫脂奶粉封閉后,4℃孵育NeuN 抗體、SYP 抗體、p-Nrf2 抗體、HO-1 抗體及內參GAPDH 抗體過夜。次日,將條帶洗滌后孵育相應二抗1 h。孵育完成后,將條帶進行清洗并用ECL 顯影成像。曝光圖像用NIH Image J 對灰度值進行分析,GAPDH 抗體所對應條帶的灰度值作為內參進行校正。統計時將假手術組的灰度值標準化為1,計算各組的相對灰度值。
2.7 腦組織中氧化應激指標檢測
將剩余的6 只大鼠海馬CA1 區組織稱重后置于9 倍質量的生理鹽水中,冰浴制備勻漿。離心后取上清液,按照試劑盒說明書對GSH-Px、SOD 的活性以及MDA 的含量進行測定。
2.8 統計學處理
實驗數據采用SPSS 軟件進行統計分析,用均數±標準差表示。水迷宮實驗中逃逸潛伏期結果采用重復測量雙因素方差分析;多組間比較采用單因素方差分析(ANOVA),組間兩兩比較采用LSD-t檢驗。P<0.05 表示差異有統計學意義。
3 結果
3.1 黃芩苷改善CCH 大鼠空間學習記憶損傷
大鼠定位航行訓練結果如表1和圖1所示,與假手術組大鼠相比,模型組大鼠在第2~5日的逃逸潛伏期明顯延長(P<0.01);給予中、高劑量黃芩苷處理后,缺血大鼠逃逸潛伏期的延長得到了逆轉(P<0.05 或P<0.01)。在探索實驗中,與假手術組大鼠比較,模型組大鼠在目標象限所待時間明顯縮短(P<0.01),給予中、高劑量黃芩苷能顯著延長缺血大鼠在目標象限所待時間(P<0.01)。
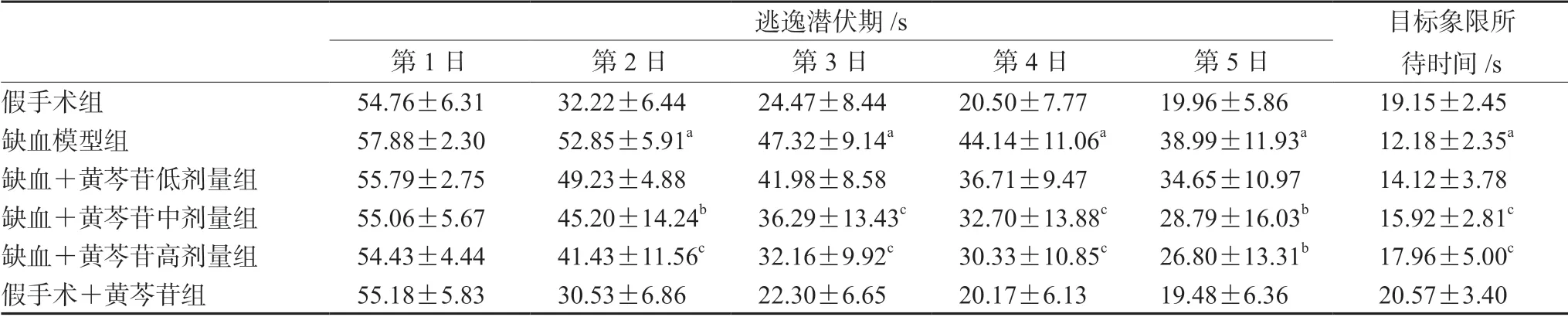
表1 黃芩苷改善CCH 大鼠空間學習記憶損傷(n=12)Tab 1 Baicalin ameliorated the spatial learning and memory impairment induced by CCH in rats (n=12)
圖1 各組大鼠水迷宮實驗典型游泳軌跡圖Fig 1 Typical swimming paths of different groups in the Morris water maze task
3.2 黃芩苷改善CCH 大鼠非空間學習記憶損傷
圖2A 為新事物認知實驗的示意圖。圖2B 結果顯示,與假手術組大鼠相比,模型組大鼠的分辨指數明顯降低(P<0.01)。給予中、高劑量黃芩苷治療能顯著改善腦缺血所引起的分辨指數降低(均P<0.01)。

圖2 黃芩苷對CCH 大鼠非空間學習記憶損傷的影響(n=12)Fig 2 Effect of baicalin on the non-spatial learning and memory impairment induced by CCH in rats(n=12)
3.3 黃芩苷改善CCH 大鼠海馬CA1 區LTP 的抑制
圖3A 為大鼠海馬Schaffer 側枝-CA1 區LTP誘導前后EPSPs 圖。圖3B 顯示,與假手術組大鼠相比,模型組大鼠的LTP 的誘導明顯受到抑制(P<0.01)。給予中、高劑量黃芩苷后能部分逆轉缺血大鼠LTP 誘導的抑制(P<0.05)。

圖3 黃芩苷改善CCH 大鼠海馬CA1 區LTP 的抑制(n=12)Fig 3 Baicalin ameliorated the CCH-induced inhibition on LTP at the CA1 area of the hippocampus in rats(n=12)
3.4 黃芩苷改善CCH 大鼠海馬CA1 區神經元及突觸損傷
為進一步探討黃芩苷改善慢性腦缺血的分子生物學途徑,我們選擇黃芩苷中劑量給藥組進行后續機制分析。如圖4A 及4B 所示,與假手術組大鼠相比,模型組大鼠NeuN 及SYP 的表達顯著降低(P均<0.01)。給予100 mg·kg-1黃芩苷后能顯著上調缺血大鼠NeuN 及SYP 的表達(P均<0.05)。
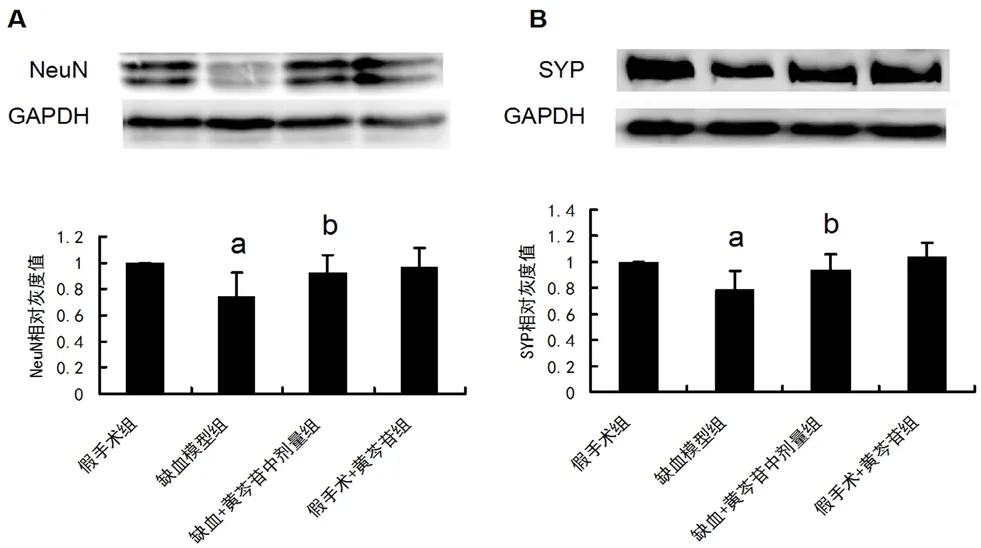
圖4 黃芩苷對CCH 大鼠海馬CA1區NeuN 及SYP 表達的影響(n=6)Fig 4 Effect of baicalin on the expression of NeuN and SYP induced by CCH in hippocampal CA1 area of rats(n=6)
3.5 黃芩苷改善CCH 大鼠海馬CA1 區的氧化應激指標
如表2所示,與假手術組大鼠比較,缺血大鼠海馬CA1 區GSH-Px 及SOD 的活性顯著降低(均P<0.01),MDA 的含量顯著升高(P<0.01);給予100 mg·kg-1黃芩苷后能顯著上調GSH-Px 和SOD 的活性以及降低MDA 的含量(P均<0.05)。

表2 黃芩苷對CCH 大鼠海馬CA1 區氧化應激指標的影響(n=6)Tab 2 Effect of baicalin on the oxidative stress induced by CCH in hippocampal CA1 area of rats (n=6)
3.6 黃芩苷促進CCH 大鼠海馬CA1 區Nrf2/HO-1 信號通路的激活
如圖5所示,與假手術組大鼠相比,模型組大鼠海馬CA1 區p-Nrf2 及HO-1 的表達顯著升高(均P<0.05)。給予100 mg·kg-1黃芩苷后能進一步促進缺血大鼠p-Nrf2 及HO-1 的表達上調(P<0.05,P<0.01)。
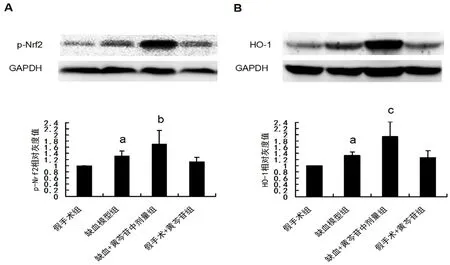
圖5 黃芩苷對CCH 大鼠海馬CA1 區Nrf2/HO-1 信號通路的影響(n=6)Fig 5 Effect of baicalin on the activation of Nrf2/HO-1 signaling pathway in the hippocampal CA1 of rats after CCH(n=6)
4 討論
VaD 是一種年齡相關性的癡呆類型。近年來,隨著人口老齡化進程的加劇,VaD 越來越受到人們的關注,但關于VaD 的發病機制目前還未研究清楚,其治療也尚無批準的有效藥物。因此深入VaD 的研究迫在眉睫。通過雙側頸總動脈結扎手術建立大鼠CCH 模型是研究VaD 最常用的一種模型[2]。借助此模型,本研究發現CCH 能導致大鼠出現顯著的空間及非空間學習記憶損傷,給予中、高劑量黃芩苷(100、200 mg·kg-1)可顯著改善CCH 所致的學習記憶損傷。
LTP 可以從突觸可塑性的角度闡明學習記憶形成的細胞分子機制[7];而神經元和突觸變化可以從結構可塑性的機制闡明學習記憶的改變[8]。本研究通過在體場電位記錄大鼠海馬CA1 區LTP,進一步證實中、高劑量黃芩苷可以改善CCH 所致的學習記憶損傷。并且,黃芩苷改善CCH 所致的學習記憶損傷可能與抑制海馬CA1 區神經元及突觸損傷有關。
事實上,大量研究顯示黃芩苷可以改善腦缺血損傷[9-10],并且對多種模型引起的認知障礙有改善作用[11-12]。黃芩苷改善缺血損傷的一個重要機制是緩解缺血引起的氧化應激[5,10]。氧化應激是由于組織氧化還原的平衡狀態被破壞,從而引起自由基大量聚集、膜脂質破壞、DNA 裂解、蛋白氧化;最終可導致突觸丟失,神經元死亡,突觸可塑性減弱。抑制氧化應激損傷已被充分證實可以減少神經元的丟失和突觸的破壞,改善認知功能[13-14]。GSH-Px活性、SOD 活性降低及MDA 含量通常聯系起來作為評估氧化應激程度的指標。GSH-Px 和SOD 是機體內清除自由基的重要抗氧化酶;而MDA 含量可以間接反映出細胞受自由基損害的程度。本研究發現給予黃芩苷后能顯著逆轉CCH 引起的GSH-Px 和SOD 活性降低及MDA 含量升高。提示黃芩苷改善CCH 所致的學習記憶損傷是通過抗氧化實現的。
Nrf2 作為核轉錄因子,在細胞防御多種應激損傷中起重要作用。氧化應激時,Nrf2 可發生磷酸化并轉位進入細胞核,在細胞核內積聚并進一步識別、結合抗氧化反應元件,從而啟動具有細胞保護效應的多種抗氧化酶基因(如HO-1)的轉錄,達到降低氧化應激水平,保護細胞和組織的作用[15-16]。本研究發現CCH 模型大鼠海馬CA1區p-Nrf2 及HO-1 的蛋白表達出現上調,提示Nrf2/HO-1 通路激活,這可能是機體啟動的一種自我保護機制,與此前報道相一致[17]。給予黃芩苷后,p-Nrf2 及HO-1 的表達進一步上調,證實黃芩苷可能是通過促進Nrf2/HO-1 通路的激活,緩解氧化應激損傷,從而改善CCH 所致的認知障礙。這與文獻報道在其他模型下黃芩苷可經Nrf2/HO-1 通路調控氧化應激損傷相一致[18]。
綜上所述,本研究通過大鼠CCH 模型,發現黃芩苷能改善CCH 所致的認知障礙,其機制可能與促進Nrf2/HO-1 信號通路的激活,抑制CCH 所引起的氧化應激,緩解神經元及突觸損傷有關。

