抑制Yes-相關蛋白表達促進芬太尼誘導乳腺癌細胞凋亡的研究
侯海濤,尚翠霞,鄧景元,崔延超,趙昭,陸鵬,沈劍南,馬姣,姚力
西安交通大學第一附屬醫院,a 康復醫學科,b 胸外科,西安 710061
盡管近十年來乳腺癌的治療取得了巨大進步,但仍有許多晚期乳腺癌患者遭受著癌痛帶來的身體、精神-社會相關的痛苦[1]。因此,鎮痛治療已成為乳腺癌治療的一個重要組成部分[2]。芬太尼為人工合成的μ受體激動阿片類強鎮痛藥物,廣泛應用于癌癥圍手術期止痛或緩解晚期癌痛或放化療引起的疼痛[3]。越來越多的證據表明芬太尼對癌癥患者的長期預后有潛在的影響。然而,關于阿片類藥物對乳腺癌復發和轉移的影響存在爭議[4]。這可能是因為在不同乳腺癌亞型中,芬太尼能選擇性地促進或抑制各異的基因/蛋白表達,從而影響乳腺癌進展。因此,針對不同機制進行更有針對性的研究,對于闡明芬太尼在乳腺癌發生發展過程中的具體作用十分必要,從而為乳腺癌的預防和治療提供相關證據。
Yes-相關蛋白(YAP)作為一種轉錄共激活因子,其過表達或激活多被認為是促進乳腺癌生長、血管生成和轉移的致癌因子[5],但也有研究表明YAP1可以通過促進凋亡、調節免疫而發揮抑瘤作用[6]。YAP的表達與乳腺癌分子亞型、腫瘤細胞成分及所處微環境相關。所以針對Hippo信號通路相關的靶向藥物治療現已成為乳腺癌治療的研究熱點[7]。YAP的激活主要通過Hippo信號通路、機械應力、G蛋白偶聯受體(GPCR)信號通路、蛋白質相互作用以及轉錄后修飾等途徑調控[8]。最重要的是,最近在乳腺細胞系中發現了YAP信號通路的胞外調節因子,如溶血磷脂酸(LPA)、鞘氨醇-1-磷酸(S1P)、雌激素和兒茶酚胺。這些細胞外調節因子作為配體,通過結合不同的GPCR,激活或者抑制YAP/TAZ表達[9-11]。有趣的是芬太尼激活的μ受體也是一種GPCR,其能否調控YAP信號通路從而影響乳腺癌的生長?
本研究將通過研究芬太尼在乳腺癌細胞系中對YAP的調控作用及作用機制,討論不同YAP表達下芬太尼對乳腺癌發展的影響。
1 實驗方法
1.1 細胞系及細胞培養 人乳腺癌細胞MCF-7購于中國科學院典型培養物保藏委員會細胞庫。細胞培養基成分為:RPMI 1640培養基、10%胎牛血清(FBS,Thermo Fisher,中國,上海)、0.3 g/L谷氨酰胺和100 IU /mL青霉素和100 μg/L鏈霉素的 (Invitrogen,MA,USA)。培養箱條件為37 °C,一氧化碳(CO)濃度為5%。對照shRNA及YAP下調shRNA由上海吉凱基因醫學科技股份有限公司構建,轉染過程按照廠家指導進行。使用芬太尼(2.0 μg/L)干預細胞時,對細胞進行去血清培養16 h。小分子MOR抑制劑cyprodime hydrochloride及Gi蛋白抑制劑Pertussis toxin均購于R&D公司,對MCF-7細胞進行預處理濃度及時間分別為10 nM作用2 h和100 μg/L作用16 h。
1.2 細胞增殖試驗(MTT) 將MCF-7細胞接種于密度為2×103/孔的96孔板中24 h,然后用芬太尼處理或作為對照。孵育72 h后,每孔取20 μL MTT溶液(5 mg/mL),再孵育4 h,棄去培養基,將甲瓚沉淀溶解于DMSO中。使用微滴度平板閱讀器測定在570 nm和630 nm(背景)吸光度。細胞活力表示為活細胞相對于對照的百分比。所有的實驗均重復3遍。IC50由每個細胞系的劑量-反應曲線產生。
1.3 細胞流式實驗 Annexin V-FITC和碘化丙啶(PI)試劑盒(Roshe Applied Science,Germany)檢測細胞凋亡。將3×105個細胞接種于6孔板中,用shRNA處理6 h。用accutase酶消化細胞,用冰冷PBS洗滌2次,然后在HEPES緩沖液中重懸細胞,并同時加入標記有annexin v-熒光素和PI的抗體。避光孵育后,流式細胞儀(BD Biosciences)分析細胞凋亡率。
1.4 Western Blot 用RIPA buffer (Beyotime,China)提取GBM細胞總蛋白。采用BCA蛋白測定試劑盒(中國Beyotime公司)測定蛋白濃度。然后用SDS-聚丙烯酰胺凝膠電泳分離蛋白,轉到PVDF膜(Millipore,USA)上。用5%脫脂牛奶封閉PVDF膜。然后將一抗phospho-YAP、YAP、pMST1/2、MST1/2、pLATS1、LATS1、Survivin和Bcl2(均購于Santa Cruz)在4 ℃孵育過夜;二抗(1∶10 000稀釋)室溫孵育1 h后TBST洗3次后顯影。采用ECL化學發光試劑盒和Quantitative-one軟件檢測分析蛋白表達水平。
1.5 體外成瘤實驗 雌性裸鼠(Balb/c-nu/nu)來自西安交通大學動物中心。小鼠(4~6周)飼養于無菌級實驗動物房。40只小鼠成長至8周后分為2組,每組20只,分別接種YAP正常表達及YAP敲除MCF-7細胞: 5×106個細胞加入生長因子降低的Matrigel (Becton、Dickinson和Company)以1∶1(v∶v)比例懸浮,皮下注射至右側。植入7 d后,將上述兩組小鼠再隨機分為0.9%氯化鈉注射溶液治療組和芬太尼治療組(每24 h皮下注射0.02 mg/kg) (n=10),第40天頸椎脫位處死。剝除植入腫瘤并測量。腫瘤體積按公式計算:體積=長×寬2/2。所有動物實驗均通過西安交通大學倫理評審委員會批準。
1.6 免疫組織化學 切除荷瘤小鼠皮下腫瘤,石蠟包埋,4 μm連續切片,在二甲苯中脫蠟,在濃度梯度酒精中水化。PBS洗滌載玻片,3% H2O2室溫孵育10 min,阻斷內源性過氧化物酶活性。用山羊血清在室溫下孵育30 min,阻斷非特異性結合,然后在4 ℃濕盒中孵育一抗過夜。用PBS洗滌后,在室溫下孵育生物素化二抗15 min。然后鏈霉親和素-過氧化物酶復合物孵育,用DAB試劑盒顯影。顯微鏡下觀察并拍照。



注:**P<0.01,***P<0.001;YAP為Yes-相關蛋白。
2 結果
2.1 下調YAP可促進芬太尼誘導的乳腺癌細胞凋亡 首先,本組研究了芬太尼在乳腺癌MCF-7細胞增殖中的作用。如圖1A所示,MTT檢測結果顯示無論在YAP正常表達組還是YAP低表達組,芬太尼干預后細胞的OD值均顯著降低(P<0.01,P<0.001),提示芬太尼可以抑制MCF-7細胞的增殖能力。計算抑制率后本組發現,芬太尼對YAP shRNA組細胞具有更高的抑制率(圖1B,P<0.001)。細胞增殖能力的降低主要是由于細胞凋亡的作用增強。因此,本研究進一步檢測了芬太尼對正常YAP表達及YAP低表達MCF-7細胞的凋亡作用,如圖1C所示,流式細胞結果證實,芬太尼可以促進MCF-7細胞的凋亡,當YAP表達受抑制后,這種促進凋亡的作用顯著增強(表1,圖1C,P<0.01)。

表1 流式細胞檢測芬太尼對不同YAP表達MCF-7細胞凋亡率的影響
2.2 芬太尼促進乳腺癌細胞中YAP去磷酸化 YAP蛋白的活化主要表現為其絲氨酸127位(Serine 127)殘基的去磷酸化(dephosphorylation)。因此,本研究檢測了芬太尼是否影響MCF-7細胞中YAP的表達或磷酸化。如圖2A所示,芬太尼顯著抑制了磷酸化YAP的表達(t=4.769,P=0.041 3)。既往研究顯示,非磷酸化的YAP只有進入細胞核內才能作為共轉錄激活因子參與調節細胞的增殖。因此,本研究進一步檢測了細胞核中YAP的表達,結果顯示芬太尼顯著提高乳腺癌細胞核中YAP蛋白的表達(圖2B,t=48.66,P=0.000 4)。

注:YAP為Yes-相關蛋白。
2.3 MOR-Gi通路介導芬太尼誘導YAP去磷酸化 由于芬太尼是μ阿片受體(MOR)的強激動劑,本研究驗證了MOR是否參與芬太尼誘導的YAP去磷酸化。采用選擇性MOR抑制劑cyprodime hydrochloride對MCF-7細胞進行預處理。cyprodime hydrochloride可以顯著消除芬太尼誘導的YAP去磷酸化 (圖3A,表2)。此外,Gi蛋白抑制劑Pertussis toxin(PTX)也可以抑制芬太尼誘導的YAP去磷酸化(圖3B,表3)。

注:YAP為Yes-相關蛋白;MOR為μ阿片受體。
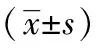
表2 MOR受抑制后芬太尼對磷酸化YAP的表達影響減少
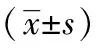
表3 Gi蛋白受抑制后芬太尼對磷酸化YAP的表達影響減少
2.4 芬太尼誘導YAP下游因子Survivin及BCL2表達 活化的YAP可以促進抗凋亡基因 (如Survivin,BCL2) 轉錄,抗凋亡基因高表達與成瘤性相關[12],所以我們進一步測試了芬太尼與Survivin和Bcl2表達的關系。如圖4所示,芬太尼顯著增加了MCF-7細胞中Bcl2 和survivin的蛋白表達(圖4)。同時,當在MCF-7細胞中敲除YAP后,消除了芬太尼誘導的Bcl2和survivin高表達(圖4,表4,表5)。
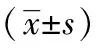
表4 YAP受抑制后芬太尼對其下游蛋白survivin的表達影響減少
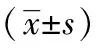
表5 YAP受抑制后芬太尼對其下游蛋白Bcl2的表達影響減少
2.5 體內研究下調YAP對芬太尼抑制乳腺癌生長的影響 為了研究YAP和芬太尼對腫瘤生長在體內的作用,我們使用未敲除YAP的MCF-7細胞作為對照組細胞,YAP敲除MCF-7細胞作為實驗組,在BALB/cnu/nu裸小鼠體內皮下成瘤。本研究通過免疫組織化學試驗,驗證腫瘤中YAP的表達(圖5A)。

注:YAP為Yes-相關蛋白。

注:YAP為Yes-相關蛋白。
與體外實驗結果一致,圖5B所示,在YAP敲除組中,芬太尼可顯著降低的腫瘤體積[(405±123)mm3比(251±96)mm3,t=6.622,P=0.022],而在對照組細胞中,芬太尼對乳腺腫瘤的生長影響較小[(589±102)mm3比(501±81)mm3,t=0.911,P=0.458]。
3 討論
癌癥鎮痛為癌癥治療重要組成部分,而研究表明,麻醉及圍手術期鎮痛干預可能影響乳腺癌細胞行為并與腫瘤復發相關[2]。
芬太尼家族為鴉片類受體合成鎮痛劑,現已越來越被廣泛應用于晚期乳腺癌患者的鎮痛[13]。但芬太尼對乳腺癌的轉移及侵襲作用仍存在爭議,比如有研究發現芬太尼可以通過Wnt信號通路介導的α1.6-巖藻糖基化,促進MCF-7和MDA-MB-231干性及EMT,從而促進腫瘤形成[14-15]。而趙海燕等[16]研究發現芬太尼可以抑制MCF-7的轉移及侵襲,同時有研究認為芬太尼可以抑制NK細胞等免疫功能,影響腫瘤周圍免疫微環境,從而促進腫瘤的生長及轉移[17]。也有研究表明鴉片類藥物使用與乳腺癌復發并無臨床相關性[18],因此闡明芬太尼是否促進乳腺癌的發生、發展及其機制,對臨床乳腺癌患者能否應用芬太尼止痛具有十分重要的意義。
本研究發現,鎮痛濃度的芬太尼(2.0 μg/L)在體外能促進乳腺癌MCF-7細胞的凋亡,從而有效抑制乳腺細胞增殖。在探討其機制時,本組發現,當MCF-7細胞中YAP的表達抑制后,芬太尼顯示出了更強的抑制作用。YAP是一種共轉錄激活因子,其信號活化可以通過穩定細胞骨架、促進細胞黏附、血管生成、促進EMT,提高乳腺癌干細胞的干性等各個方面促進乳腺癌轉移[19]。因此,本研究這一發現提示,在特定條件下,芬太尼作用于乳腺癌細胞時有可能出現不同的生物學表現。比如,當乳腺癌細胞中YAP高表達時,芬太尼可能激活YAP,從而促進乳腺癌細胞增殖的作用。
YAP的激活主要通過Hippo信號通路、機械應力、G蛋白偶聯受體(GPCR)信號通路、蛋白質相互作用以及轉錄后修飾等途徑調控[8]。當YAP被磷酸化后可被進一步降解,是去其活性。只有去磷酸化的YAP可以進入核內,結合TEAD并活化下游靶基因轉錄,調控細胞凋亡、細胞增殖等作用,調節器官大小、參與腫瘤形成[7]。現研究不斷發現,YAP的激活受到多種細胞外分子的調控,包括LPA、葡糖糖、胰高血糖素、腎上腺素、S1P、凝血酶、雌激素等[20]。本研究發現,芬太尼也可以調控YAP的活化,其調控機制為GPCR信號通路,即芬太尼-MOR-Gi-YAP信號通路。本研究再次豐富了YAP調控的細胞外信號分子。
相同的信號通路可以根據細胞形態、所處位置及周圍微環境不同發揮多種調控作用[20]。本研究發現芬太尼抑制了乳腺癌的增殖并促進乳腺癌細胞的凋亡,但在機制研究中,芬太尼可以通過使YAP去磷酸化而活化YAP,促進其下游抗凋亡蛋白Survivin和BCL2的表達,從而具有促進成瘤作用。但當敲除YAP后這種促進成瘤作用消失,說明只有在特定條件下(如YAP高表達),芬太尼才具有潛在的促進乳腺癌成瘤的作用。此外,也有研究顯示,阿片類藥物可以通過AKT-NFκB信號通路抑制乳腺癌干細胞性和EMT從而抑制腫瘤生長[21],同時也有實驗發現芬太尼可抑制乳腺癌形成[22],這些結果表明,芬太尼通過不同信號通路在乳腺癌中發揮不同的作用,而本研究進一步證實抑制YAP后可促進芬太尼誘導的乳腺癌細胞凋亡,為芬太尼在乳腺癌鎮痛治療中的應用提供堅實的理論基礎。

