雙熒光素酶報告基因系統驗證Nlu-miRNA-8對Ccdc124的靶向調控
閘雯俊,游艾青
(糧食作物種質創新與品種改良湖北省重點實驗室/湖北省農業科學院糧食作物研究所,武漢 430064)
MicroRNA(即miRNA)是由18~25個核苷酸組成的一類內源性、短序列非編碼單鏈RNA,它由DNA轉錄產生,不翻譯蛋白質,通過和mRNA 3′UTR區結合來調控目標基因的表達。miRNA主要是通過5′端被稱為種子序列的7 nt序列與位于靶mRNA 3′UTR的miRNA調控元件相互作用以識別靶mRNA。miRNA作為轉錄后基因調控的一種方式,在生物體內形成一個調控網絡,由于miRNA調控作用明顯,本身序列短,便于操作和研究,在生物學功能研究方面越來越受到人們的重視。
miRNAs研究已經成為昆蟲生命科學領域中一個新的熱點。國內已有研究者利用高通量測序獲得雌 雄 成 蟲 時 期 的 褐 飛 虱(Nilaparvata lugensSt?l)miRNAs,為研究miRNAs對褐飛虱生長發育提供了試驗依據[1]。同時Zhou等[2]已經測得灰飛虱的miRNAs,為研究灰飛虱的代謝及發育奠定了基礎。在雌性褐飛虱中,注射miR-4868b模擬物后谷氨酰胺合成酶蛋白表達下調,注射miR-4868b抑制劑后谷氨酰胺合成酶蛋白表達上調[3]。Nlu-miRNA-173及其靶標基因Ftz-F1的正常表達能夠確保褐飛虱正常發育;而當Nlu-miRNA-173過表達時,會導致褐飛虱發生嚴重的蛻皮缺陷[4]。
褐飛虱屬同翅目飛虱科昆蟲,又稱褐稻虱。褐飛虱是水稻主要害蟲之一,在中國長江流域和華南及西南廣大稻區發生頻繁、危害嚴重[5]。為分析可能調控Ccdc124基因表達的miRNA,本研究構建了Ccdc124基因3′-UTR雙熒光素酶基因報告載體psi-CHECK2并鑒定其與Nlu-miRNA-8靶向調控關系。
1 材料與方法
1.1 材料
1.1.1 材料 褐飛虱品種(生物型Ⅱ)為武漢大學收藏,飼養在感蟲水稻品種臺中1號(TN1)植株上,環境條件為(25±2)℃,80%的相對濕度,光照培養16h/d,黑暗培養8 h/d。
1.1.2 試劑 人工合成的Ccdc124目標序列(生工生物工程股份有限公司合成),Nlu-miRNA-8 mimics及陰性對照(GenePharma合成);DMEM培養基+10%FBS(Gbico);XhoI和NotI(購自NEB公司);DNA Ligation Kit(TOYOBO,貨號:LGK-100);轉染試劑(lipofectamine 2000(Invitrogen,貨號:11668-019);QIAquick Gel Extraction Kit(QIA-GEN,貨號:28704);psi-CHECK2 Vector及雙熒光素酶報告基因檢測試劑盒(Promega,貨號:E1910)。
1.2 方法
1.2.1 褐飛虱組織總RNA提取與檢測 使用Trizol試劑(購自Invitrogen公司)提取褐飛虱全蟲的總RNA,具體提取步驟參照Trizol試劑自帶說明書。溶解后的RNA在含有溴化乙錠(EB)的1.5%瓊脂糖膠上電泳檢測,同時在RNA濃度測定儀上測定濃度,存放于-20℃備用。
1.2.2 褐飛虱Ccdc124基因3′UTR區片段的擴增根據GenBank中的褐飛虱Ccdc124基因序列(ID:XM_022350855.1)中 的3′UTR區 采 用Primer Premier5.0軟件設計PCR引物,設計合 成 特 異 引 物(F:5′-CCGGCTCGAGCAAATCACCCGAGAACCCTA-3′;R:5′-TAAGCGGCCGCGCTATTGACAATGCTG ACCAA-3′),上述引物由廣州市銳博生物科技有限公司合成。目標片段DNA大小為214 bp。PCR擴增反應體系(50μL)為5×Phusion Green HF Buffer 10μL,10 mmol/L dNTPs 1μL,上游引物2.5μL,下游引物2.5μL,cDNA模板1μL,Phusion DNA Polymerase 1μL,ddH2O 32μL。反應程序為98℃預熱30 s;98℃變性10 s,60℃退火30 s,72℃延伸30 s,共35個循環;72℃延伸10 min;4℃保存。PCR產物進行1%瓊脂糖電泳檢測確定特異性產物。
1.2.3 PCR產物酶切和純化 用兩種內切酶XhoI和NotI對上述PCR產物進行雙酶切,酶切反應體系如下,體系總體積為40μL。PCR產物酶切體系:PCR產物20μL,10×H緩沖液4μL,BSA 4μL,XhoI限制性內切酶2μL,NotI限制性內切酶2μL,ddH2O 8μL,共40μL。反應程序為在37℃酶切4 h,隨后進行回收純化。
1.2.4 psi-CHECK2雙酶切處理 psi-CHECK2載體含有限制性內切酶XhoI和NotI酶切位點。用兩種內切酶XhoI和NotI對上述PCR產物進行雙酶切,酶切反應體系總體積為40μL:載體psi-CHECK210μL,10×H緩沖液4μL,BSA 4μL,XhoI限制性內切酶2μL,NotI限制性內切酶2μL,ddH2O 18μL,共40μL。反應程序為在37℃酶切4 h,隨后進行回收純化。
1.2.5 雙熒光素酶報告載體構建 T4 DNA Ligase連接目的片段與psi-CHECK2載體。將連接產物轉化DH5感受態細胞,接種于含氨芐青霉素的LB平板,37℃生化培養箱過夜培養。篩選陽性克隆并經XhoI+NotI雙酶切電泳鑒定。克隆經雙酶切電泳鑒定后送測序(載體送至上海生工測序),與預期序列一致的克隆保留,接種LBAmp液體培養基培養12 h后提取質粒DNA。
1.2.6 雙熒光素酶基因報告分析 果蠅S2細胞常規培養于37℃5%CO2飽和濕度的條件下。轉染前1 d,細胞按2×104個/孔接種于24孔板上,培養基為含10%FBS的DMEM-高糖培養基;轉染當天,細胞匯合度為50%~60%,吸去舊的培養基,用PBS洗滌2次,然后每孔加入300μL OPTI-MEM培養基,置于5%CO237℃培養箱中;每個孔OPTI-MEM培養基稀釋Lipofectamine 2 000 1μL,終體積為50μL,室溫下靜置5 min;每個孔加入20μmol/L濃度的miRNA mimics 1μL和0.5μg質粒,再加入OPTI-MEM至總體積50μL,室溫下靜置5 min(最終孵育液中為50 nmol/L miRNA mimics)。復合50μL Lipofectamine 2 000倍稀釋液和孵育液,室溫下靜置20 min;每孔加入100μL轉染復合液,晃動24孔板稍加混勻;在5%CO237℃培養箱中孵育5 h,用新鮮的完全培養基(含血清)替換含有轉染復合物的培養基;轉染48 h后,吸去舊的培養基,用PBS清洗2次,每孔細胞加入100μL的PLB(Passive lysis Buffer),室溫輕微振搖15 min,收集細胞裂解液。用Promega公司的Dual-Luciferase Reporter Assay System(E1910)進行樣品Luciferase活性檢測。
2 結果與分析
2.1 褐飛虱Ccdc124基因3′UTR區片段的擴增
以基因組DNA為模板進行PCR反應擴增Ccdc1243′UTR,約為214 bp,1.5%瓊脂糖 凝膠電泳分析PCR產物大小,與預計產物大小一致(圖1)。
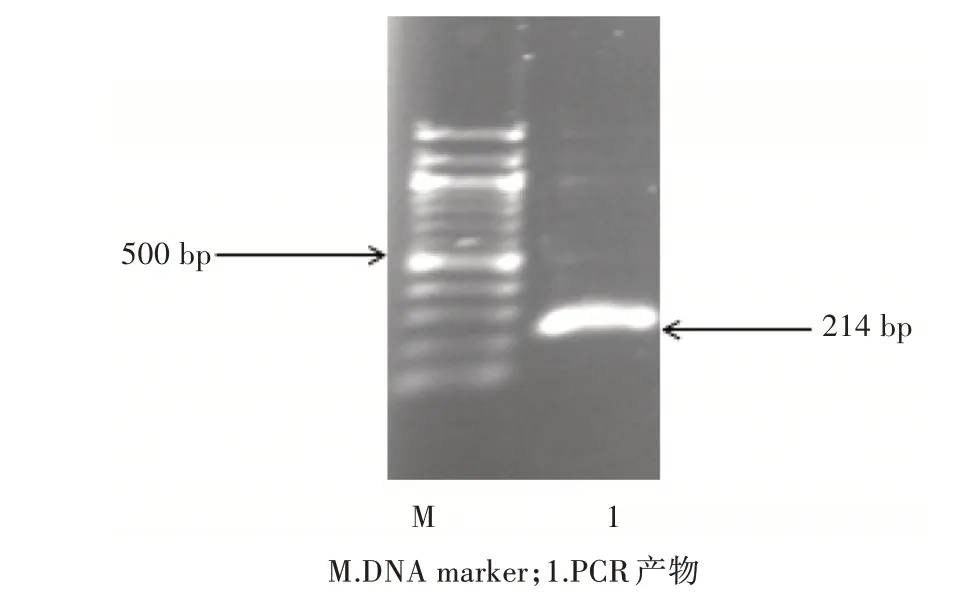
圖1 PCR擴增Ccdc124 3’UTR
2.2 Ccdc124 3′UTR載體構建
PCR產物和psiCHECKTM-2載體經雙酶切、純化、連接轉化后挑取5個單克隆菌落培養過夜,菌液PCR鑒定(圖2)。菌液PCR陽性單克隆,少量提取質粒后經雙酶切鑒定,可見2條帶(圖3),結果顯示分別對應Ccdc1243′UTR片段(214 bp)及載體片段(6 273 bp)。陽性克隆送測序鑒定,blast比對后與GeneBank公布序列一致,說明成功構建了psi-CHECK2/Ccdc1243′UTR載體。
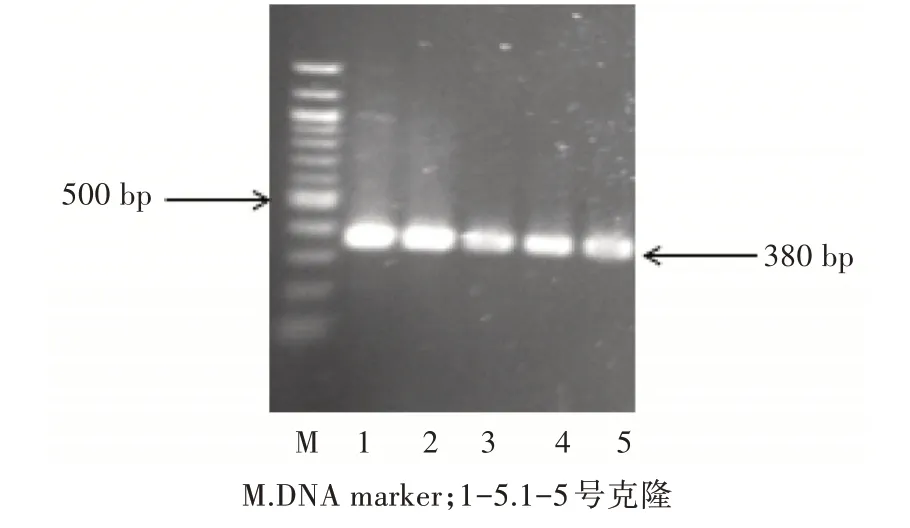
圖2 菌液PCR鑒定電泳

圖3 重組質粒psi-CHECK 2/Ccdc124 3′UTR雙酶切鑒定電泳
2.3 miRNA-8與Ccdc124的靶點驗證
將miRNA-8 minic(Minic-8)、空白對照(No-Minic)或陰性對照(Minic-Ct)與psi-CHECK2/Ccdc1243′UTR重組質粒分別共轉染果蠅S2細胞,以共轉染空白對照(No-Minic)或陰性對照(Minic-Ct)作為對照組,測得共轉染miRNA-8 minic(Minic-8)與psi-CHECK2/Ccdc1243′UTR重組質粒組雙熒光素酶相對值為0.625,與對照組相比,熒光素酶活性極顯著下調37.5%。因此,根據雙熒光素酶報告基因表達結果分析,miRNA-8 minic對psi-CHECK2/Ccdc1243′UTR載體的報告熒光有明顯的下調作用(圖4)。
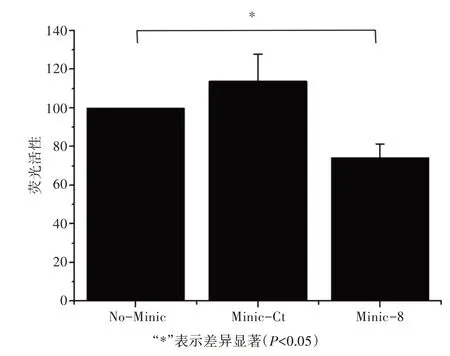
圖4 雙熒光素酶檢測
3 小結與討論
microRNA主要是通過與相應靶基因的3′UTR序列中microRNA作用元件相互作用,抑制靶基因mRNA的轉錄及蛋白的翻譯。
本研究利用TargetScan、miRanda和Pictar 3種軟件預測靶向調控Ccdc124的miRNA,并聯合Pubmed文獻數據庫,最終認定Nlu-miRNA-8靶向調控Ccdc124基因的可能性較大。本課題通過生物學試驗進一步驗證了二者的調控關系。本研究以褐飛虱基因組DNA為模板PCR擴增Ccdc124基因的3′-UTR序列,構建psi-CHECK2/Ccdc1243′UTR載體。試驗設置空白對照、miRNA-8 minic陰性對照,設計嚴謹,聯合構建的載體共轉染于果蠅S2細胞,采用雙熒光素酶基因報告法檢測轉染后各組活性。結果顯示,轉染miRNA-8 minic可明顯下調psi-CHECK2/Ccdc1243′UTR載體熒光酶素活性。綜上所述,本研究成功構建含有Ccdc124基因3′-UTR段雙熒光素酶基因報告載體,同時通過雙熒光素酶基因報告分析法初步證明Nlu-miRNA-8對Ccdc124基因在生物信息學水平存在調控的可能性,為下一步研究Nlu-miRNA-8的生物學功能提供可試驗依據。

