非疫苗血清型肺炎鏈球菌發生機制及疫苗新策略
劉福莉,李佳茵,何 平,華允芬
肺炎鏈球菌(Streptococcuspneumoniae,Sp)是一種表面包被莢膜的革蘭氏陽性雙球菌,兼性厭氧。到目前為止,依據其莢膜多糖結構的特異性,Sp已確定有近100種血清型。SP在自然界中分布廣泛,作為一種常見的條件致病菌,常在正常人鼻咽腔中定植,當機體免疫功能下降或受其他因素影響時,可引發各種侵襲性疾病,如腦膜炎、敗血癥、菌血癥等,患有慢性疾病或免疫力低下的人群、2歲及以下的兒童和65歲以上老年人是其主要的侵襲對象。據統計,由細菌性肺炎導致的死亡約占全球5歲以下兒童死亡人數的15%[1]。盡管抗生素治療具有一定的效果,但抗生素不能治療由肺炎鏈球菌感染初期造成的生理上的不可逆損傷,并且肺炎鏈球菌對抗生素的耐藥性日益嚴重,而新型抗菌藥物的發現受制于高昂的研發成本和可能較低的投資回報率[2]。因此,尋求控制Sp感染的新方法,是目前亟待解決的關鍵問題。疫苗通過提高易感人群對病原菌的免疫能力有效地降低感染率,在Sp感染防治中愈加受到重視[3]。但近年來血清型替換及莢膜轉換現象頻繁發生導致肺炎鏈球菌血清型分布發生變化,使得目前以莢膜多糖為基礎的多糖疫苗和多糖蛋白結合疫苗的保護效力大大降低,此外,肺炎鏈球菌疫苗不能預防由無莢膜肺炎鏈球菌的引起的疾病,這無疑增加了疾病防控的風險和治療難度。研究肺炎鏈球菌非疫苗血清型的發生機制進而開發新的疫苗已經成為當下必要的課題。
1 肺炎鏈球菌莢膜多糖及其疫苗
細菌莢膜多糖(capsular polysaccharide,CPS)在細胞壁外形成關鍵的防護層,保護細菌逃避宿主的先天免疫反應機制,逃逸后的細菌可在機體組織細胞中生長繁殖引發感染,故莢膜多糖與細菌毒力息息相關。肺炎鏈球菌莢膜種類繁多,有近100種不同的莢膜類型,稱為血清型,這些不同的血清型由莢膜多糖的組成和結構決定[4]。CPS位點由12至20個基因組成,編碼4種保守的調控蛋白,1種初始糖基轉移酶、幾種非初始糖基轉移酶、1種Wzy重復單位聚合酶和1種Wzx翻轉酶[5-6]。最近的研究發現,不同的CPS不僅造成肺炎鏈球菌毒力的差異,還影響其定植和傳播。Ammar Zafar通過構建一種幼鼠鼻腔定值、脫落和傳播模型證明了肺炎鏈球菌從宿主上呼吸道粘膜(upper respiratory tract,URT)脫落的水平與CPS類型和表達量相關,且通過傳播導致不同莢膜型的肺炎鏈球菌感染率差異呈顯著性。這一研究可能解釋了為何一些肺炎鏈球菌血清型在人群中更常見[7]。
肺炎鏈球菌莢膜多糖作為抗原可刺激機體產生相應抗體,通過中和作用加速對肺炎鏈球菌的清除。1983年,23價莢膜多糖疫苗研制成功。PPV23覆蓋了23種經常引起肺炎鏈球菌感染的血清型,理論上能有效預防80%以上的成人肺炎鏈球菌感染,但該疫苗對2歲以下兒童的保護效果較弱。為了使2歲以下兒童產生保護性免疫應答,2002年開發了第1種7價肺炎鏈球菌多糖蛋白結合疫苗(pneumococcal conjugate vaccines,PCV),基于北美和歐洲的流行病學數據,該疫苗將7種常見致病血清型(4、6B、9V、14、18C、19F、23F)的莢膜多糖與載體蛋白CRM197相結合。流行病學數據顯示,在接種疫苗前,血清型14在這些國家是導致兒童和成人侵襲性肺炎鏈球菌病(invasive pneumococcal disease,IPD)的主要原因,接種PCV7后,7F和19A血清型開始在兒童中占主導地位[8]。2010年,惠氏公司在7價多糖蛋白結合疫苗的基礎上又上市了第2種結合疫苗,即13價肺炎鏈球菌多糖蛋白結合疫苗(PCV13),該疫苗包含了PCV7中未覆蓋的6種新血清型,即血清型1、3、5、6A、7F和19A,其血清型覆蓋范圍的增加為預防肺炎鏈球菌感染提供了更廣泛的保護作用[9]。表1總結了目前所有獲得許可的肺炎鏈球菌疫苗。雖然PPV和PCV已經得到廣泛應用,但由于其保護范圍有限以及非疫苗血清型及無莢膜肺炎鏈球菌的增加,使得由肺炎鏈球菌感染導致的死亡率仍然居高不下。

表1 肺炎鏈球菌疫苗成分比較
2 肺炎鏈球菌非疫苗血清型的發生機制
2.1 血清型替換 血清型替換是指原來是次要的或非致病性肺炎鏈球菌血清型變成了主要的致病性血清型,且不在現有疫苗血清型的涵蓋范圍內[10]。研究發現,盡管PCV接種有效地減少了疫苗血清型Sp在鼻咽部的定植,但隨著疫苗血清型Sp從鼻咽生態位中清除,非疫苗血清型Sp的攜帶量很快增加,導致肺炎鏈球菌的攜帶率仍然很高[11]。最典型的例子是繼2000年美國引入7價結合疫苗后,19A血清型肺炎鏈球菌的流行率迅速增加并成為IPD的主要誘因。血清型19A肺炎鏈球菌于1998年首次被報道,在PCV7疫苗實施前,疾病控制和預防中心中并沒有關于19A分離株的相關記錄,當時較為常見的是19F,而1998-2005期間,由19A血清型肺炎鏈球菌導致的侵襲性疾病增加了近3倍[12]。同樣的,在美國引入了13價肺炎鏈球菌結合疫苗后,監測發現PCV13包含的19A血清型肺炎鏈球菌的定植率有所降低,但35B等非疫苗血清型的定植在逐漸增加[13-14]。在2012年印度南部的兩例成人侵襲性肺炎鏈球菌感染的患者中發現,導致患者死亡的兩個肺炎鏈球菌分離株血清型33C和7C均屬于非疫苗血清型[15]。流行病學數據表明,世界各國在疫苗接種后均出現了明顯的血清型替換現象,而且不同地區和年齡組之間導致IPD的非疫苗血清型存在差異。近年來研究者觀察到,非疫苗血清型8、9N、15A和23B在澳大利亞、北美和某些歐洲國家呈上升趨勢,盡管出現了共有的非疫苗血清型,但并沒有觀察到像在PCV7上市前的血清型14和PCV13上市前的血清型19A一樣有一種占據主導地位的血清型[8]。目前的研究普遍認為,在疫苗的直接作用下,非疫苗血清型的迅速替換可能是由于不同血清型的菌株在定植部位的競爭性作用[16]。血清型替換現象的出現使我們意識到長期使用PCV的策略必須要有所轉變,并且不斷提高對流行的肺炎鏈球菌血清型的認知。且各國之間流行的血清型存在差異,也要求我們考慮是否在不同地區研制不同的血清型疫苗制劑。
2.2 莢膜轉換 除了血清型替換,莢膜轉換也是肺炎鏈球菌血清型流行率發生變化的主要原因。莢膜轉換即通過改變或交換其CPS基因座來改變單個克隆血清型的現象[17-18]。通過對1937年至2007年收集的426株肺炎鏈球菌的血清型和MLST數據進行分析發現,其中有36株肺炎鏈球菌發生了莢膜轉換,其原因個別歸因于核苷酸的替換或缺失,但大多數是由于CPS基因座的重組造成的,并且存在從另一個肺炎鏈球菌菌株或相關物種中捕獲基因片段進而表達新莢膜類型的可能[17,19]。Chrispin實驗室收集了98名嬰兒共1 553份鼻咽拭子樣本,通過全基因組測序比較了肺炎鏈球菌在定植過程中的基因組變化,數據顯示,在定植過程中,Sp能迅速進行微進化使菌株獲得較高的遺傳多樣性[20]。這種多樣性的決定因素包括宿主、菌株類型和定植持續時間,并受突變和同源重組現象的影響。而Chrispin早期的一項研究表明肺炎鏈球菌這種通過轉化和同源重組從其他菌株甚至其他物種中獲得異源DNA的能力與其定植能力相關,作者認為,具有較強的定植能力的肺炎鏈球菌通常具有較厚的莢膜,從而能抵抗中性粒細胞的吞噬作用和補體介導的殺傷作用,在長期的定植過程中有更高的獲得外源DNA的幾率[21]。從2010年至今,人們又相繼發現了10種新的莢膜類型,表2列出了最新發現的10種肺炎鏈球菌血清型信息。2020年,Feroze Ganaie實驗室發現了第100種肺炎鏈球菌莢膜類型,并將其命名為血清型10D,通過基因分析發現,10D肺炎鏈球菌CPS中唯一編碼核糖醇轉移酶的基因wcrO10D極有可能來自口腔鏈球菌[22]。鏈球菌屬包含104種已知的物種,目前的研究表明,緩癥鏈球菌、嬰兒鏈球菌和口腔鏈球菌,是肺炎鏈球菌獲得外源基因片段的主要來源[23-25]。種間的莢膜基因交換大大增加了肺炎鏈球菌莢膜型別的多樣性,并使血清型復雜化。
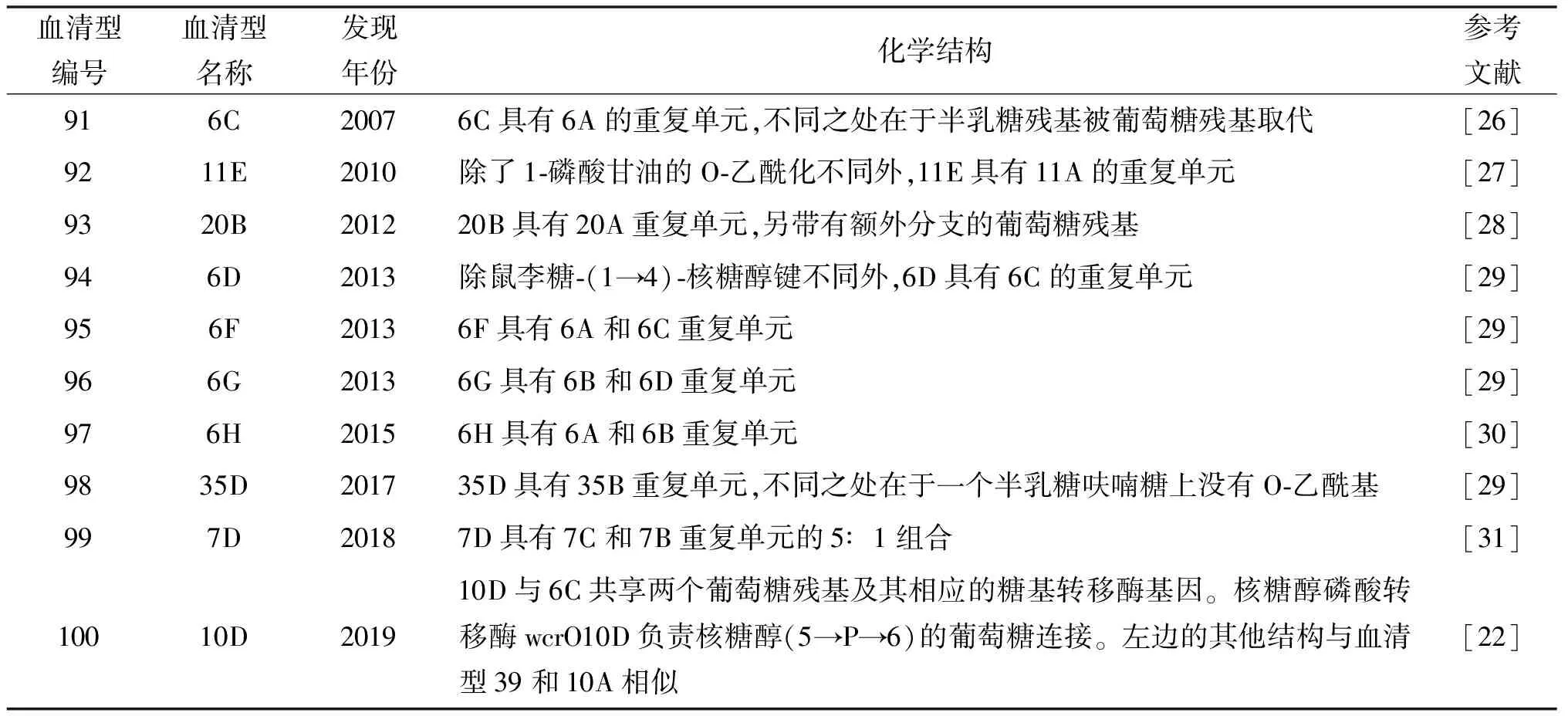
表2 最近發現的10種肺炎鏈球菌血清型列表
在疫苗的選擇壓力下,肺炎鏈球菌通過種內重組以及與其他鏈球菌的種間重組不斷進化,使其具有結構多樣的莢膜多糖,這種由疫苗血清型到非疫苗血清型的莢膜轉換,促使新型的肺炎鏈球菌菌株逃避現有疫苗的作用。除此之外,通過重組,還增加了肺炎鏈球菌獲得耐藥基因的可能[32-33]。
2.3 無莢膜肺炎鏈球菌 莢膜多糖作為肺炎鏈球菌分型的依據,不僅是肺炎鏈球菌最重要的毒力因子之一,還有助于病原菌在宿主的鼻咽部定植。近年來,研究發現無莢膜肺炎鏈球菌(nonencapsulated streptococcus pneumoniae,NESp)的分離率逐漸增加,在使用了PCV7疫苗后,葡萄牙兒童NESp攜帶率從2001年的1.5%增加到2006年的5.1%[34]。
CPS合成位點位于肺炎鏈球菌高度保守的dexB基因和aliA基因之間,是表達莢膜多糖所必需的。通過對NESp的CPS位點的組成進行分析,可將NESp分為兩類[23],第1類NESp分離株具有傳統莢膜類型肺炎鏈球菌的CPS位點序列,但由于在dexB基因和aliA基因之間出現基因的缺失或突變,從而不能正常表達莢膜多糖;第2類NESp分離株的CPS基因位點完全被其他基因取代。NESp菌株由于缺乏莢膜多糖,傳統上認為該類菌株不具有致病能力。但研究發現,在一些NESp分離株中,CPS位點具有編碼新的毒力的相關蛋白PspK、aliC和aliD,這些蛋白增加了NESp在宿主鼻咽部的定植能力和毒力。基于第2類NESp是否表達肺炎鏈球菌表面蛋白(PspK)和兩個寡肽結合脂蛋白(aliC和aliD)又被分為4個支系,分別為NCC1(null-capsule clade,NCC)、NCC2、NCC3和NCC4。NCC1表達肺炎鏈球菌表面蛋白PspK,但aliC和aliD呈陰性;NCC2是aliC和aliD陽性,而PspK陰性;NCC3為aliD陽性,aliC和PspK陰性;NCC4均為陰性[35-36]。
來自日本的一項最新研究報告稱,從兒童急性中耳炎患者分離到的肺炎鏈球菌菌株中,6.4%的菌株為NESp,其中4.7%為PspK陽性[23,37]。此外在韓國不同城市的兒童中發現了同一種MLST類型的NCC1分離株。這表明NCC1克隆株可在人群中傳播[38]。已有多個研究表明,PspK表達可以促進肺炎鏈球菌與宿主細胞的粘附,與NESp的定植和毒力有關[37]。動物實驗也證明NCC1分離株只有在含有pspK的情況下才能定植于小鼠鼻咽部[39]。aliC和aliD作為底物結合蛋白,在NESp菌株早期定植和持續感染中發揮著重要作用。體外分析表明,aliC和aliD的存在導致NESp對上皮細胞的粘附和體外生物膜形成的減少,但增加了溶血素Ply的表達。而當aliD缺失時,Ply表達量和NESp在血液中的存活率顯著降低,這表明與aliC相比,aliD在侵襲性疾病中具有更為主導的作用[40]。
目前已經證明NESp一樣可以有效地在鼻咽部定植,并占無癥狀攜帶者分離株的3%~19%[41]。這些NESp與非侵襲性疾病如中耳炎、結膜炎和非細菌性肺炎相關[42],并且菌株中攜帶多重耐藥基因[43]。最近,日本一家醫院首次從肺炎病人支氣管痰液中分離出對β-內酰胺類抗生素、大環內酯類和喹諾酮類耐藥的多耐藥性NESp[38],此外,Bradshaw將帶有莢膜的熱滅活菌株WU2與NESp菌株混合,通過腹腔注射構建了混合菌株的小鼠全身感染模型,發現NESp能夠在體內轉化過程中獲得莢膜并維持抗生素抗藥性,進而進化為毒性更強的菌株[41]。莢膜的缺乏,使NESp菌株更容易獲得外源DNA,具有更高的遺傳可塑性。但現有肺炎鏈球菌疫苗并不針對缺乏莢膜多糖的NESp,這可能導致NESp在鼻咽部的定植增加[44]。我們必須意識到由NESp引起的感染在不久的將來可能成為一個重要的臨床問題。因此,監測和研究NESp的致病性和藥物敏感性對于制定有效的預防和治療策略具有重要意義。
3 新型疫苗及策略
血清型替換、莢膜轉換及NESp的增加使得現有疫苗已不能全面有效地預防肺炎鏈球菌感染,因此,基于有莢膜和無莢膜的肺炎鏈球菌表達的蛋白質設計的蛋白質疫苗以及全細胞疫苗等新一代疫苗的開發有可能解決當下非疫苗血清型肺炎鏈球菌流行率增加的問題,通過引起與特定血清型無關的免疫應答,實現對現有疫苗的補充。
肺炎鏈球菌能表達多種有助于其在鼻咽黏膜表面定植的表面蛋白[45],如圖1所示。使用所有血清型肺炎鏈球菌共有的表面蛋白作為抗原,以期開發能誘導機體對不同血清型肺炎球菌均能產生免疫應答的蛋白質疫苗,是未來肺炎鏈球菌疫苗的發展趨勢,也是更加經濟可行、廣泛持久的保護方式。目前已經發現了20多種具有保護作用的肺炎鏈球菌蛋白質,其中對于肺炎鏈球菌表面蛋白A、肺炎鏈球菌溶血素、肺炎鏈球菌表面黏附素A的研究較多,已經證明它們有助于肺炎鏈球菌的定植并具有免疫原性。但是這些蛋白有些并不能被NESp菌株表達,需要研究能有效針對NESp的目標蛋白。在NESp菌株中,研究者發現了(pspK、aliC和aliD)3個基因,它們取代了莢膜多糖生物合成位點中的CPS合成基因。先前的研究表明,肺炎鏈球菌表面蛋白k和兩個寡肽結合脂蛋白與NESp菌株的黏膜定植和感染密切相關,并且PspK、aliC和aliD均具有免疫原性,是重要的疫苗候選蛋白[46]。已有研究表明,全身免疫及粘膜免疫均能夠在小鼠體內誘導產生PspK特異性保護性抗體,且PspK免疫小鼠血清能有效減少表達PspK的菌株在小鼠上皮細胞的粘附[47]。此外,肺炎球菌表面蛋白C(PspC)與PspK具有一定的序列同源性,而PspC免疫也被證明對肺炎鏈球菌病有保護作用[48]。

圖1 肺炎鏈球菌在宿主表面定殖的分子機制[45]
近年,研究開發出一種肺炎鏈球菌全細胞疫苗(whole cell vaccine,WCV),它經基因修飾去除了自溶素基因,并由且不含莢膜多糖的滅活的肺炎鏈球菌菌株組成,常以氫氧化鋁作為佐劑[49]。NESp菌株由于沒有莢膜包裹,使得肺炎鏈球菌表面的蛋白質抗原暴露于免疫系統中,而這些抗原通常由不同血清型的肺炎鏈球菌表達,因此能夠引起與特定的血清型無關的免疫應答[50-51],WCV可以更好地預防這類菌株的感染。此外,肺炎鏈球菌是一種革蘭陽性菌,不含脂多糖,作為全細胞疫苗使用相對安全[52]。根據多個實驗室的研究表明,當全細胞疫苗與合適的佐劑結合時,可以通過粘膜免疫減少肺炎鏈球菌的定植。
4 小 結
肺炎鏈球菌感染性疾病一直是世界上重要的公共衛生問題之一,通過廣泛的預防和治療措施減少兒童鏈球菌性肺炎的發病率,降低死亡率和死亡人數,是聯合國千年發展目標實現的關鍵[53]。雖然疫苗對肺炎球菌疾病有顯著的保護作用,但近年來頻繁的血清型替換及NESp的增加使得目前的多糖疫苗和多糖蛋白結合疫苗免疫效果并不理想,此外,肺炎鏈球菌通過種間基因轉移促進了莢膜多糖的多樣性,導致了抗原的多樣性。而有莢膜和無莢膜的肺炎鏈球菌在定植期間密切的相互作用不僅導致重組菌株的出現,還可能導致獲得抗生素抗藥性和毒力因子的幾率增加,進而增加疾病防控的風險和治療難度。目前的疫苗和治療策略對非疫苗血清型肺炎鏈球菌和NESp均無效,因此研究開發新的疫苗已經成為當下必要的課題。了解非疫苗血清型肺炎鏈球菌的流行機制及探究無莢膜肺炎鏈球菌如何在宿主定植并導致疾病,將有助于設計更有效的應對策略。
利益沖突:無

