大動物體外膜氧合模型建立的研究進展
齊嘉琛,高思哲,張巧妮,吉冰洋
體外膜氧合(extracorporeal membrane oxygena?tion, ECMO)是心肺功能衰竭患者通過機械循環輔助裝置獲得短時間體外生命支持(extracorporeal life support, ECLS)的一種輔助治療手段[1]。 ECMO 的原理是將靜脈血從體內引流到體外,通過氧合器(即膜肺)的氣體交換,使靜脈血氧合為動脈血,再用泵將血液灌注回體內。 由此在一段時間內替代患者的心肺功能。 ECMO 可支持呼吸和(或)循環功能、能有效而迅速地改善低氧血癥及去除CO2、可進行左心/右心或全心輔助從而有效支持全身循環、避免長期機械通氣所致的氧中毒及氣道損傷,為心肺功能的恢復或心肺移植贏得時間[2]。
動物模型是ECLS 領域研究的基礎,基于動物模型可以進行相關生理學研究及分子機制研究,并為相關臨床試驗提供重要參考。 多年來,已經有多種ECMO 大動物模型建立并應用,但在可行性和方法上缺乏全面的比較。 因此,本文對現有的靜脈-動脈(veno-artery, V-A)ECMO 大動物急性疾病模型、靜脈-靜脈(veno-venous,V-V) ECMO 大動物急性呼吸窘迫綜合征(acute respiratory distress syn?drome, ARDS)模型、清醒 ECMO 大動物長期生存模型的特點和建立方法進行系統的綜述,目的是優化在未來研究設計中模型建立的相關策略。
1 V-A ECMO 大動物急性疾病模型的建立
V-A ECMO 現在被廣泛用于各種病因導致的心源性休克的循環支持治療[3]。 基于此特點,V-A ECMO 大動物模型主要針對心功能衰竭、心源性休克疾病模型的建立。
1.1 心功能衰竭、心源性休克造模方法和并發癥 研究大部分使用豬[4-16],也有用羊[17-18]作為構建疾病模型的物種,部分研究未提及年齡及性別信息。大多數研究采用急性心肌梗死(acute myocardial in?farction,AMI)誘導模型,通過結扎冠狀動脈左前降支(left anterior descending coronary artery,LAD)實現。 其他模型使用起搏誘導心室顫動(ventricular fi?brillation,VF)、艾司洛爾輸注、心肌缺氧或一氧化碳中毒的誘導方法。 大部分模型為急性期模型,大動物存活時間短,其中AMI 模型建立風險較大,可出現不可逆的VF 導致動物死亡,與其他模型相比復雜程度及不可控性更大。 V-A ECMO 大動物的主要特征、心功能衰竭、心源性休克模型的誘導方法及潛在的并發癥詳見表1。
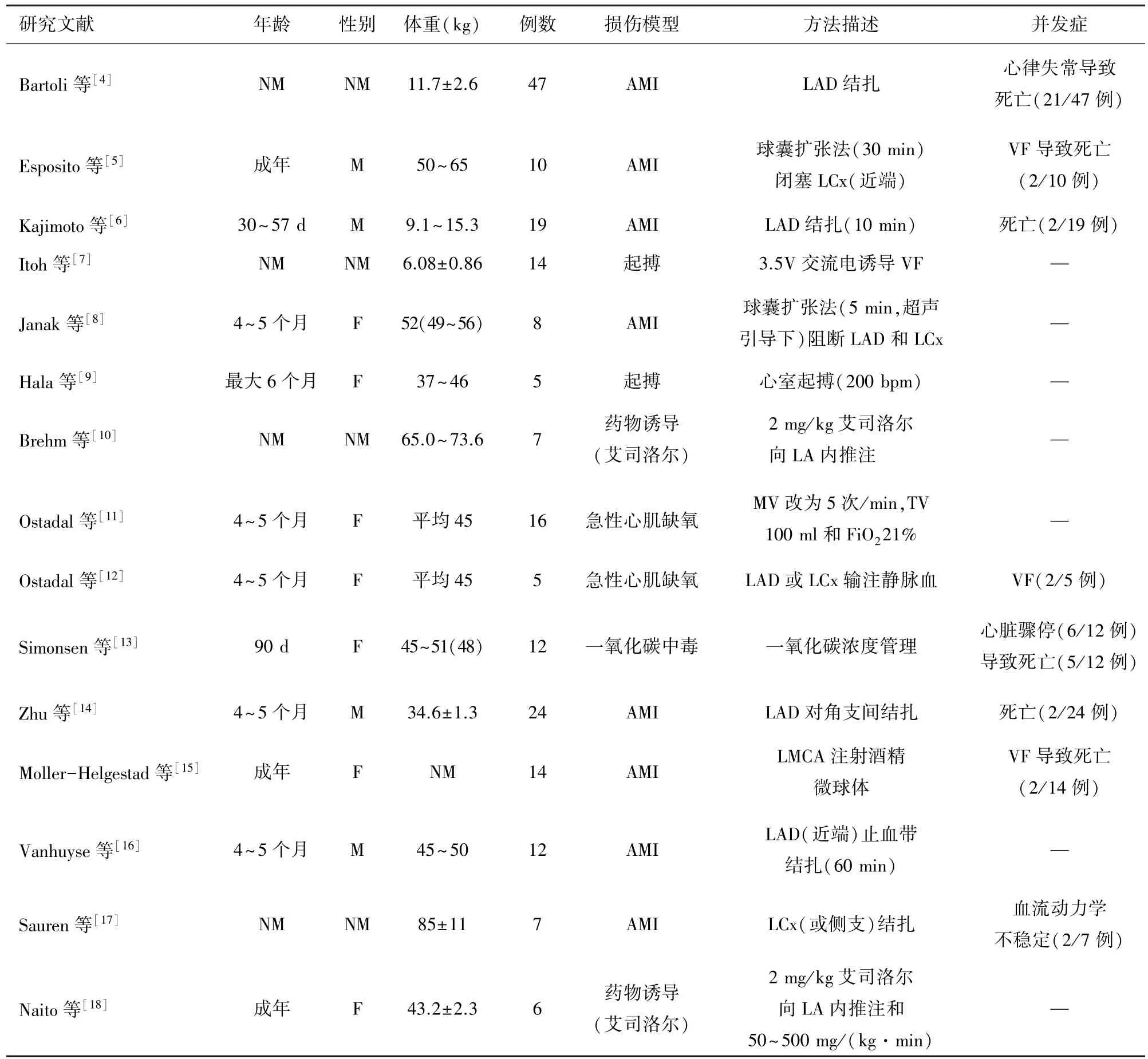
表1 V-A ECMO 大動物疾病模型的基本特征、造模方法和并發癥
1.2 術前管理及麻醉 根據物種不同,動物術前禁食24 ~48 h,禁水12 h。 給予氯胺酮或咪達唑侖鎮靜,靜脈麻醉誘導多應用丙泊酚(2 mg/kg,iv)+阿片類藥物靜脈注射,吸入麻醉誘導多采用異氟烷(1%~3%)吸入,隨后氣管插管并機械通氣。 麻醉維持多采用靜脈+吸入復合麻醉,即異氟烷+丙泊酚[8 ~10 mg/(kg·h)]+阿片類藥物的組合,根據大動物生理參數、生命體征、角膜和眼瞼反射、流淚和自發運動調整麻醉維持劑量。 機械通氣參數設置:潮氣量多為8~10 ml/kg,呼吸頻率根據呼氣末二氧化碳分壓調節,吸入氧濃度根據氧分壓調節。
1.3 插管及抗凝管理 V-A ECMO 插管相關信息、流量及抗凝管理詳見表2。 大部分模型采用外周插管,但插管策略不盡相同。 部分研究中的ECMO 流量是實驗的一個控制參數。
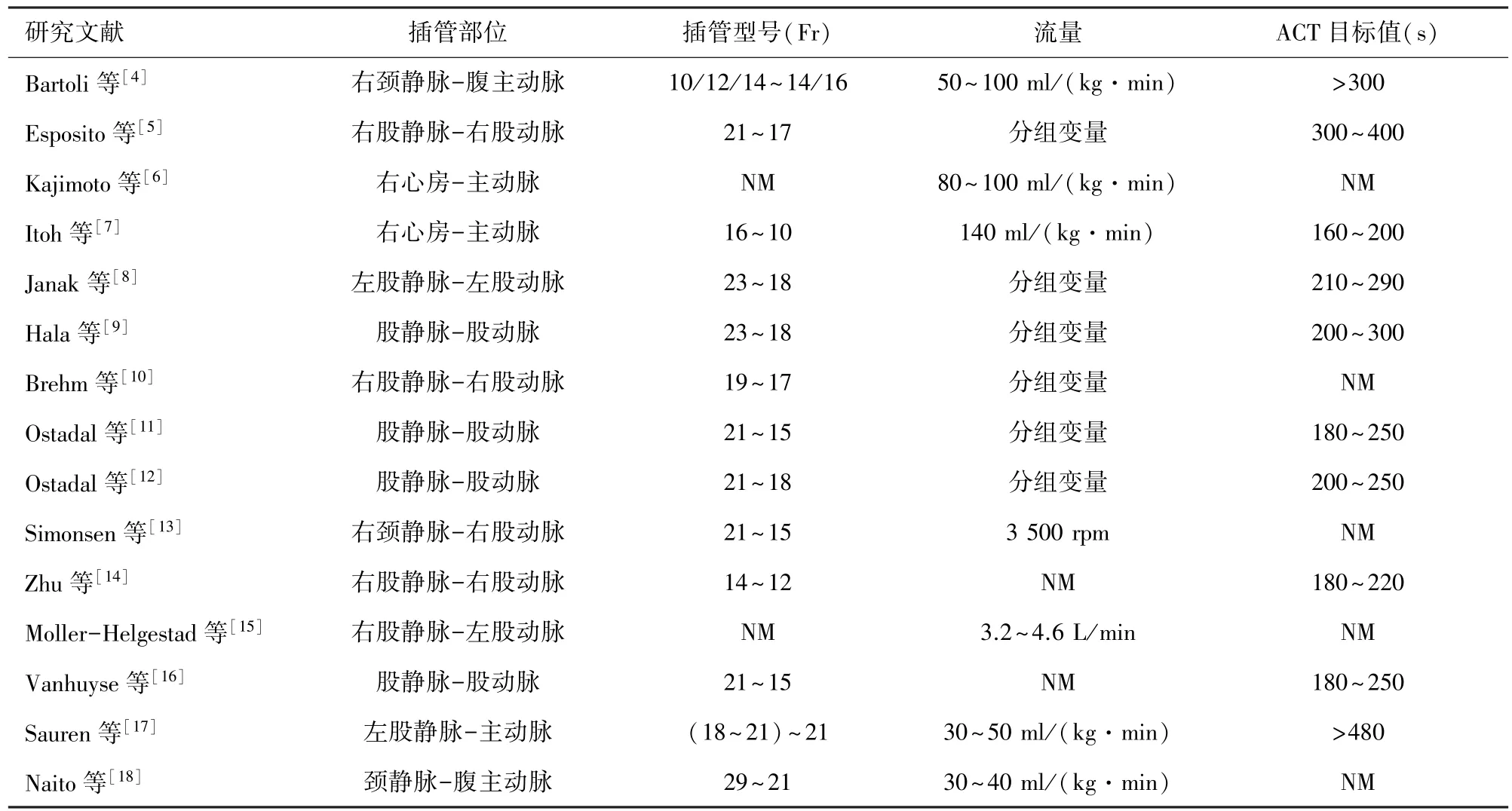
表2 V-A ECMO 大動物疾病模型插管、流量及ACT 目標值相關信息
一旦開始V-A ECMO 支持,ECMO 相關參數設置應盡可能標準化,以符合最新指南或實踐:經頸/股動脈穿刺,確認尖端位置;ECMO 流量控制在60 ml/(kg·min)左右;根據動脈血氣及靜脈氧飽和度(SvO2)或動脈氧飽和度(SaO2)動態調整膜肺的氧流量及氧濃度。
2 V-V ECMO 大動物ARDS 疾病模型的建立
當機械通氣不能維持足夠的氧合或清除CO2時,V-V ECMO 可作為急性呼吸衰竭患者的救命性治療手段,這種情況多出現在嚴重的ARDS 的患者中[19]。 因此 V-V ECMO 大動物模型主要針對 ARDS疾病模型的建立。
2.1 ARDS 疾病模型的主要特征和造模方法 研究大部分使用豬[20-28],也有用羊[29-31]作為構建疾病模型的物種。 大動物ARDS 疾病模型的誘導方法主要包括:油酸(oleic acid,OA)輸注、脂多糖(lipopolysac?charide,LPS)輸注、鹽水灌洗、缺氧、鈍性損傷及煙霧吸入。 大部分模型為急性期模型,大動物存活時間多小于24 h。 各個模型的具體誘導方法及研究持續時間詳見表3。
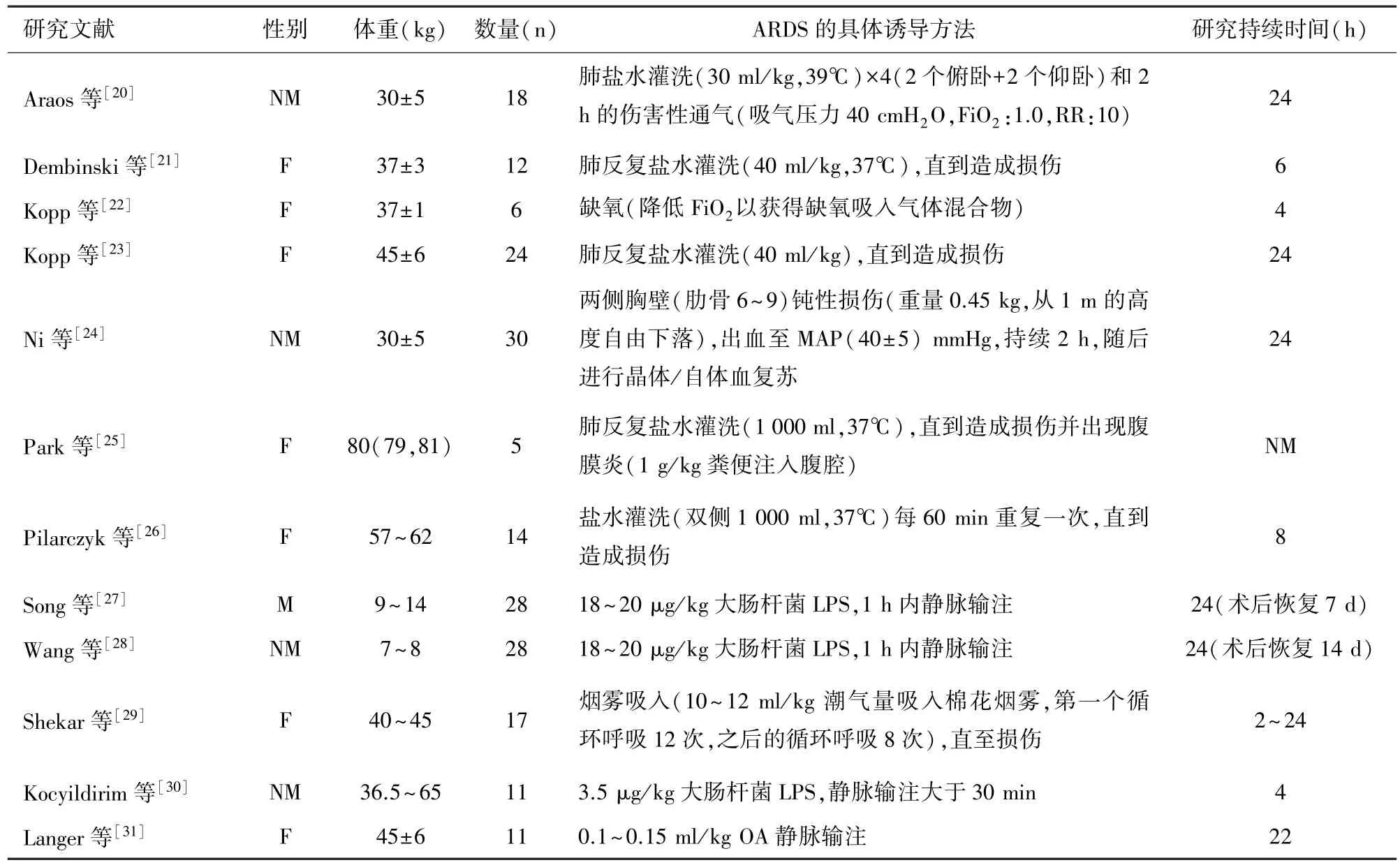
表3 V-V ECMO 大動物ARDS 疾病模型中的主要特征、造模方法和持續時間
2.2 插管相關信息及參數設置 大部分模型采用外周插管,但ECMO 插管策略及參數設置不盡相同。ECMO 的流量、膜肺的通氣量及吸入氧濃度應根據動脈血氣及 SvO2或 SaO2動態調整。 V-V ECMO 大動物模型的插管信息及參數設置見表4。
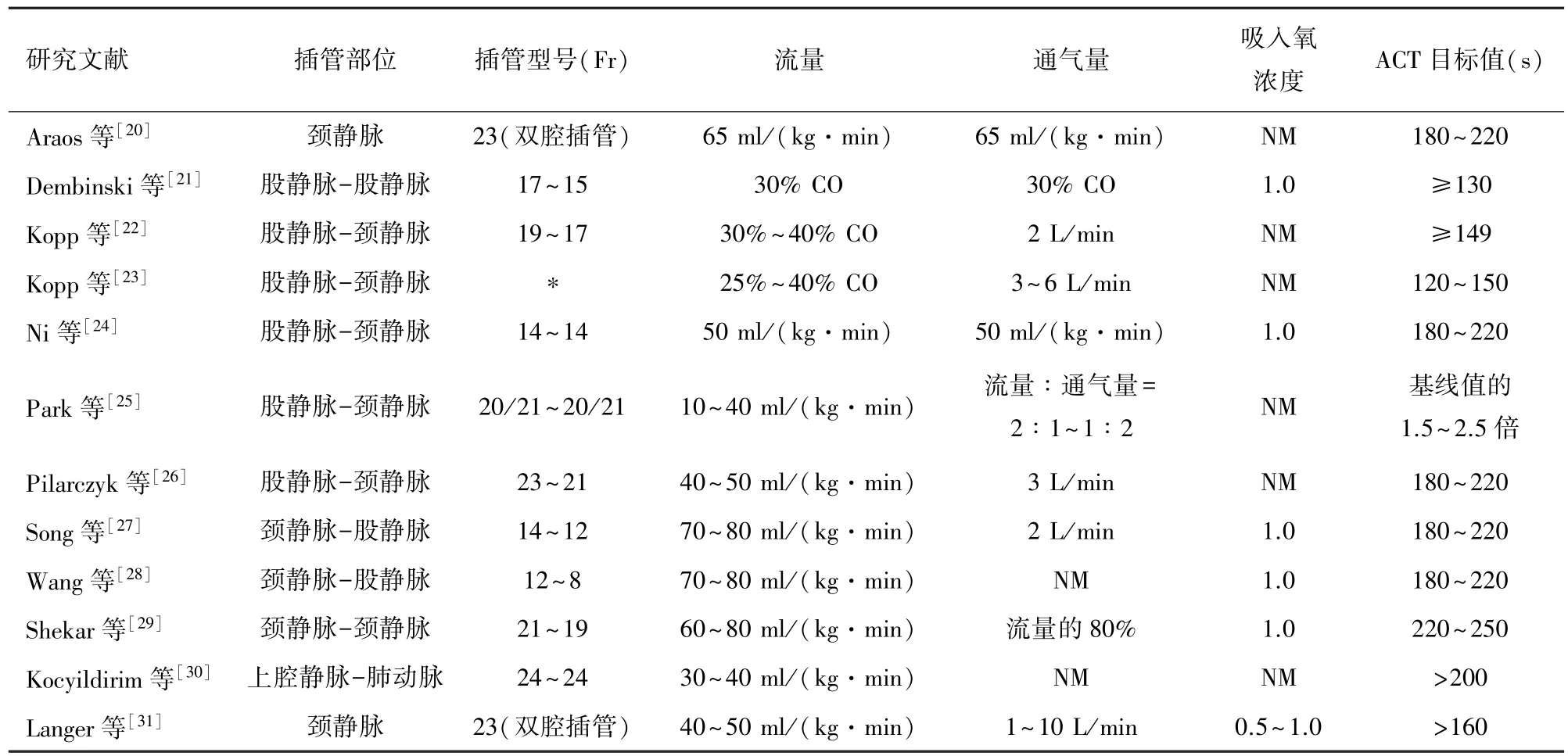
表4 V-V ECMO 大動物模型的插管信息及參數設置
3 清醒ECMO 大動物長期生存模型的建立
清醒ECMO 最重要的指征是作為肺移植的過渡治療[32-34]。 其優勢在于避免了因氣管插管、鎮靜、肌肉退化、神經肌肉并發癥、醫院獲得性感染以及移植預后不良引起的一系列不良后果。 清醒ECMO 也成功用于急性呼吸衰竭恢復的過渡治療[35],尤其是對于有創機械通氣相關風險較高的患者,如免疫力低下或慢性阻塞性肺部疾病患者[36]。 清醒 V-A ECMO 方法已用于重度肺高壓和右心衰竭相關的肺功能衰竭患者,近期有文獻報道,V-A ECMO 可作為原發性心源性休克或心臟驟停患者過渡至恢復或行心臟移植的一種治療方法,有助于降低感染風險和評估神經系統功能,可用于重癥心源性休克患者[37]。
清醒ECMO 大動物長期生存模型的建立旨在探究清醒ECMO 的病理生理改變,并為設計相關臨床試驗提供基礎。
3.1 清醒大動物模型的基本特征及研究目的 清醒ECMO 大動物長期生存模型中的大動物多為羊,部分研究未提及羊的年齡及性別信息。 現存的大部分ECMO 大動物模型為健康大動物的長期生存(清醒)模型,建立的主要目的是驗證ECMO 設備的安全及有效性。 大動物的基本特征總結詳見表5。

表5 清醒ECMO 大動物長期生存模型中羊的基本特征
3.2 大動物術前和術后的管理 大動物的術前管理、麻醉誘導及麻醉維持與ECMO 大動物短期(急性)疾病模型的方法基本相同。 ECMO 成功建立后,需確認ECMO 的流量及大動物的生命體征平穩,逐漸減停麻醉,嘗試脫機。 當大動物肌力及自主呼吸恢復后,拔除氣管插管。 術后將大動物置于監護籠中,大動物可以在籠內自由活動,自主進食水。 圍術期給予抗生素預防術后感染。
3.3 插管、參數設置及抗凝管理 為了使大動物清醒后能夠在監護籠內活動自由,研究均采用頸部血管插管。 插管型號根據動物體重及血管條件選擇。ECMO 的流量、膜肺的通氣量及吸入氧濃度根據動脈血氣及SvO2或SaO2動態調整。 ECMO 插管相關信息、參數設置及抗凝管理的具體信息詳見表6。

表6 大動物(羊)ECMO 插管相關信息、參數設置及抗凝管理
4 總 結
ECMO 從20 世紀70 年代成功進入臨床以來,從設備、應用領域到ECMO 管理策略都發生了巨大的變化,并隨著新時代的發展,產生了新的適應證和挑戰。 大動物模型的建立可以為ECMO 相關的病理生理學探究、設備研發、應用擴展、管理策略的優化等方面提供研究基礎。

