單純皰疹病毒1型DNA聚合酶輔助亞基UL42的研究進展
張云帆,陳煉凱,張蕊
中國農(nóng)業(yè)大學動物醫(yī)學院,北京100193
單純皰疹病毒1型(herpes simplex virus type 1, HSV-1)屬于皰疹病毒科α-皰疹病毒亞科,是一種具有囊膜的雙鏈線性DNA病毒。HSV-1是一種嗜神經(jīng)型病毒,通過上皮黏膜細胞感染后,一部分病毒通過裂解感染(lytic infection),引起角膜炎和口唇皰疹;另一部分病毒則沿著感覺神經(jīng)逆行到達腰背神經(jīng)節(jié),并潛伏在三叉神經(jīng)節(jié)中,直到宿主免疫力下降時再重新開始復制,啟動新一輪感染[1]。
DNA聚合酶在病毒感染過程中發(fā)揮著重要作用,也是抗病毒藥物作用的關鍵靶位。HSV-1 DNA聚合酶由和UL42共同組成:UL30為催化亞基(catalytic subunit),具有聚合酶和3’-5’外切酶活性(校對活性),負責DNA的復制[2];UL42為輔助亞基(accessory subunit),負責提高UL30的持續(xù)合成能力,以及UL30與DNA的連接[2-4]。這2個亞基在胞質(zhì)內(nèi)翻譯成蛋白質(zhì)并結(jié)合后,依賴核定位信號(nuclear location signal, NLS)共同轉(zhuǎn)運至宿主細胞核中,并與其他病毒蛋白一同參與DNA的復制[5]。本文主要介紹輔助亞基UL42的結(jié)構特點、主要功能、作用機制及其在抗病毒藥物開發(fā)中的研究進展,旨在為病毒致病機制的后續(xù)研究和抗病毒藥物的研發(fā)提供參考。
1 UL42蛋白概述
1.1 UL42蛋白的結(jié)構特點
HSV-1 UL42蛋白由488個氨基酸組成,是DNA聚合酶中的輔助亞基,也稱為持續(xù)合成因子(processivity factor),在不同皰疹病毒中高度保守。UL42 N端1~340位氨基酸是主要功能域,這段肽段負責結(jié)合UL30以形成聚合酶全酶、結(jié)合DNA以輔助病毒基因組復制,促進UL30的持續(xù)合成[6]。圖1標注了不同功能域的位置,可見C端148個氨基酸的折疊很松散,不負責UL42的基本功能[6]。
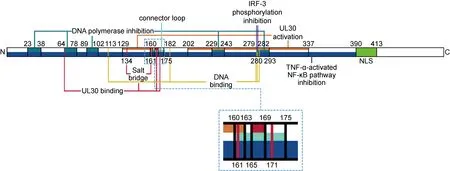
UL42 main activity domains include UL30-binding domain, UL30-activating domain and DNA-binding domain. It can also inhibit TNF-α activated NF-κB signal pathway, phosphorylation of IRF-3 and activity of DNA polymerase. In addition, UL42 contains a connector loop and one NLS.
UL42在體內(nèi)外均以單體形式存在[7],其結(jié)構與PCNA(增殖細胞核抗原)三聚體的單體結(jié)構高度相似。UL42由2個拓撲域構成,分別為29~160、175~319位氨基酸,2個拓撲域之間的旋轉(zhuǎn)角度為40°,小于PCNA的60°旋轉(zhuǎn)角度,因此UL42的結(jié)構更平面。每個拓撲域都含有2個反向平行的β折疊,各有一條支鏈βD1、βI2與對方非共價結(jié)合。兩個β折疊之間的肽段(160~175位氨基酸,詳見圖1)構成1個連接環(huán)。連接環(huán)背側(cè)有3個α螺旋,αA1位于N端,αA2、αB1位于C端,具體如圖2所示。該表面富含的正電殘基在α-皰疹病毒中高度保守,并與DNA的磷酸骨架結(jié)合,使得UL42在DNA鏈上滑動[8]。
1.2 UL42蛋白在細胞內(nèi)的定位
DNA病毒在宿主細胞質(zhì)合成DNA聚合酶,轉(zhuǎn)運至細胞核內(nèi)啟動病毒復制。研究顯示,多種皰疹病毒聚合酶輔助蛋白(polymerase accessory protein,PAP)的C端都有功能性核定位信號NLSs[9-10]。
Loregian等[11]發(fā)現(xiàn),UL30能夠通過C端pol肽中的RRMLHR序列介導入核,該NLS是UL30唯一的NLS,屬于非經(jīng)典NLS。Alvisi等[5]發(fā)現(xiàn),UL42 C端含有1個雙分型NLS(NLSbip:PTTKRGRSGGEDARADALKKPK413),位于 391~413位氨基酸,介導入核轉(zhuǎn)運需要Ras相關核蛋白(Ran)、三磷酸腺苷(ATP)和內(nèi)膜蛋白(IMP),是一種經(jīng)典NLS。單獨敲除UL30或UL42的NLS并不影響HSV-1 DNA聚合酶入核,但同時敲除二者則使聚合酶失去入核能力,說明DNA聚合酶先在細胞質(zhì)內(nèi)形成復合體,再借助2個亞基的NLS轉(zhuǎn)運進入細胞核,而UL42很可能是UL30的細胞核協(xié)同轉(zhuǎn)運蛋白[5]。圖1中標注了UL42 NLS在氨基酸鏈的位置。
1.3 UL42蛋白對病毒復制的影響
目前,HSV-1 DNA的復制機制尚不完全明確,有證據(jù)表明,有7種病毒蛋白負責HSV-1 DNA的復制,包括由UL30和UL42組成的DNA聚合酶,單鏈DNA結(jié)合蛋白細胞感染多肽8(cell infection polypeptides 8,ICP8),由UL5、UL8、UL52組成的解旋酶-引物酶復合體,以及序列特異性的復制起始位點結(jié)合蛋白UL9[12]。其中最重要的是DNA聚合酶。
ICP8既是經(jīng)典的單鏈DNA結(jié)合蛋白,也是單鏈退火蛋白,對病毒感染時的DNA復制至關重要[13]。由UL5、UL8、UL52組成的解旋酶-引物酶復合體在復制叉上將dsDNA解鏈,并啟動滯后鏈的合成,但效率很低。UL30-UL42復合物與解旋酶結(jié)合能提高后者的解旋活性[14]。UL9具有部分ssDNA的3’-5’DNA解旋酶活性[15],并能夠特異性地與任意復制起始位點結(jié)合,啟動DNA的復制。UL30的酶活性可以催化DNA的合成,而UL42能夠?qū)L30與DNA模板鏈結(jié)合,提高全酶的持續(xù)合成能力[2]。二者構成HSV-1 DNA聚合酶全酶,在HSV-1 DNA合成與病毒復制過程中發(fā)揮了至關重要的作用。
2 UL42蛋白輔助病毒復制的分子機制
2.1 UL42與UL30的結(jié)合機制
UL30 1200~1235位氨基酸形成的α螺旋是主要的UL42結(jié)合位點,而UL42 N端三分之二的區(qū)域能夠在體內(nèi)外與UL30結(jié)合并發(fā)揮作用[6]。UL42與UL30單純的物理結(jié)合并不能提高其催化能力[16],說明兩者的相互作用更為復雜。Hamatake等[17]用胰蛋白酶消化UL42時,發(fā)現(xiàn)兩種富含精氨酸與賴氨酸的片段,在dsDNA存在時不被胰蛋白酶消化,其相對分子質(zhì)量分別為2.8×104和8×103。限制性酶切發(fā)現(xiàn),2.8×104片段為1~245位或1~254位氨基酸,8×103片段起始于255位氨基酸,可能終止于319、340或370位氨基酸。2.8×104和8×103混合物能夠與UL30結(jié)合并激活其酶活性,且兩者無法通過純化分離,說明其共存時相互連接,并與UL30結(jié)合。這2個片段可能包含了UL42的UL30結(jié)合域的最小范圍。
Zuccola等[8]研究發(fā)現(xiàn),UL42與UL30之間有多種作用形式,兩個蛋白的主鏈上,UL30 A1208的羰基氧和UL42 V296的氮連接,UL30主鏈的A1235、L1234之間的氫鍵與UL42 K289側(cè)鏈的氨基發(fā)生作用。兩蛋白的側(cè)鏈之間也形成多個氫鍵連接,包括UL30 R1224、D1232、H1228與UL42 D63、R64之間的3個氫鍵,以及R1229、Q171、E1211三者之間形成的氫鍵網(wǎng)絡。UL42連接環(huán)的165~169位氨基酸與UL30的1211~1216位氨基酸形成反向平行的氫鍵。UL30的H1228、R1229與UL42的R64、Q171是2個蛋白相互作用的關鍵結(jié)合位點。此外,破壞UL42 E161和R134之間的鹽橋可能會影響UL42與UL30的結(jié)合。圖1中標注了部分與UL30結(jié)合相關的位點或肽段。
2.2 UL42促進UL30持續(xù)合成能力的機制
UL42作為DNA聚合酶中的持續(xù)合成因子,與UL30結(jié)合后可以激活其持續(xù)合成病毒基因組的能力。研究表明,UL30 C端227個氨基酸負責與UL42功能性相互作用[18]。Monahan等[19]為了確定UL42中同時與UL30物理及功能性相互作用的區(qū)域,構建了一系列突變體。他們發(fā)現(xiàn),d129~163和d202~337兩個突變體不能激活UL30,說明這2個區(qū)域是UL42激活UL30的功能域。其中129~163區(qū)域為螺旋-卷曲-螺旋結(jié)構,不影響UL42與UL30的物理結(jié)合,其中的157位氨基酸對UL42的功能非常重要。202~337區(qū)域可能不止一個功能域,然而由于實驗靈敏度不足,尚未確定該區(qū)域是否也與UL30-UL42的物理結(jié)合相關。圖1中標注了以上兩個區(qū)域在氨基酸鏈上所處的位置。
研究表明,UL42對dsDNA具有高度親和力,而UL30對ssDNA的親和力更高[20-21]。Weisshart等[22]發(fā)現(xiàn),UL42通過提高UL30對dsDNA的特異性結(jié)合,以減少全酶從模板鏈上解離。Gottlieb等[23]利用Tsurimoto 和Stillman[24]制備的引物模板模型,發(fā)現(xiàn)當UL42與UL30結(jié)合后,全酶對引物模板鏈3’端的親和力增加了10倍。他們認為,UL42在全酶內(nèi)作為滑動夾子,通過增加UL30與引物模板鏈3’端的親和力來提高其持續(xù)合成能力。Chaudhuri 和Parris[25]發(fā)現(xiàn),UL42對引物模板的親和力與穩(wěn)定性隨著離子強度的增加而降低,而UL30-UL42復合物對離子強度變化不敏感,說明UL42并非僅僅通過與UL30結(jié)合而提高其持續(xù)合成能力。他們猜測,UL42可能和T7 DNA聚合酶[26]一樣,UL30 C端與UL42結(jié)合后,其無序的構象會發(fā)生變化,可能會在DNA周圍形成更緊密的構象,導致解離率降低。
基于Gottlieb和Challberg[23]的猜想, Chow和 Coen[27]提出了如下假設:不同于其他持續(xù)合成因子,UL42與DNA的結(jié)合能促進UL30的活性。為了證明此猜想,他們試圖找到只影響DNA結(jié)合活性、不影響UL30結(jié)合活性的UL42突變體。結(jié)果表明,插入突變體I-203和I-206不能與dsDNA結(jié)合、無法刺激UL30,卻能與UL30形成免疫共沉淀,保留了DNA聚合酶的基本功能,證明了UL42在體內(nèi)外增強UL30的持續(xù)合成能力需要DNA結(jié)合活性。
Zuccola等[8]建立了UL42/Pol/DNA的模型,發(fā)現(xiàn)在UL42與DNA結(jié)合的正電表面有5個保守的殘基可能與DNA結(jié)合有關,分別為R113、R182、R279、R280、Q282。Randell等[28]用Ala替代4個保守的Arg,構建出4個單突變UL42,發(fā)現(xiàn)UL42與DNA的結(jié)合受到了影響。雖然UL42與UL30的結(jié)合并不受影響,但長鏈DNA的合成卻隨之減少,說明UL42結(jié)合DNA與結(jié)合UL30的能力是相互獨立的,但UL42結(jié)合DNA的能力的確能夠影響UL30合成長鏈DNA的能力。圖1中標注了與DNA結(jié)合有關的所有位點。
2.3 UL42在DNA鏈上的移動機制
在DNA復制過程中,前導鏈需要持續(xù)合成因子,以保證每次催化后,DNA聚合酶不會從模板鏈上解離。持續(xù)合成因子通過與催化亞基和DNA鏈相互作用,增加全酶的作用時間,例如滑動夾子模型。許多持續(xù)合成因子都通過形成滑動夾子環(huán)繞在DNA上,在不影響合成速度的同時促進DNA合成,包括PCNA、E.coli Pol Ⅲ的β亞基、T4噬菌體等。滑動夾子并沒有DNA親和力,與DNA的結(jié)合依賴于夾子載體和ATP[29]。
Weisshart等[22]認為,UL30-UL42復合物與DNA穩(wěn)定結(jié)合的同時,并不會降低DNA的合成速度,因此其移動機制必定與滑動夾子不同。他討論了ratcheting模型和sitting模型(由Thomas J. Kelly提出)兩種模型,用于解釋UL30-UL42復合物在模板鏈上的移動機制。在ratcheting模型中,催化導致酶發(fā)生了構象變化,與模板鏈特異性強的構象占主導地位,同時UL42的DNA結(jié)合活性下降,便于聚合酶在模板鏈上移動。T4 DNA聚合酶是此模型的典型代表。而在sitting模型中,UL42始終結(jié)合在模板鏈的初始結(jié)合位點,DNA鏈穿過UL30進入UL42,并被擠出。這種模型與T7RNA聚合酶的scrunching模型非常相似[30]。但Randell等[29]發(fā)現(xiàn),UL42能在保持高親和性的同時沿著DNA滑動,這與sitting模型相反,反而能夠解釋ratcheting模型。圖3為3種移動模型的示意圖。
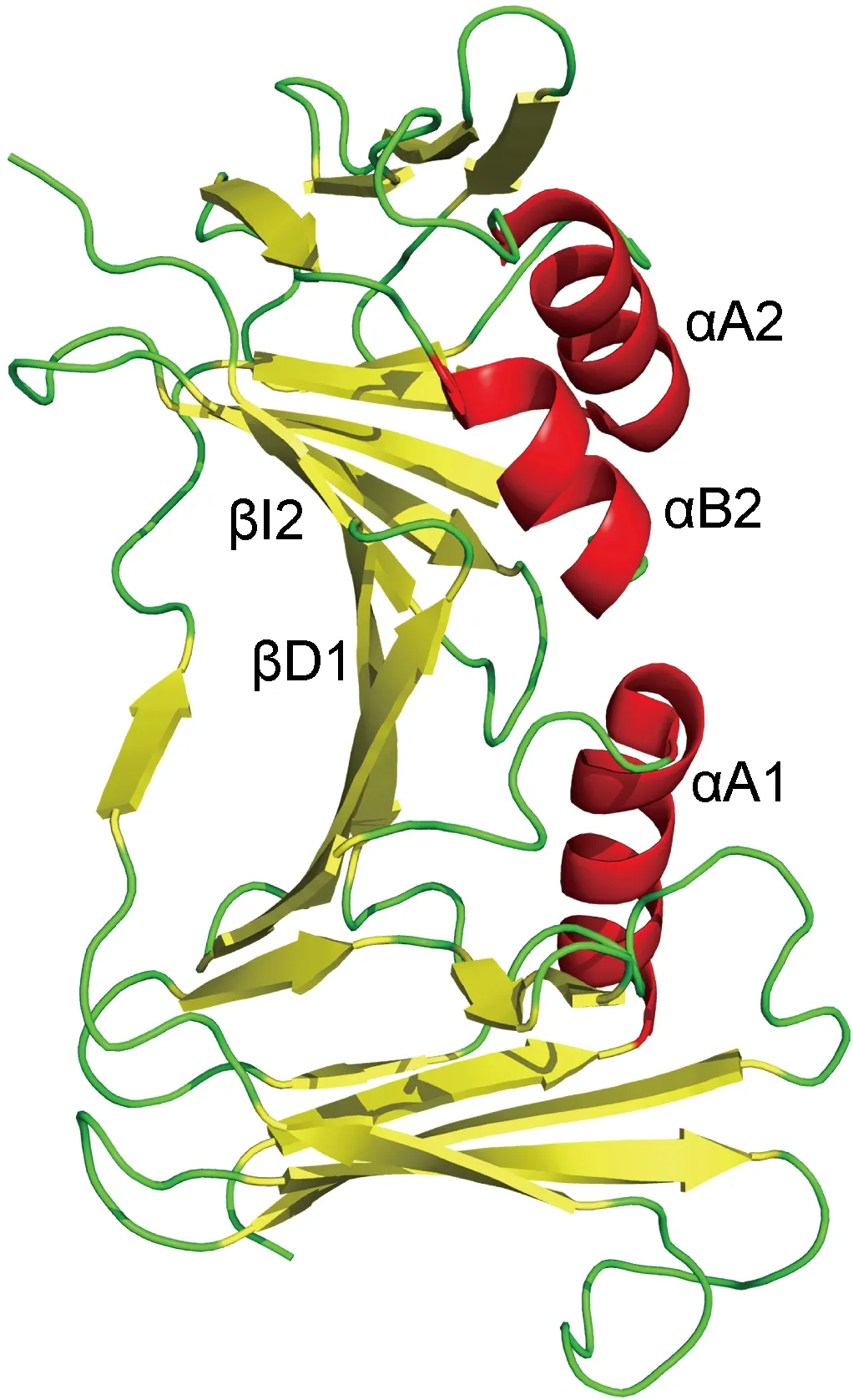
UL42 is composed by two antiparallel beta sheets, these two domains interact noncovalently through βD1 and βI2. The connector loop covalently connects the two domains. The opposite of the connector loop is three α helices: αA1、αA2、αB2.
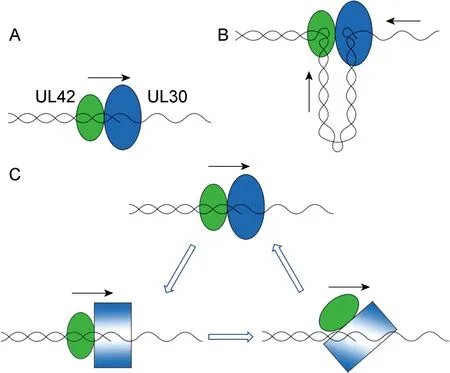
A. Sliding clamp model: lacking in DNA affinity and depending on clamp loader and ATP. B. Sitting model: UL42 remains at the initial binding site. After being squeezed out of UL30, DNA enters UL42. C. Ratcheting model: the catalytic activity causes a conformational change on UL30, and binds to DNA with a template-specific conformation. UL42 DNA-binding activity decreases, and thus the polymerase moves alone the template.
Zuccola等[8]綜合了以上觀點,提出了如下猜想:UL42通過靜電作用與DNA結(jié)合并滑動。UL42連接環(huán)的背側(cè)表面為正電,可與DNA的負電磷酸骨架發(fā)生靜電相互作用,使得UL42沿著其骨架滑動。不與UL30結(jié)合時,UL42只能進行單向、隨機的移動;與UL30結(jié)合后,兩者的復合物獲得了動力和方向。
3 UL42抑制宿主天然免疫通路的分子機制
NF-κB是一類轉(zhuǎn)錄因子,在炎癥、免疫、細胞增殖、分化和生長等細胞活動中發(fā)揮重要作用,會影響多種基因的表達[31],是重要的免疫因子。TNF-α是固有免疫中重要的多功能細胞因子,能夠誘導免疫應答中多種基因的表達,可經(jīng)一系列反應激活NF-κB[32-33]。Zhang等[34]發(fā)現(xiàn),UL42通過其N端(1~390位氨基酸)結(jié)合p65和p50,阻礙后者的核轉(zhuǎn)移,抑制TNF-α激活的NF-κB信號通路。R113、R279和R280是UL42與DNA結(jié)合的關鍵殘基[28],并位于UL42 N端,可能與NF-κB信號通路的抑制有關。突變UL42的3個DNA結(jié)合位點(R113、R279和R280)使UL42失去阻礙p65和p50核轉(zhuǎn)移的能力,抑制NF-κB信號通路激活的作用也有所下降,表明這3個保守的Arg在UL42抑制NF-κB信號通路激活中具有重要作用。此外,UL42還可以抑制NF-κB誘導激酶(NF-κB inducing kinase, NIK)和NF-κB激酶抑制劑α(inhibitor of nuclear factor kappa-B kinase, IKKα)誘導的NF-κB啟動子活性,提示UL42還可能抑制非經(jīng)典NF-κB信號通路[34]。圖1中標注了抑制TNF-α激活的NF-κB信號通路有關的肽段。
Chapon等[35]建立了HSV-1基因組的轉(zhuǎn)座子插入突變體庫,發(fā)現(xiàn)UL42能夠調(diào)控干擾素(interferon,IFN)調(diào)控因子3(IRF-3)的功能。UL42特異性抑制IRF-3磷酸化,進而下調(diào)IFN-β的轉(zhuǎn)錄。R279-280A突變體既不能影響IFN-β的激活,也不能與IRF-3結(jié)合,表明這2個Arg在抑制IFN-Ⅰ產(chǎn)生中也具有關鍵作用。圖1中標注了這2個位點在氨基酸鏈上的位置。
4 UL42在抗病毒藥物開發(fā)中的研究進展
Owsianka等[36]根據(jù)UL42的氨基酸序列,合成了96個十五肽,以檢測UL42是否含有可以抑制DNA聚合酶活性的肽段,并得到了5個十五肽,分別為23~38、64~78、89~102、229~243、279~293位氨基酸。后4個肽段可能通過與DNA結(jié)合發(fā)揮其抑制作用,而第1個肽段的抑制機制有待進一步研究。但遺憾的是,這5個肽段特異性有限,并不適合作為抗病毒藥物研發(fā)的先導化合物。圖1中標注了這5個肽段的位置。
RNA沉默是脊椎動物常見的抗病毒機制,可由RNA干擾(RNA interference, RNAi)誘導產(chǎn)生,導致靶mRNA特異性降解[37]。Mollaei等[37]設計了2種靶向HSV-1 UL42 mRNA的siRNA,轉(zhuǎn)染siRNA的HeLa細胞形成的HSV-1病毒空斑顯著減少,同時未發(fā)現(xiàn)細胞病變。Real-time PCR結(jié)果顯示,siRNA能夠阻斷UL42基因表達,顯著抑制HSV-1 DNA的復制,提示RNAi可以作為抑制HSV-1的有效手段,并且UL42特異性siRNA不會對宿主細胞造成傷害。
阿昔洛韋是首個用于治療HSV的藥物。此外,還有其前體藥物萬乃洛韋、噴昔洛韋及其前體藥物泛昔洛韋,這4種藥物的磷酸化形式均可作為病毒DNA聚合酶競爭性抑制劑,以抑制DNA合成[38-39]。然而,由于這類藥物生物活性較弱、半衰期短,加之HSV能夠長期潛伏在神經(jīng)節(jié)內(nèi),并不能阻止HSV復發(fā)。鑒于以上情況,研究HSV DNA復制相關因子的功能與結(jié)構,對于研發(fā)長期有效的抗病毒藥物具有啟發(fā)作用。
目前,有效阻斷或干擾蛋白之間相互作用的抑制劑成為研究熱點。HSV-1的DNA聚合酶2個亞基的相互作用為抗病毒研究提供了一個有力靶位。Liuzzi等[40]設計了一種HSV RNR抑制劑,命名為BILD 1263,通過抑制RNR亞基之間的結(jié)合來抑制HSV-1、HSV-2及耐阿昔洛韋HSV的體內(nèi)復制。Loregian等[11]發(fā)現(xiàn),利用UL30 C端27個氨基酸可以破壞HSV-1 UL30與UL42之間的相互作用,病毒復制也無法進行。以上證據(jù)為研發(fā)抗HSV-1藥物提供了新的研究方向。
5 HSV-1 UL42同源蛋白的研究進展
作為皰疹病毒復制過程中重要的輔助亞基,HSV-1 UL42擁有多種同源蛋白,包括PRV(pseudorabies virus)UL42、HCMV(human cytomegalovirus)UL44、KSHV(Kaposi’s sarcoma-associated herpesvirus)PF-8、HHV-7(human herpes virus-7)UL27、EBV(Epstein-Barr virus) BMRF1等。這些蛋白無論是在結(jié)構還是功能上,都具有一定的相似性。對UL42的結(jié)構功能研究,能夠啟發(fā)對其他同源蛋白的探索。
偽狂犬病毒(Pseudorabies virus, PRV)的DNA聚合酶同樣由UL30和UL42蛋白組成,其UL42含有384個氨基酸。與HSV-1相同,PRV UL42能夠單獨與UL30相互作用,并提高其復制能力[41];可通過單體形式與dsDNA結(jié)合[42]。PRV UL42含有2個單分型NLS和1個雙分型NLS,只有雙分型NLS(354~370位氨基酸)真正具有核定位作用,因此PRV UL30只有在UL42存在時才能轉(zhuǎn)運入核[43]。使用siRNA敲低UL42能夠顯著抑制PRV復制,但尚不清楚UL42對病毒復制的作用與其核定位功能之間是否具有相關性[44]。
人巨細胞病毒(human cytomegalovirus,HCMV)的DNA聚合酶由催化亞基UL54和持續(xù)合成因子UL44組成。HCMV的UL44含有433個氨基酸,156~290位氨基酸為DNA結(jié)合域。UL44能以二聚體或單體形式與dsDNA高親和性結(jié)合,其結(jié)合不依賴于滑動夾子和ATP[45]。UL44背側(cè)面上有一凸出的可動環(huán)(flexible loop),是結(jié)合宿主細胞核與病毒DNA的必需片段,但不涉及與UL54的結(jié)合[46]。UL44的N端折疊形成頭對頭的同源二聚體,稱為C形夾子[45]。借助背側(cè)面和C形夾子形成的間隙環(huán),UL44可以環(huán)繞在DNA上[47]。未二聚化的UL44無法支持DNA的持續(xù)合成,但并不影響與UL54的相互作用及入核[48]。HCMV UL44僅有一個NLS,位于425~431位氨基酸[10]。
卡波氏肉瘤病毒(Kaposi’s sarcoma-associated herpesvirus,KSHV)的持續(xù)合成因子為PF-8,與dsDNA具有親和力,與催化亞基Pol-8結(jié)合后促進其復制能力[49]。PF-8與HCMV UL44同樣能夠形成頭對頭的同源二聚體,但前者缺少間隙環(huán),無法環(huán)繞DNA,提示兩者的DNA結(jié)合機制可能不同[50]。在此過程中,10~27位氨基酸負責與Pol-8相互作用,N端和279~301位氨基酸負責結(jié)合dsDNA,共同提高Pol的合成能力[51]。而與HSV-1 UL42一樣,PF-8的C端與主要功能無關。1~21位、277~304位氨基酸是實現(xiàn)二聚化的重要片段[52]。PF-8通過C端的NLS(369~377位氨基酸),并通過N端或C端某一肽段與Pol-8結(jié)合,來介導Pol-8入核[9]。
6 小結(jié)
HSV-1的潛伏感染和反復發(fā)作,對公共衛(wèi)生造成了嚴重影響。UL42作為HSV-1重要的DNA聚合酶組成亞基,具有調(diào)控病毒DNA復制和拮抗宿主天然免疫反應的雙重作用,但仍須進一步的機制研究。圖1總結(jié)了UL42的主要功能域及其分布情況。考慮到結(jié)構和功能的相似性,對HSV-1 UL42同源蛋白的研究可為其機制的探索提供基礎。未來的研究應集中于對UL42參與生理和病理過程分子機制的闡述,以及篩選能夠與UL42 DNA特異性結(jié)合域互補的抗病毒藥物。對UL42蛋白功能和作用機制的進一步闡釋,將為理解皰疹病毒在細胞和宿主體內(nèi)的生命周期、病原和宿主細胞的相互作用以及特異性抗病毒藥物的開發(fā)提供重要的參考數(shù)據(jù)。

