載藥明膠微球劑的制備及應用研究進展
張奇珍, 尹明明, 余曼麗, 陳福良
(中國農業科學院 植物保護研究所,北京 100193)
0 引言
傳統劑型農藥存在持效期短、有效利用率低以及因過量使用或重復使用而引發一系列環境污染及對非靶標生物危害等問題[1],由此推動了微囊劑(microcapsules)[2]、微球劑(microspheres)[3]、緩釋顆粒劑(granules)[4]等農藥緩控劑型的研發,其中微球劑具有靶向給藥、控制釋放、抵抗環境因素 (紫外線、水分、微生物、酶等) 干擾、減少環境污染等特點[5]。微球劑的研究始于美國,于1985年首次報道[6],此后陸續研究開發了部分農藥微球劑[7-8]。微球劑過去統稱為微囊劑,隨著科技的進步及電鏡掃描技術的發展,發現微球劑與微囊劑之間有明顯區別。《中國藥典》對微球劑的定義為活性成分溶解或均勻分散在輔料中形成的微小球狀實體 (一般規定其粒徑范圍為1~250 μm),而微囊劑定義為固態或液態活性成分被輔料包封而形成的微小膠囊[9]。國際純化學與應用聯合會(IUPAC) 及《中國藥典》(2010年版) 已把微球劑從微囊劑中區分開來,單獨歸為一種新的劑型—微球劑[9]。美國食品藥品安全管理局 (FDA) 已批準上市了多個醫藥微球劑品種[10-11]。相比于國外,中國對微球劑的研究起步較晚,研究較淺。雖然微球劑在醫藥領域的應用已成為近年來研究的熱點[12-13],但在農藥領域仍處于探索階段。
調控微球劑中藥劑的釋放最重要的因素在于載體材料的選擇和制備工藝的優化。明膠 (gelatin)是由18種氨基酸與多肽交聯形成的直鏈聚合物(圖式1) ,無毒、無抗原性,是目前應用較多且具有緩釋作用的一種天然高分子載體材料[14]。以明膠為載體的載藥體系已被廣泛應用于醫藥微球劑的制備,不僅提高了藥物的穩定性,而且通過緩釋作用,提高了藥物療效,降低了毒副作用[15-16],展現出廣闊的應用前景。
關于明膠微球劑在醫藥領域的研究進展前人已進行過相關綜述[17],其中對明膠-醫藥微球劑的性質及制備方法進行了概述,重點論述了乳化法制備時乳液的形成機理等,目前尚未見以明膠為載體或明膠與其他材料一起形成的復合材料為載體的農藥微球劑的制備及應用的相關綜述。鑒于此,本文介紹了明膠微球劑的制備方法,論述了近年來在農藥、醫藥等領域明膠微球劑及其復合載體微球劑的研究和開發應用,旨在為利用明膠微球劑作為農藥緩釋劑進行綠色防控提供新思路,以期促進明膠微球劑在農藥領域的開發應用。
1 明膠微球劑的制備方法
明膠微球劑的制備主要有噴霧干燥法、乳化-溶劑揮發法、交聯法和相分離法等。實際制備過程中,根據所包埋藥物的性質,如化學結構、穩定性等,選擇匹配的制備方法以達到良好效果(表1) 。
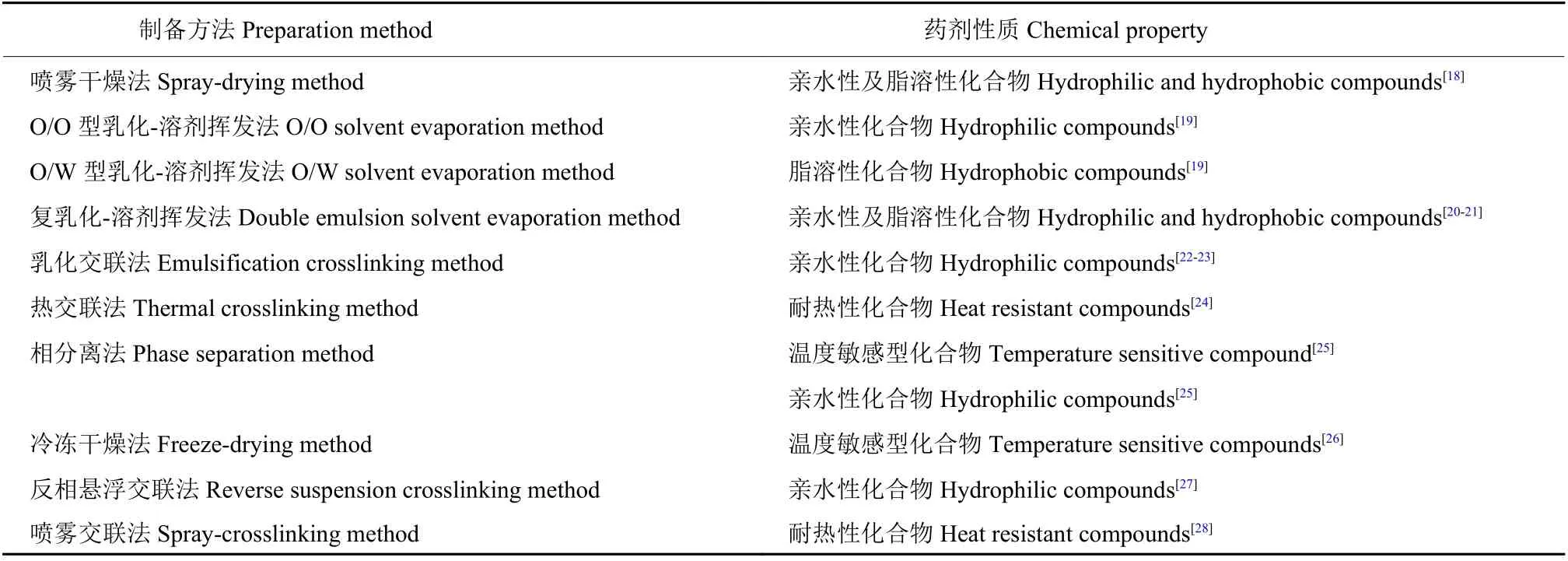
表1 藥劑性質與明膠微球劑制備方法的對應關系Table 1 Correspondence between the properties of the compound and the preparation method of gelatin microspheres
1.1 噴霧干燥法
噴霧干燥法 (spray-drying method) 是最易于實現工業化生產的微球劑制備方法,其原理是通過霧化器將所制備的溶液或乳狀液分散成極小的液滴 (粒徑一般小于50 μm) ,通過壓縮機產生的熱空氣使液滴迅速干燥,將粉末與水蒸氣分離,最后收集粉末即得微球劑 (分散成很細的微粒)[24]。在不同的制備條件下 (料液組成、載體濃度、交聯劑濃度、交聯時間、蠕動泵轉速及進風溫度等) ,微球劑的粒徑、形貌和載藥量等也不同。陳福良等[3]采用噴霧干燥法制備了呋蟲胺 (dinotefuran) 明膠微球劑 (圖1) ,為中空微球劑,載藥量為20%,包埋率達98%,粒徑 (D50) 為12 μm。
Tran等[29]利用噴霧干燥法制備了更昔洛韋(ganciclovir,GCV) 明膠微球劑,并對制備參數進行了優化。結果表明,通過調節交聯時間 (0~60 min)、交聯濃度及明膠/GCV的比例,構建出粒徑可控 (5~10 μm) 且高負載 (載藥量68%) 的微球劑,其釋放動力學與明膠/GCV比之間存在線性關系,呈現出不同的釋放性能,實現了藥物釋放的可控性。
與其他方法相比,噴霧干燥法具有有效成分利用率高、制備過程簡單、成球速度快、生產效率高和適合規模放大等優勢,對親水性及疏水性化合物均適用[18],宜于連續化工業生產。通過調節壓力、蠕動泵轉速及噴嘴口直徑等,實現粒徑可控。但制備過程中需要較高溫度 (>100 ℃) ,而在此條件下明膠很容易水解變性,進而影響微球劑的機械強度,即不適宜對溫度敏感型化合物 (熱敏型物料) 進行包埋[30]。
1.2 乳化溶劑揮發法
乳化-溶劑揮發法 (emulsion solvent evaporation method) 是制備微球劑常用的方法之一。根據分散相與連續相的不同,可分為單乳法和復乳法 ,其中聚合物載體、有效成分、乳化劑、水相組成、液滴分散方式和溶劑揮發速率等都會對微球劑的性能產生影響[5]。
1.2.1 單乳化-溶劑揮發法 單乳化-溶劑揮發法(single emulsion solvent evaporation method) ,根據制備過程中的乳液類型體系可分為水包油(O/W)型和油包油(O/O)型乳化-溶劑揮發法。O/W型乳化-溶劑揮發法是將有效成分和載體溶解在有機溶劑 (如丙酮或二氯甲烷) 中,并將其分散到含有乳化劑的水相中,通過機械攪拌或超聲分散成O/W型乳液,除去內相溶劑后固化成球[31]。Huda等[32]采用O/W型乳化-溶劑揮發法制備了明膠-聚己內酯微球劑,粒徑為5~20 μm,通過調整明膠與聚己內酯的比例,構建了不同的載藥體系。
單乳化-溶劑揮發法操作簡單,對設備要求不高,尤其適合于實驗室等場所。其中,O/W型乳化-溶劑揮發法適用于包埋脂溶性化合物[33-34],對于親水性化合物,由于在溶劑揮發過程中有效成分會逐漸擴散進入水相,導致有效成分流失,很難獲得較理想的包埋率[35]。對于水溶性有效成分微球劑的制備,O/O型乳化-溶劑揮發法則更為適合,但此法制備的微球劑干燥時間普遍較長,且固化后的微球劑因外表面沾有油珠,需用有機溶劑 (如環己烷等) 清洗,存在部分安全隱患[26]。此外,O/O法制備的微球劑與O/W法相比,部分有聚集現象,微球劑中活性成分多以結晶形式存在,表面可能會出現裂隙等不規則形狀[24]。
1.2.2 復乳化-溶劑揮發法 復乳化-溶劑揮發法(double emulsion solvent evaporation method) 是在單乳化-溶劑揮發法的基礎上改進而來的,包括O/W/O和W/O/W 兩種乳液體系。首先,制成O/W或W/O型初乳乳化體系;然后,將初乳乳化體系分散到水或揮發性溶劑中形成O/W/O或W/O/W型復乳乳化體系;之后以超聲、減壓、加熱等方法除去體系中的溶劑,固化干燥后制成微球劑[24]。
復乳化-溶劑揮發法是制備多肽蛋白類藥物微球劑最常用的方法。劉海峰等[36]采用復乳化-溶劑揮發法制備了5-氟尿嘧啶明膠-聚乳酸微球劑,以混合型乳化劑V(Tween-80) :V(Span-80) = 5 : 1作為初乳乳化體系,引入O-羧甲基殼聚糖作為復乳乳化體系,經優化乳化劑種類及用量、5-氟尿嘧啶濃度和聚乳酸分子質量等參數,構建出表面形貌規整且體外釋放性能良好的載藥微球劑。
該法可實現親水性及脂溶性化合物的包埋,且宜于包埋活性大分子化合物 (蛋白質、多肽等),但其制備參數較多,工藝比較復雜,放大規模的工業化生產較為困難[20-21]。
1.3 交聯法
交聯法 (crosslinking method) 是以有效成分與高分子材料的混合水溶液為水相,以含乳化劑的有機溶劑為油相,經混合攪拌乳化后先形成穩定的W/O型乳液,再采用加熱或者乳化交聯的方法使之固化,最終得到載藥微球劑。
1.3.1 乳化交聯法 應用乳化交聯法 (emulsification crosslinking method) 制備微球劑時,其制備參數如藥劑濃度、攪拌轉速以及交聯劑用量等均可影響微球劑的粒徑及包埋率等,進而影響藥劑的釋放速率。Yu等[37]采用乳化交聯法制備了對乙酰氨基酚明膠微球劑,分析了交聯劑用量、藥物含量和轉速對載藥量和包埋率的影響,以及藥物含量和轉速對微球劑粒徑的影響,構建出載藥量高且粒徑合適的對乙酰氨基酚明膠微球劑,釋藥率可達60%~89%,在一定程度上實現了藥物緩釋性。傳統的土壤調節劑可以調節過度使用或污染的土壤,但在使用中存在著效率低、難降解、對環境有害等問題。Wu等[38]通過乳化交聯法構建了磷酸銨鎂明膠-殼聚糖微球劑,可提高土壤保水性,是一種能夠沉淀游離重金屬離子、促進作物生長,且易被環境中的微生物降解的環保型土壤調節劑。
采用乳化交聯法制備親水性小分子微球劑操作簡便[22-23],易于實現機械化和工業化生產,可以將微球劑的粒徑控制在納米級范圍內,有利于保持藥物完整結構和生物活性的穩定,但在制備過程中涉及到毒性較大的交聯劑,存在安全隱患[39]。
1.3.2 熱交聯法 熱交聯法 (thermal crosslinking method) 是將明膠水溶液加熱至50℃左右后倒入植物油中,在高溫下乳化一定時間后冷卻至40℃左右,經離心、洗滌、干燥,得到未交聯的明膠微球劑;再將其加入到已預熱至180℃的植物油中,通過加熱交聯、過濾、洗滌、干燥制得[24];或將未交聯的明膠微球劑置于預熱至180℃的烘箱中加熱交聯直接獲得[24]。吳姝雯等[40]采用熱交聯法制備了作為栓塞劑的明膠微球劑,粒徑為50~1 400 μm,溶脹率達150%~400%,表面光滑且分散性良好,通過正交試驗證明,明膠濃度對微球劑的平均粒徑及溶脹率均具有響應行為,但該方法制備時間過長 (超過1 d),因此在實際開發應用中受限。
1.4 相分離法(凝聚法)
相分離過程 (phase separation method) 就是凝聚過程,故也稱為凝聚法,可分為單凝聚法和復凝聚法[41]。
1.4.1 單凝聚法 單凝聚法 (single coacervation method) 是指在有效成分與聚合物共存的有機溶液中,加入另一種能與溶解聚合物的溶劑任意混溶、但不能溶解有效成分和聚合物的有機溶劑,通過物理或化學等方法降低高分子聚合物的溶解度,最后凝聚、固化成球[24]。El-Samaligy等[42]將明膠-吐溫20混合溶液在pH值5.5~6.5條件下進行反應,經過一系列處理后得到粒徑為180~300 nm(平均粒徑 (232 ± 58) nm) 的作為阿霉素和放線菌素D吸附劑的明膠微球劑,球體光滑且無聚集現象。但該方法制備的微球劑粒徑分布較寬,且操作繁瑣,不適合工業化生產,因而未得到大范圍推廣。
1.4.2 復凝聚法 復凝聚法 (complex coacervation method) 是指使用帶相反電荷的兩種高分子聚合物作為復合載體,將有效成分分散在復合載體中,在適當條件下 (如改變pH值、溫度、濃度、電解質等) ,使得帶相反電荷的高分子聚合物通過靜電作用形成絡合物,導致溶解度降低而凝聚成微球劑[24]。
常用的復合載體有明膠-阿拉伯膠、明膠-羧甲基纖維素和殼聚糖-阿拉伯膠等。楊愷等[43]采用明膠-阿拉伯膠制備了阿維菌素 (abamectin) 微球劑,平均粒徑約為5.64 μm,平均包埋率為64.48%。紫外光譜分析表明,阿維菌素在微球化前后性質未發生變化;熱穩定性試驗表明,其可在4~50 ℃范圍內保存,具有良好的穩定性和實用價值。Basu等[44]以殼聚糖和明膠為復合載體,采用復凝聚法制備了鹽酸曲馬多微球劑,未使用戊二醛等化學交聯劑,利用靜電相互作用的可逆物理交聯來取代化學交聯,避免了化學交聯劑的毒副作用和其他不良影響,是一種理想的給藥體系。
綜上:相分離法適合用于制備親水性小分子化合物的微球劑,其包埋率可達90%以上,且釋藥效果良好,可滿足低溫操作要求,適宜包埋溫度敏感型化合物[25];但因其精準而嚴格的實驗條件控制要求和成本偏高等因素,且操作較為繁瑣,難以工業化生產,限制了其應用[25]。
1.5 其他方法
除上述制備方法外,還可通過其他一些制備方法,如噴霧交聯法[45-46]、冷凍干燥法[47]、反相懸浮交聯法[48]、反乳液交聯法[49-50]等得到粒徑可控、表面光滑的明膠微球劑。在實際的研究和應用中,可以根據藥劑性質、施藥對象、施用部位等因素,調節微球劑所需的粒徑尺寸、載藥量、包埋率以及緩釋度、緩釋時間等,從而選用合適匹配的制備方法。
2 明膠復合微球劑
明膠兼具蛋白質和高分子材料的雙重特性,由于其結構中含有不同種類的活性官能團,使其具備多種交聯及改性的可能,其與殼聚糖、海藻酸鈉等材料構建的復合載體微球劑可以有效改善單一明膠微球劑熱穩定性較差及在藥物緩釋等方面的缺陷,采用復合載體制備的微球劑可延長藥劑釋放時間。
2.1 明膠殼聚糖微球劑
殼聚糖 (chitosan) 是由2-氨基-2-脫氧-β-D-葡聚糖與糖苷鍵組合而成的陽離子聚合物,具有良好的生物相容性和抗菌性,是自然界唯一的堿性多糖[51]。殼聚糖結構中有易于修飾的羥基和氨基等基團,有利于開發為具有優良性能的殼聚糖衍生物;而明膠高分子鏈上含有氨基、羥基和羧基等活性基團,能與負載藥劑以離子鍵或氫鍵的方式結合。
Zhou等[52]以戊二醛 (GA) 為交聯劑,采用O/W型乳化-溶劑揮發法制備了以明膠和殼聚糖為復合載體的5-氟尿嘧啶 (5-FU) 微球劑,其粒徑約為300 μm。在較高含量的戊二醛(0.2 mL/g) 下,由于微空隙的收縮,提高了聚合物的剛性,進而降低了5-FU的釋放速率;在聚合物體系的釋放行為研究中發現,通過改變復合載體材料的占比可以調控5-FU的釋放動力學,明膠占比大的微球劑表現出更長的持效期,且5-FU的釋放動力學遵循Fick擴散規律。
Wang等[53]采用反相懸浮交聯法制備了作為酸性染料吸附劑的明膠-殼聚糖微球劑,粒徑約為20 μm。吸附性能研究結果顯示,其在pH為2~3、接觸時間為100 min及30 °C條件下,0.5 g/L的明膠-殼聚糖微球劑對酸性染料的吸附率可達98%,相關系數均在0.94以上,且吸附過程符合Langmuir模型和Freundlich模型,證明明膠-殼聚糖微球劑對酸性染料具有很好的吸附性能,這為制備來源廣泛、高效及可回收的吸附劑提供了基礎。同時,以明膠、殼聚糖等天然可生物降解聚合物為復合載體制備的載藥微球劑,有望成為一種新型給藥系統[53]。
2.2 明膠海藻酸鈉微球劑
海藻酸鈉 (sodium alginate) 是從褐海藻中分離得到的一種天然多聚糖,是由β-(1,4)-D-甘露糖醛酸 (M) 和α-(1,4)-L-古羅糖醛酸 (G) 兩種結構單元構成的線性共聚物[54]。海藻酸鈉作為輔助載體,具有良好的生物相容性和穩定性,但其存在對疏水性藥物負載量低、釋藥速度較快且易發生突釋等問題,而將海藻酸鈉與其他載體材料進行復合改性,可達到互補效果[55]。羅璋[56]報道了毒死蜱(chlorpyrifos) 明膠-海藻酸鈉微球劑,為解決海藻酸鈉釋藥速度較快的問題提供了良好的途徑。以海藻酸鈉和明膠為復合載體,進而形成了更為緊密的復合載體微球劑,有利于增強小分子藥物的包埋和緩釋效果。
范倩等[57]以明膠和海藻酸鈉為復合載體,以靜電噴涂的方法構建了鹽酸四環素明膠-海藻酸鈉微球劑,平均粒徑約400 μm。對該復合微球劑制備的最佳條件和藥物釋放性能等研究結果表明,將兩種載藥 (0.25、0.5 mg/L) 微球劑,在pH 1.4的酸性溶液和pH 7.4的磷酸緩沖溶液中進行釋藥性能的測定,證明了通過載藥量及環境pH對調控釋藥性能具有雙重響應性。以海藻酸鈉改善明膠的成球性,以明膠改善海藻酸鈉的力學性能,這為復合微球劑的實際應用提供了研究依據。
Amini等[58]制備的心肌細胞 (H9C2) 明膠-海藻酸鈉微球劑具有較好的生物降解率和溶脹率,且溶脹率呈指數增長,在72 h時達到峰值,溶脹比從0.04%增加到1.8%,復合微球劑的自發降解特性在第15 d達到最高水平。Xu等[59]認為明膠-海藻酸鈉微球劑對細胞的增殖和生存能力的促進作用均優于海藻酸鈉單一微球劑,因而具有潛在的研究價值。
2.3 明膠聚乳酸微球劑
聚乳酸 (poly-lactic acid,PLC) 又稱聚丙交酯,因其具有良好的機械性能且無毒無害,在藥物緩釋、細胞培養等方面得到了廣泛的研究和應用,是一種新型的生物可降解高分子材料[60]。由于聚乳酸表面親水性較差,缺乏天然高分子識別位點等,因而極大地限制了其作為生物材料方面的應用。而結合明膠分子的結構特點,將二者制備成復合載體微球劑可產生互補作用。劉海峰等[36]通過制備條件的優化,構建了成球性高和體外釋藥性能良好的5-氟尿嘧啶明膠-聚乳酸微球劑。
明膠微球劑對含纖維連接蛋白的表面具有親和力,因而,利用明膠與纖維連接蛋白之間的相互作用可對微球劑進行改性[61]。Swami等[62]利用明膠對聚乳酸微球劑的表面進行了修飾,使其能夠識別纖維連接蛋白,從而制備了酮洛芬明膠-聚乳酸微球劑,平均粒徑在43.02~69.98 μm之間,包埋率最高達81.11%;控釋試驗表明,藥物釋放受多個過程控制,其中Higuchi's方程線性度最佳,Korsmeyer-Peppas方程的對應圖同樣顯示出良好的線性關系 (r= 0.927~0.975) 。
明膠-聚乳酸微球劑可被用于體內穩定性研究,是一種有前景的位點特異性控釋體系。
2.4 明膠聚己內酯微球劑
聚己內酯 (polycaprolactone,PCL) 是一種具有生物相容性和生物可降解性的脂肪族聚酯,降解緩慢,可作為良好的藥物傳遞基質[63-64]。聚己內酯本質上是疏水性的,細胞識別位點有限,為了提高其細胞相容性,Huda等[32]采用乳化-溶劑揮發法構建了明膠-聚己內酯微球劑,同時引入少量聚乙烯吡咯烷酮 (PVP) 用以提高微球劑的粒徑分布及表面形貌。研究發現,隨著聚己內酯的濃度升高,限制了PVP在顆粒表面的錨定吸附速率,導致團聚;而通過優化明膠-聚己內酯的比例,可得到分散性及穩定性均良好的微球劑 (圖2) 。
Rao等[65]采用聚合物分散技術構建了含有異硫氰酸熒光素-牛血蛋白 (FITC-BSA) 的明膠微球劑。為了延長FITC-BSA的釋放時間,在明膠微球表面添加聚己內酯進行包裹,得到一種低成本的FITC-BSA明膠-聚己內酯微球劑。體外釋放研究顯示,大約有62%的FTTC-BSA被包埋在微球劑內部,且其釋放速率隨著聚己內酯濃度的增加而降低。
3 明膠微球劑的應用
明膠作為微球劑的載體材料,已被廣泛應用于醫學[12-13]、農藥[3,52]、化工[53]等領域,如藥物緩釋 (控釋) 、體內示蹤、靶向作用等。
3.1 明膠微球劑在醫學上的應用
3.1.1 調控藥物釋放 在應用過程中,通過微球劑擴散、載體的逐步分解或溶解,最終實現微球劑可控、穩定地釋藥。而在微球劑投入實際應用之前,可先建立數學模型以預測藥劑釋放動力學[66-67]。常用于研究藥劑釋放動力學的模型方程有4種:零級釋放動力學方程、一級釋放動力學方程、Higuchi方程和Korsmeyer-Peppas方程[68]。Tran等[29]制備了更昔洛韋交聯明膠微球劑,隨著交聯時間的變化,粒徑可控,明膠微球劑釋放機理遵循Fick擴散定律,釋放符合Korsmeyer-Peppas方程,被測配方的n指數值均 < 0.45,即擴散是釋放的主要機制,證明明膠微球劑是一種合適的給藥系統,并為明膠微球劑未來在制藥領域的應用奠定了基礎。
姜黃素具有抗氧化、抗炎、抗微生物、抗腫瘤等藥理作用,但其水溶性極低,同時在加工儲存過程中易受外界因素的影響而降解失活,這極大程度地制約了其應用。Ratanavaraporn等[69]以明膠和絲素為載體,采用O/W型乳化-溶劑揮發法制備了姜黃素明膠-絲素微球劑,控釋試驗結果表明,該微球劑可持續釋放姜黃素并延長其半衰期,提高了姜黃素的生物利用度,同時有效改善了姜黃素的水溶性和穩定性,為解決姜黃素應用過程中存在的問題提供了新思路。Ci等[70]采用乳化凝聚法 (emulsification-coacervation method) 制備了二氧化氯明膠微球劑,緩釋試驗結果證明,該微球劑可穩定地持續釋放低濃度的二氧化氯氣體。
3.1.2 體內示蹤 明膠微球劑被放射性元素或熒光物質標記后,可用于體內示蹤研究。以明膠為載體制備的微球劑用于體內示蹤具有以下特點:所制備的微球劑有彈性,粒徑小且含多微孔,可供示蹤劑附著的表面積大,即運載示蹤劑量多;明膠化學性質穩定,不會使吸附其中的示蹤劑失效或對示蹤能力產生影響[71]。楊云霞等[72]將用125I標記的硫酸鏈霉素明膠微球劑注入小鼠體內,通過示蹤法研究了肺內藥物滯留時間及體內分布變化。陳建明等[73]對99mTc標記的褪黑激素明膠微球劑通過γ射線閃爍顯像技術考察了其滯留時間,表明明膠作為示蹤載體具有良好的應用前景。
3.1.3 靶向作用 載藥明膠微球劑有如下幾個主要特點:對人體、生物體等特定部位具有靶向性,表現為藥物濃集于靶區;可進行特異性輸送,能以預期的速率釋放藥物,控制給藥速度;可減少藥物用量,降低藥物在其他部位的毒副作用及不良反應,達到高效低毒的治療效果[74];明膠作為骨架載體易于成型,能與醛類等物質發生交聯反應形成緩釋層且可被酶降解[75]。基于這些特點,明膠在靶向制劑中被廣泛應用。Li等[76]制備了氯膦酸鹽明膠納米微球劑,利用99mTc標記微球劑,通過閃爍顯像技術評估了微球劑靶向肝脾的能力,發現大鼠體內有70.6%的微球劑在肝脾積累,顯示出良好的靶向效果。
明膠作為靶向制劑應用極為廣泛,具有良好的靶向性和生物降解性,降解后可形成無毒產物排出體外。Qu等[12]制備了頭孢喹肟 (cefquinome,CEQ) 明膠微球劑,發現其在靶組織 (肺) 中可持續釋放36 h,體內研究確定肺部為靶組織及最大CEQ釋放區域,檢查結果表明,局部炎癥隨微球劑的生物降解而逐漸消失。Yuan等[13]采用明膠作為載體構建了負載替米考星 (tilmicosin,TMS) 的明膠微球劑,通過MCPKP軟件驗證了替米考星明膠微球的肺靶向作用。結果表明,替米考星被明膠微球劑負載后顯著增加了其在肺部的分布,減少了在腎、肝、肌肉,尤其是心臟中的分布,為改變替米考星的給藥途徑、拓寬其應用范圍、延長其使用壽命以及臨床新制劑的開發提供了科學依據。
3.2 明膠微球劑在農藥上的應用
載藥明膠微球劑在農藥領域屬于新型制劑,還處于探索開發階段,目前公開報道的有阿維菌素、呋蟲胺、毒死蜱、氯氰菊酯等明膠微球劑等。
3.2.1 阿維菌素明膠微球劑及阿維菌素明膠-聚乳酸微球劑 阿維菌素廣泛用于動物衛生和農業害蟲控制,但其在光照或在土壤微生物作用下會迅速降解,失去雙糖結構,導致其在田間應用2~3 d內即失去殺蟲活性[77-78]。若將阿維菌素制備成微球劑,不僅分解和流失等問題可以得到解決,還可使其釋放得到控制。唐輝等[79]采用乳化縮聚法構建了負載阿維菌素的明膠微球劑,粒徑在10~200 μm之間,載藥量達14.18% ± 0.55%,包埋率達71.35% ± 2.75%;其體外釋藥規律遵循Higuchi方程,消解半衰期是原藥的6.6倍,不僅提高了有效成分的穩定性,而且具有明顯的緩釋作用及良好的生物利用度。Cheng等[80]以明膠-聚乳酸為復合載體,采用復乳化-溶劑揮發法 (W1/O/W2)制備了包埋阿維菌素及碳酸銨的明膠-聚乳酸微球劑,通過葉片噴霧施藥發現,該復合微球劑對果蠅的平均致死數是防蟲誘捕器 (control traps) 的7~15倍,阿維菌素持續釋放時間約為15 d,不僅降低了控制果蠅的成本,還減少了殺蟲劑的使用頻率。
3.2.2 呋蟲胺明膠微球劑 呋蟲胺屬于第三代新煙堿類殺蟲劑。常規劑型有懸浮劑、可濕性粉劑等,其持效期短,農藥利用率低,而且隨著葉面噴霧的廣泛使用,這類劑型的呋蟲胺易于對授粉昆蟲 (蜜蜂) 產生毒害。近年來,研究者們致力于尋求新的替代劑型。陳福良等[3]利用噴霧干燥法構建了呋蟲胺明膠微球劑,具有較高的包埋率,在土壤及植物葉片中的消解速率緩慢,有更長的控釋持效期,且與白粉虱的發生階段相匹配。
3.2.3 毒死蜱明膠-海藻酸鈉微球劑 羅璋[56]以明膠-海藻酸鈉為載體,采用銳孔-凝固浴法制備了毒死蜱明膠-海藻酸鈉微球劑,并探討了微球劑基材的種類、交聯時間以及毒死蜱的含量對微球劑緩釋性能的影響。結果表明,毒死蜱經過復合載體負載后熱穩定性能明顯提高,分解溫度由180 ℃提高到210 ℃;該控釋體系能夠顯著降低有效成分的釋放速率,降低其累積釋放量,但載體的種類對微球有效成分的緩釋性能影響最大。
3.2.4 氯氰菊酯明膠-海藻酸鹽微球劑 氯氰菊酯(cypermethrin) 是一種應用廣泛的高效廣譜殺蟲劑。Roy等[81]以氯氰菊酯為模型農藥,以氯化鈣為交聯劑,以明膠-海藻酸鹽為載體,構建了氯氰菊酯明膠-海藻酸鹽微球劑。通過改變載體和交聯劑的用量,制備了一系列不同組分的載藥體系。結果表明,明膠、海藻酸鹽、氯化鈣及溫度等因素均具有溶脹響應行為。氯氰菊酯的負載量、明膠濃度及交聯劑用量會調控微球劑的釋放速率,14 d后微球劑的釋放量為75% (而直接施用氯氰菊酯6 d后的釋放量即為75%) ,釋放過程由明膠-海藻酸鹽的溶脹所控制,并遵循非Fick輸運機制。相比于直接使用氯氰菊酯 (粉劑) ,加工成微球劑可以使氯氰菊酯的釋放速率得到有效減緩,體現了緩控釋技術在農業領域的適用性,這為以生物聚合物為載體的緩釋農藥的研究提供了參考。
4 小結與展望
微球劑是一種具有緩釋功能的藥劑傳遞系統,對農藥的高效利用和發展綠色精準防控具有重要意義。明膠作為一種具有廣闊應用前景的載體,已發展成為緩控釋載體材料的研究熱點[82]。以明膠為載體制備的明膠微球劑具有以下幾方面優勢:1) 可以使有效成分持續釋放,延長持效期,同時減少環境污染,具有高效、安全的特點。 2) 在高效、綠色的農業防控中,基于不同防治對象及為害部位,可以選擇匹配的微球劑制備工藝,構建出不同的載藥體系,通過改善微球劑粒徑、載藥量、包埋率及在作物表面的附著沉積性等性能,控制其釋放行為,若匹配對應的施藥方式 (拌土、撒施、葉面噴霧等) ,在藥物的實際應用中更具針對性。例如明膠微球劑粒徑不同,施用方式也有所差異。若微球劑粒徑大,釋放速度慢,持效期長,可直接針對地下害蟲等封閉環境進行撒施或拌土;若微球劑粒徑小 (如納米級微球劑) ,與釋放介質的接觸面積更大,可提高微球劑在植株上的展布、附著和滲透能力,其釋放速度相對較快,持效期短。明膠微球劑也可經過二次加工成固體可分散劑型進行葉面噴霧,用于防治果樹上繁殖周期短、年發生多代及發生代數重疊的害蟲,如紅蜘蛛、木虱、蚜蟲等。3) 在病蟲害防控中,根據作物病蟲害發生規律,可利用載體性能調節微球劑中有效成分的釋放速率,使調控農藥的釋放曲線與有害生物防控劑量需求曲線相吻合。多數害蟲在適宜的溫度下會快速繁殖,尤其是在高溫高濕下易于爆發成災。明膠作為微球劑的載體具有一定的溫度響應性[83],在溫度較高時,明膠分子鏈易被破壞,會使有效成分加快釋放。此外,明膠是水溶性載體材料,且易受到濕度高低的影響,在高濕度情況下載體之間的聚合更易于破裂[84]。明膠微球劑的這些特性可有效提高藥物利用率,安全、高效、精準、經濟的控制病蟲害,這正是未來微球劑發展的重點。
盡管明膠微球劑在農藥緩控釋制劑方面具有明顯的優勢,但是目前也面臨諸多挑戰。在制劑工業化的制備和精準釋放方面仍有一些亟待解決的問題:1) 目前大多數明膠微球劑的制備過程比較復雜,產率較低,制備工藝大多仍局限于實驗室研究階段,在工業生產上適用性尚不高[20-21],應加強對最佳生產工藝的探索和新設備的開發,以加快其產業化生產進度[67]。2) 根據作物病蟲害發生與流行規律、危害特點及環境條件等綜合因素,利用農藥緩釋劑型加工手段調節載體性能及釋放方式等,建立具有靶向專一性的明膠微球劑載藥體系,使農藥達到在特定時間提供所需劑量的精準釋放,已成為一項具有挑戰性和創新性的任務[85-86]。3) 緩控釋制劑的設計一定要基于實際應用場景,明膠微球劑緩控設計很多仍停留在實驗室階段。與實驗室環境相比,農藥實際應用場景更為復雜[67],涉及不同作物特點、環境條件、微生物群落等多種影響因素,需選擇匹配的施藥方式。在實際的應用場景中根部施用 (撒施、拌土等) 應滿足更長的持效性,而針對葉面噴霧則需兼顧速效性和持效性[80],以達到精準控釋的目標。但對于明膠微球劑在植物表面的沉積、是否真正能夠提高對靶沉積效率及在植物中傳導行為等方面的研究較少[87],如何滿足實際葉面噴霧的需求是今后需要解決的問題,也是亟待研究的重要課題。
微球劑是緩釋藥物新劑型,應從簡單、定性的緩慢釋放,向未來精確、定量、高效的控釋方向發展,以期達到在特定時間提供所需劑量的精準釋放。緩釋載體逐漸向環保方向發展,目前對環境無毒、無污染、生物可降解的明膠作為微球劑載體已成為研究的熱點。因此,對現有制備技術和緩釋材料的進一步功能化集成,從而真正體現緩釋技術的優勢,明膠微球劑有望獲得廣闊的農業應用前景。

