AMPK信號通路在小鼠急性腎損傷發生中的作用
毛艷 盧麗 肖輝 劉瀟
急性腎損傷是一種常見的臨床危重病癥,多伴隨有腎纖維化[1]。當腎損傷發生后,氧供應突然減少,葡萄糖酵解代謝途徑供能不能滿足機體需要,加上代謝底物的減少進一步加重能量短缺,導致細胞水腫、細胞內鈣超載,從而引發一系列細胞損傷[2,3]。阿德福韋酯可導致腎損傷,機制與其在腎小管蓄積濃度過高有關,可用來構建小鼠急性腎損傷模型[4,5]。磷酸腺苷激活蛋白酶(adenosine phosphate activating protease,AMPK)被稱為能量代謝的“感受器”,是一種在細胞內調節能量代謝的重要蛋白激酶[6,7]。AMPK可通過直接磷酸化細胞內的一系列酶,或通過協同激活因子、磷酸化轉錄因子和協同抑制因子對代謝進行轉錄調控[8,9]。AMPK也可參與骨骼肌、肝臟、胰腺、下丘腦、脂肪等器官和組織的基因合成與蛋白代謝,從而保證機體的生理平衡[10,11]。本文通過建立阿德福韋酯小鼠急性腎損傷模型,探討AMPK信號通路在小鼠急性腎損傷發生中的作用。現總結報道如下。
資料與方法
1 研究材料 SPF級BALB/c雄性小鼠(48只)購自本地區實驗動物中心,許可證SCXK(2018-0007)。室內溫度20℃~28℃,濕度40%~60%,每籠6只,飼養環境通風良好,光線充足,自由攝食攝水。實驗前令動物在飼養環境中適應7天。阿德福韋酯片購自河北醫科大學制藥廠(國藥準字H20100172,批號20194422)。GAPDH內參抗體與AMPK、Keap-1多克隆抗體購自Sigma公司。
2 實驗方法與步驟
2.1 小鼠分組與處理:將所有小鼠隨機分為兩組,對照組與實驗組各24只。對照組:用等滲鹽水進行灌胃處理。實驗組:采用阿德福韋酯40 mg/kg灌胃處理,1次/周,持續2次。
2.2 檢測指標:在處理后2周、4周、6周各處死8只小鼠。①將血液標本加入離心管,靜置30 min,2 500 r/min離心15 min,取上層血清,采用全自動生化分析儀測定尿素氮(BUN)與肌酐(SCr)水平。②同時取小鼠的腎臟組織,–70℃冰箱保存,其中部分組織研磨成勻漿后,提取蛋白,根據BCA蛋白定量試劑盒說明書進行蛋白定量,再將制備好的蛋白樣品進行SDS-PAGE電泳,采用Western blotting檢測腎組織中AMPK、Keap-1的表達,以GAPDH作為內參。③另外取部分腎臟組織用4%多聚甲醛固定,然后依次進行脫水、透明、浸蠟、包埋等操作,經蘇木精-伊紅染色后,在光鏡下觀察腎組織的病理學變化,腎臟的病理損害評分標準[12]:1分,腎間質炎性細胞浸潤;1分,腎間質充血;1分,細胞核固縮;1分,腎小管腔內有脫落、壞死的細胞;1分,上皮細胞顆粒變性;1分,腎小管顯著擴張、細胞扁平;0分,正常腎小管。分數越高,腎臟病理損害越嚴重。
3 統計學處理 選擇SPSS 22.00統計學軟件與Prime Graphpad軟件對計量數據進行統計學分析,計量數據以均數±標準差表示,對比方法為獨立樣本t檢驗,檢驗水準為a=0.05。P<0.05表示差異有統計學意義。
結果
1 腎功能對比 實驗組處理后2周、4周、6周的血清BUN與SCr水平都顯著高于對照組(P<0.05)。見表1。
表1 兩組處理后不同時間點的腎功能對比()
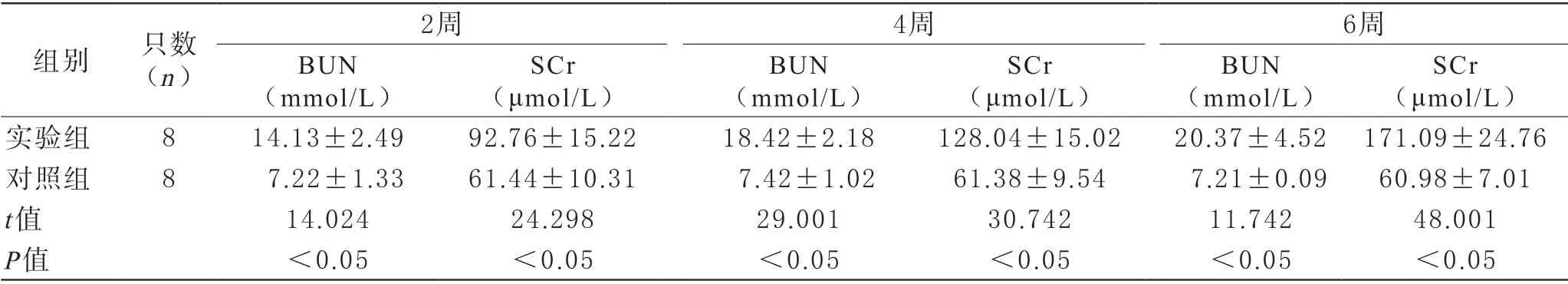
表1 兩組處理后不同時間點的腎功能對比()
2 腎臟組織病理學評分對比 實驗組處理后2周、4周、6周的腎臟組織病理學評分都顯著高于對照組(P<0.05)。見表2與圖1。
表2 兩組處理后不同時間點的腎臟組織病理學評分對比(分,)

表2 兩組處理后不同時間點的腎臟組織病理學評分對比(分,)
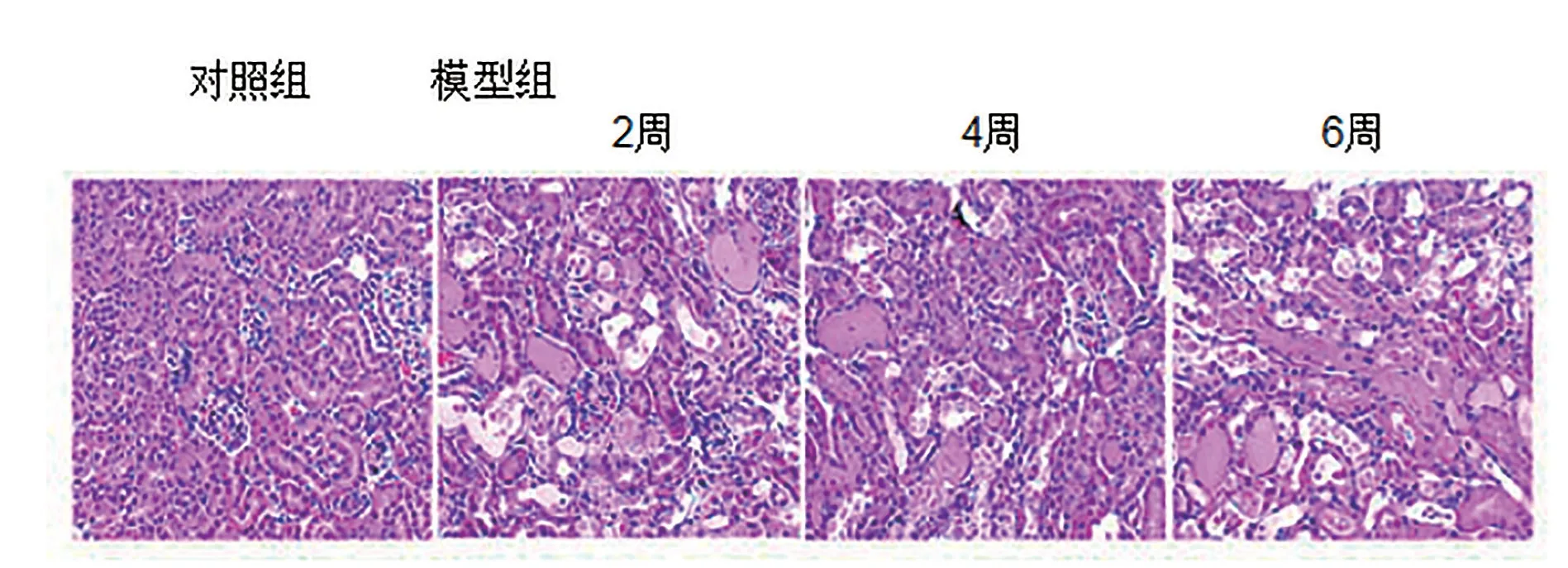
圖1 兩組腎臟組織病理特征(HE染色,×400,對照組:正常狀態;2周:腎間質充血;4周:細胞核固縮;6周:腎小管腔內有細胞脫落)
3 AMPK與Keap-1表達水平對比 實驗組處理后2周、4周、6周的腎臟組織AMPK與Keap-1蛋白相對表達水平都顯著高于對照組(P<0.05)。見表3與圖2。
表3 兩組處理后不同時間點的腎臟組織AMPK與Keap-1表達水平對比(%,)
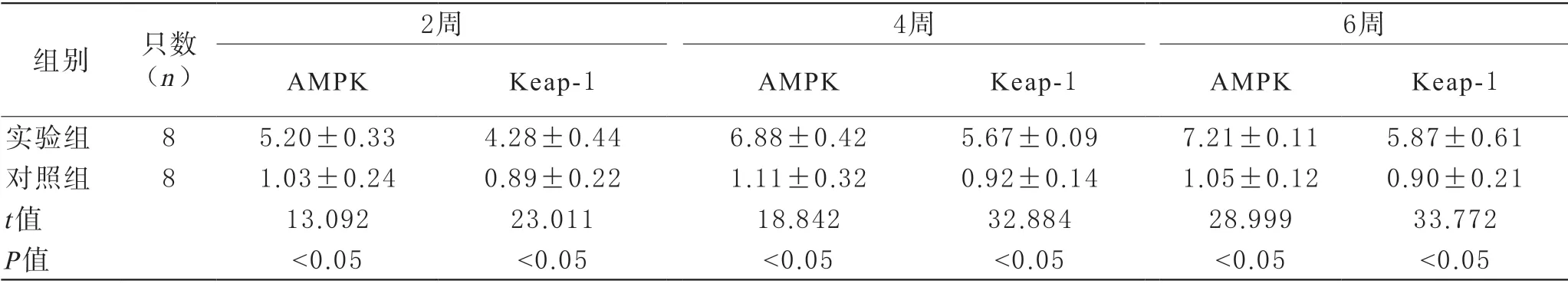
表3 兩組處理后不同時間點的腎臟組織AMPK與Keap-1表達水平對比(%,)
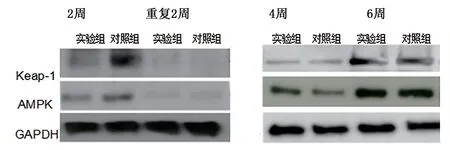
圖2 AMPK與Keap-1表達水平
討 論
急性腎損傷在臨床上比較常見,也是臨床危重患者最主要的死亡原因之一[13]。腎臟是除了肝臟以外多種藥物代謝的重要場所,當藥物經血液進入腎臟時,往往因濾過而被濃縮,容易導致腎小管受損[14,15]。其中阿德福韋酯對腎臟的損傷表現為腎小管的結構和功能改變,是構建急性腎損傷小鼠模型的常見方法[16]。本研究顯示實驗組處理后2周、4周、6周的血清BUN與SCr水平都顯著高于對照組(P<0.05)。臨床研究也顯示在使用阿德福韋酯的過程中,表現為腎小球濾過率下降或SCr上升,提示患者存在腎功能損傷[17]。但是當前影響血清BUN與SCr的因素非常多,特別是嚴重急性腎損傷患者往往存在程度不等的營養不良,使得肝臟將肌酸轉化為肌酐的能力減弱,導致血清BUN與SCr很難真實反映腎功能的狀態[18,19]。
本研究顯示實驗組處理后2周、4周、6周的腎臟組織病理學評分都顯著高于對照組(P<0.05)。腎組織病理形態學評分提示急性腎損傷的程度,其主要表現為腎臟形態結構顯著改變,可見腎小管擴張,腎小管上皮細胞腫脹和空泡變性,管腔內有管型和壞死脫落細胞,部分腎小管結構損傷,少量管腔內有蛋白性液體積聚等。
AMPK內含一個催化性α亞單位和調節性β、γ亞單位,AMP結合到γ亞單位后,使蘇氨酸172位點更易被磷酸化,變構激活復合體,造成胞內鈣離子水平變化[20,21]。AMPK可對低水平ATP做出反應,對補充細胞 ATP供應的信號轉導通路進行正向調控[22]。AMPK-Keap-1信號途徑在維持機體細胞內正常的氧化還原平衡方面發揮重要作用,且該信號通路廣泛存在于多細胞生物體內,在進化上保持高度保守[23]。腎損傷可激活AMPK,通過減少能量產生保護腎功能,進而削弱細胞線粒體功能,形成惡性循環。當腎損傷減輕后,Keap-1因子會進入細胞核重新與AMPK結合,并轉位到細胞質,使AMPK的表達處于低水平[24,25]。本研究顯示實驗組處理后2周、4周、6周的腎臟AMPK與Keap-1蛋白相對表達水平都顯著高于對照組(P<0.05),表明小鼠急性腎損傷可伴隨有AMPK信號通路的激活。本研究也有一定的不足之處,對AMPK信號通路的機制闡述不夠深入,且樣本數量較少,將在后續研究中進一步分析。
綜上,小鼠急性腎損傷可激活AMPK信號通路,誘導AMPK與Keap-1表達量上升,導致腎臟組織損傷與腎功能下降。
利益沖突所有作者均聲明不存在利益沖突

