去白懸浮紅細胞4℃儲存不同時間的質量評價
田雅嫻 詹林盛 王小慧 田兆菊
紅細胞是目前最常用的成分血,其輸注的適應癥包括癥狀性貧血、急性鐮狀細胞危象和超過30%血量的急性失血等,主要目的是恢復組織供氧[1]。美國FDA規定使用添加劑(AS-1,AS-3,AS-5等)紅細胞在體外保存可長達42天,但多項研究顯示,儲存紅細胞輸注會引發細菌感染[2]、血管外溶血[3]、炎癥[4,5]、膿毒癥[6]和血栓形成[2,7],且與特殊類型患者的不良預后具有顯著相關性[5,8]。紅細胞在儲存過程中會發生一系列生物化學和生物力學改變,稱之為“儲存損傷”,包括腺嘌呤核苷三磷酸(ATP)、2,3-二磷酸甘油酸(2,3-diphosphoglycerate,2,3-DPG)耗竭,pH值降低,鈉鉀離子濃度等生化指標改變,膜蛋白脂質過氧化,糖酵解速率降低,囊泡形成以及紅細胞形態改變等[1,9–12]。除儲存損傷外,獻血者的紅細胞并不是一個質量相等的成分血,存在供者與供者之間的變異,因此這是輸血實踐中一個值得關注的問題。儲存損傷誘發輸血安全的機制目前尚不明確,可能與紅細胞儲存損傷相關分子模式(DAMPs)潛在啟動受體的免疫系統、細胞因子的累積、循環非轉鐵蛋白結合鐵(NTBI)增加以及補體系統的激活等有關[1,9,13]。對于特殊的血液病患者如鐮狀細胞貧血[14]、β-地中海貧血[15]等,其疾病的特征是紅細胞的病理變化的結果,包括紅細胞組成成分的改變、膜受體和細胞骨架破壞,紅細胞的形狀、變形性和流變學特性的變化等。這些與疾病相關的紅細胞變化似乎與輸血前冷藏時紅細胞的變化有一些相似之處,具有潛在的臨床輸血危害[16]。儲存紅細胞的實際年齡因供體特征、儲存條件和儲存期間的生物學變化而變化,因此闡明貯存過程中紅細胞的質量及成分變化可能比存儲日期更能真實反應紅細胞的年齡,對于改善血液質量引發的臨床輸血后果應具有潛在價值[17]。根據國家標準“全血及成分血質量要求”(GB18469-2012),通過檢測溶血率、血紅蛋白含量、血細胞比容、無細菌生長等作為指標反映儲存紅細胞的質量。筆者認為,這些指標較為常規、單一,不足以反映紅細胞在儲存過程中的諸多質量參數的變化,需要更加全面、完善的質量評價技術對其進行綜合評價。我們選擇儲存的去白懸浮紅細胞進行質量研究,旨在探討不同儲存期限的紅細胞的質量變化,并據此綜合判斷一定儲存期限的紅細胞是否會造成輸注無效等不良后果。基于此,我們對4℃下不同儲存時間紅細胞的溶血率、細菌生長、生化指標、能量代謝、膜損傷及氧化應激等指標進行監測,以評價儲存去白懸浮紅細胞質量,以期提升其輸注安全性,為臨床紅細胞輸注前的血液質量提供參考數據。
材料與方法
1 材料與儀器 10份50 mL志愿者全血及一次性使用塑料血袋(內含紅細胞保存液(MAP保存液),四川南格爾生物科技有限公司)由解放軍總醫院第七醫學中心輸血科提供,血液樣本來源為18~25歲健康男性志愿者。微量游離血紅蛋白(FHb)測定試劑盒(南京建成,批號:20200901),增強型ATP檢測試劑盒(碧云天,批號:080219191112),Human 2,3-DPG ELISA KIT(成志科為,批號:Oct 2020),FITC偶聯Annexin-V凋亡檢測試劑盒(BD,批號:9312842),FITC anti-human CD47(BioLegend,批號:B286157),人丙二醛(MDA)ELISA試劑盒(上海江萊生物技術有限公司,批號:JL202105009),SOD(超氧化物歧化酶)試劑盒(南京建成,批號:20201007),全自動血細胞分析儀(BC-5130 深圳邁瑞公司),全自動生化儀AU5800(美國貝克曼診斷有限公司),多功能酶標儀(SpectraMax M5美國Molecular Devices公司),白細胞過濾器(美國Pall公司),細胞計數儀(上海睿鈺生物科技公司),pH計(S210-8 梅特勒-托利多儀器(上海)有限公司)
2 去白懸浮紅細胞制備及檢測 10份50 mL全血于采集當天經白細胞過濾器濾除白細胞后,3 000 r/min離心10 min去除大部分血漿層,臨床上200 mL全血對應紅細胞保存液約為50 mL,因此我們按全血保存液體積比為4∶1的比例加入紅細胞保存液,顛倒混勻制備去白懸浮紅細胞懸液,裝入轉移袋內密封后置于4℃保存,于第0、7、14、21、28、35和42天檢測溶血率、生化指標、能量代謝指標、氧化損傷指標、膜損傷指標及紅細胞膜表面分子,第0、14、28和42天檢測細菌生長情況。
3.1 溶血率:于檢測當天從血袋中取出1 mL血樣,取樣前充分混勻血液。全自動血細胞分析儀檢測血常規各項指標,然后離心取上清,按照游離血紅蛋白檢測試劑盒說明書測定去白懸浮紅細胞中FHb含量。根據公式:紅細胞溶血率(%)=(1–紅細胞比容)×懸浮液游離血紅蛋白濃度/總血紅蛋白濃度×100% 計算不同儲存時間的紅細胞溶血率。
3.2 細菌生長:按表1中成分用去離子水定容至l L配制培養基,高壓蒸汽滅菌待溫度降至50℃時取出,傾注約8 mL培養基至60 mm×15 mm的細胞培養板,冷卻后凝固待用。采用四區劃線法取血接種,嚴格無菌操作,同時設定陽性對照和陰性對照,37℃培養5天觀察結果。
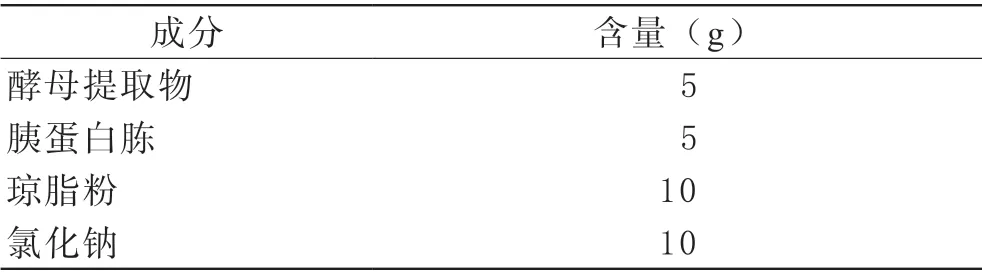
表1 培養基配制
3.3 生化指標:生化指標Na+(鈉離子)/K+(鉀離子)/GLU(葡萄糖)/LDH(乳酸脫氫酶)由全自動生化分析儀檢測,pH值采用pH計測定。
3.4 能量代謝指標:采用熒光素酶催化熒光素產生熒光時需要ATP提供能量和人2,3-二磷酸甘油酸(2,3-DPG)ELISA法分別測定紅細胞裂解液中ATP和2,3-DPG含量(按照試劑盒說明書進行)。
3.5 膜損傷指標:采用FITC偶聯Annexin-V凋亡檢測試劑盒檢測紅細胞儲存過程中表面磷脂酰絲氨酸(PS)外翻情況。取儲存去白懸浮紅細胞,3 000 r/min離心5 min,從下層吸取1 μL純紅細胞,用PBS重懸稀釋計數2×106個/mL。分別將FITC Annexin V和FITC anti-human CD47各5 μL加入100 μL 1×Bind buffer和100 μL PBS中,重懸細胞,室溫避光孵育20 min。PS測定管加400 μL 1× Bind buffer直接上機檢測,CD47測定管加1 mL PBS重懸洗一遍去除多余抗體,再用500 μL PBS重懸,上機檢測。采用FlowJo V10軟件分析結果,PS測定結果以標記率(Annexin V-FITC Labeled Rate/%)表示,CD47測定結果以平均熒光強度(mean fluorescence intensity,MFI)表示。
3.6 氧化應激指標:紅細胞內SOD活力測定采用WST-1法,MDA含量采用ELISA法,操作按照試劑盒說明書進行。
4 統計學處理 采用GraphPad Prism 7軟件進行數據做圖及處理。統計學分析采用單因素方差分析和Tukey多重比較,對各指標不同儲存天數的均數進行兩兩比較,根據P值判斷兩個均數之間是否具有統計學差異,溶血率及各生化指標以平均值±標準差()表示,其余指標不同儲存天數間的統計學差異以*表示,P<0.05視為差異有統計學意義。
結 果
1 溶血率及血常規檢測結果 隨儲存時間的延長游離血紅蛋白含量增加,與0天相比,儲存第7天開始有統計學差異(P<0.05),并隨儲存時間延長差異更加顯著。儲存終末期,即42天,溶血率升高至0.4%左右(P<0.001)。血常規顯示隨儲存時間延長RBC計數、HGB含量及HCT升高,HGB在42天出現統計學差異(P<0.001)。MCV、MCH、MCHC無明顯改變,RDW-CV和RDW-SD均升高,35和42天時RDWSD差異出現統計學意義(P<0.001),表明隨儲存時間的延長紅細胞大小的變異程度出現改變。
從理論上講,預防腐敗必須形成兩個方面的約束體系:一是制度約束,從制度上規范和監督權力的運行,形成“不能腐”的體制機制;二是“道德心理約束”,從孝廉文化建設方面使官員形成“不想腐”的孝廉心理,能夠自覺履行廉潔從政的政治道德要求。可以結合當地長期以來形成的孝廉文化傳統,對干部群眾進行“入情入理入腦入心”的宣傳、感化、熏陶、教育,在全社會形成“腐敗可恥”“一人腐敗、全家倒霉”的孝廉文化氛圍。
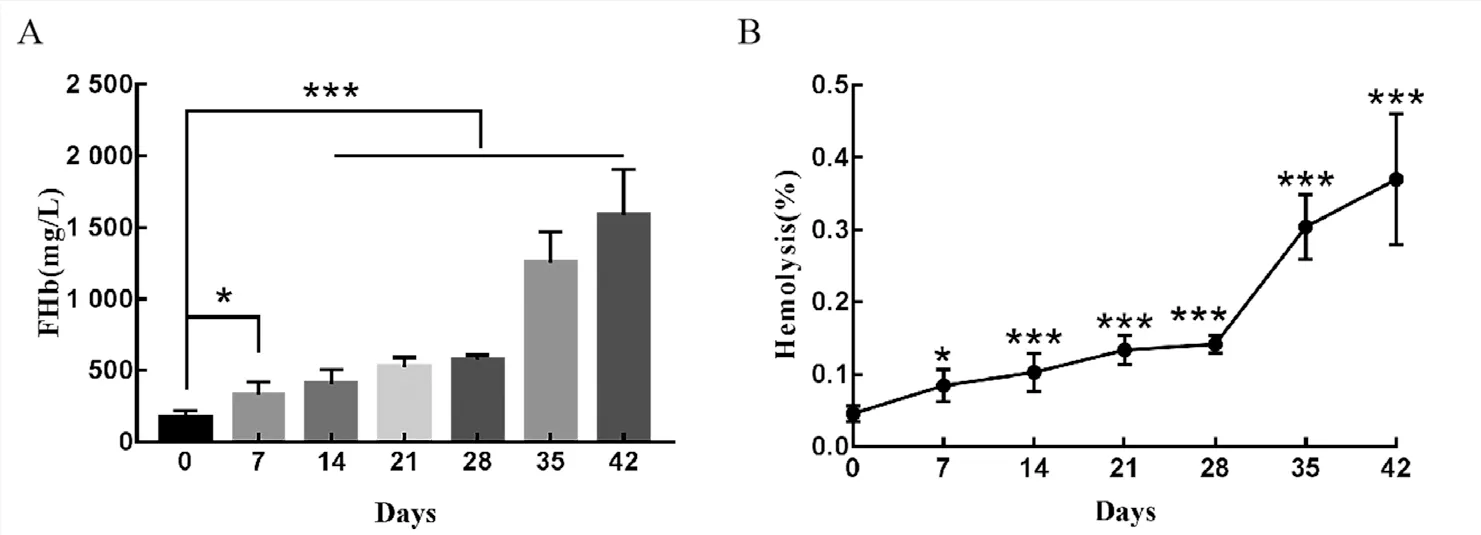
圖1 去白懸浮紅細胞儲存過程中FHb及溶血率變化
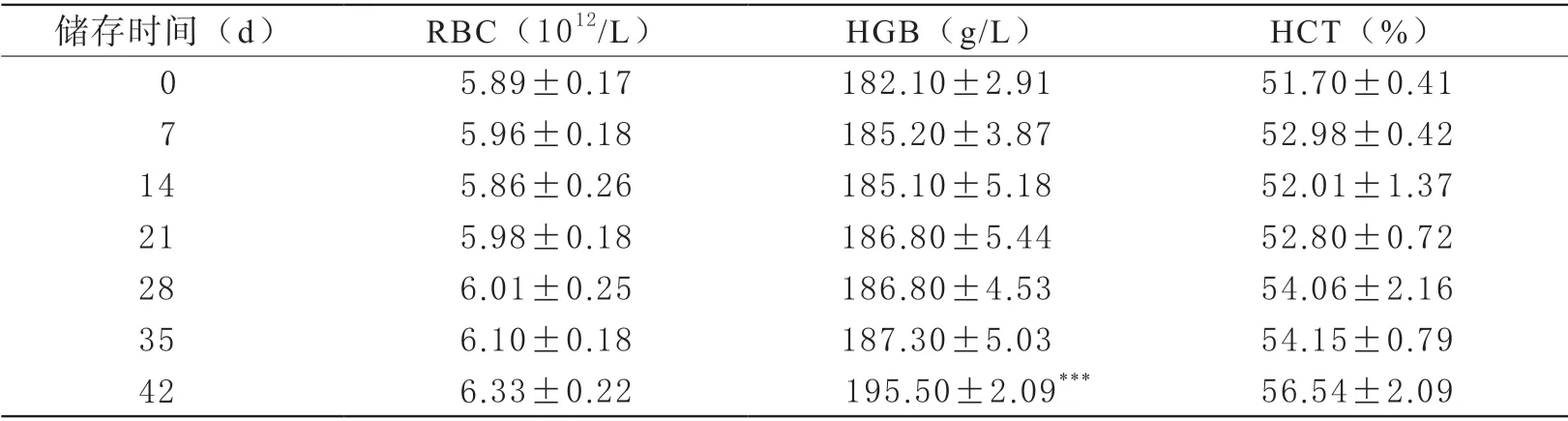
表2-1 去白懸浮紅細胞儲存過程中血常規檢測結果

表2-2 去白懸浮紅細胞儲存過程中血常規檢測結果
2 細菌生長 4℃下冷藏儲存條件下,各儲存時間組去白懸浮紅細胞均無細菌生長,符合《全血及成分血質量要求》。
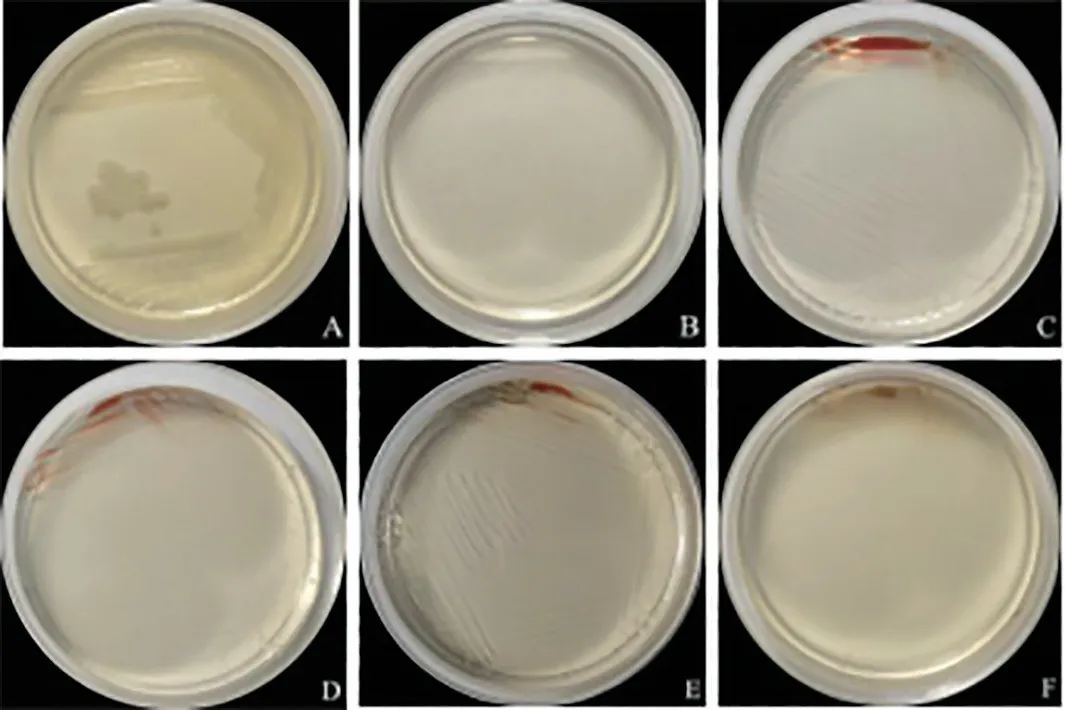
圖2 去白懸浮紅細胞儲存過程中細菌生長情況
3 生化指標檢測結果 觀察4℃下不同儲存時間血液樣本中的生化指標發現,Na+、GLU、pH隨儲存時間延長而下降,K+、LDH含量升高。其中,Na+、GLU變化無統計學差異,儲存第42天時K+含量增加了近12倍,且差異有統計學意義(P<0.001)。LDH含量增高,第21天時上升至新鮮時的1.5倍(P<0.001),21、28、35和42天與0天相比,均具統計學差異(P<0.001)。pH值隨儲存時間的延長而降低,且從第7天開始差異具有統計學意義(P<0.001)。
4 能量代謝指標檢測結果 與新鮮去白懸浮紅細胞相比,ATP在儲存第14天開始下降顯著,至第21天降至初始值的36.4%,儲存終末期降至初始值的13.2%,差異有統計學意義(P<0.001)。2,3-DPG在儲存第七天稍增高,而后開始下降,至第28天降至初始值的57.5%,差異具有統計學意義(P<0.001),隨儲存時間的延長繼續降低,到儲存終末期降至初始值的44.0%,差異具有統計學意義(P<0.001)。
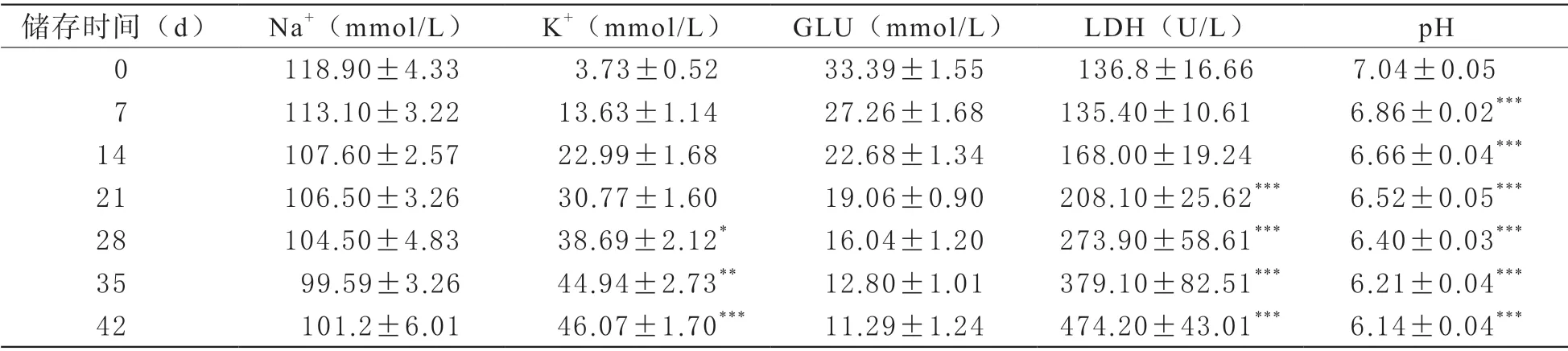
表3 去白懸浮紅細胞儲存過程中生化指標檢測結果
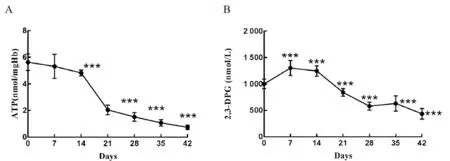
圖3 去白懸浮紅細胞儲存過程中ATP、2,3-DPG含量變化
5 膜損傷指標檢測結果 如圖4所示,紅細胞在儲存過程中PS外翻率緩慢升高,與0天相比,儲存21天時外翻率增加了12.7倍(0.03% vs.0.38%),儲存終末期時升高了27.7倍(0.03% vs.0.83%),與0天相比有統計學差異(P<0.001)。雖在儲存過程中PS外翻率升高,但數值均在1.5%以下。另外,第7天開始紅細胞膜表面的CD47分子平均熒光強度顯著下降,下降至約為新鮮紅細胞的59.1%(P<0.001),14、21、28、35及42天相比較7天變化不顯著。
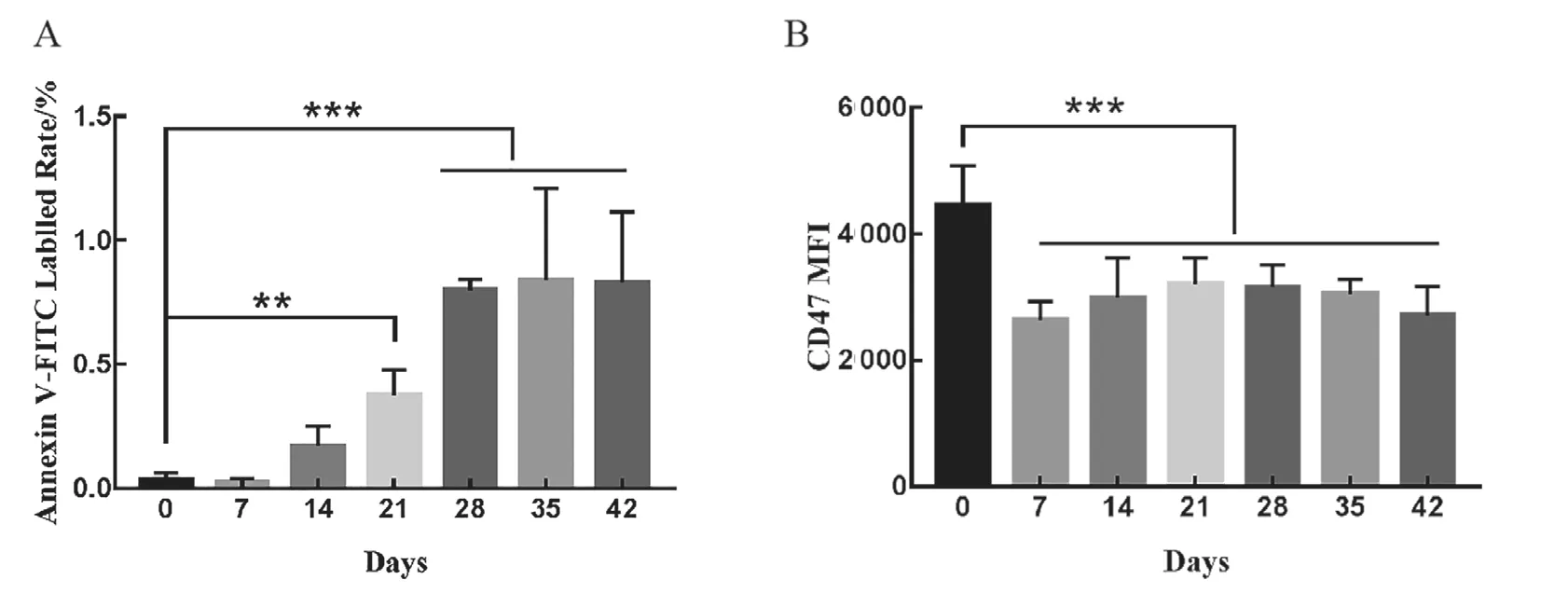
圖4 去白懸浮紅細胞儲存過程中PS外翻、CD47分子變化情況
6 氧化應激指標檢測結果 紅細胞內MDA含量無明顯變化,第28天開始SOD活力顯著下降,與新鮮紅細胞相比差異具有統計學意義(P<0.001),35天、42天與第28天相比無統計學差異。
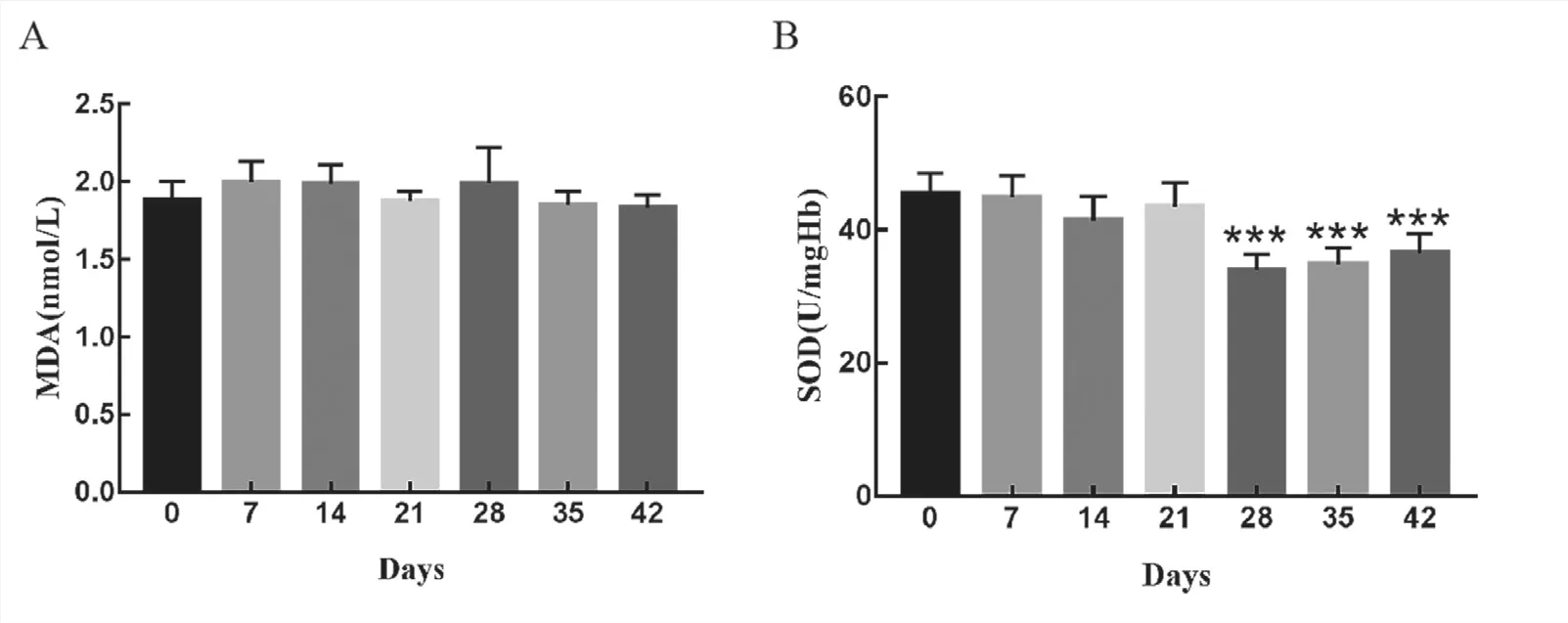
圖5 去白懸浮紅細胞儲存過程中MDA、SOD含量變化
討 論
輸血是臨床上搶救患者的重要手段,去白懸浮紅細胞輸注降低了輸血過程中白細胞和血小板引起的炎癥反應,針對需長期進行輸血的疾病如再生障礙性貧血、地中海貧血等以及因反復輸血而引發非溶血性的發熱反應的患者來說是十分理想的紅細胞成分血。研究表明,紅細胞的儲存損傷是導致其輸注風險的主要原因,儲存的衰老紅細胞會被單核/巨噬細胞系統清除。單核吞噬細胞系統對儲存損傷的紅細胞的急性大量清除會使得紅細胞釋放大量的Fe2+,超過轉鐵蛋白的承受能力,導致循環中出現非轉鐵蛋白結合鐵,游離鐵存在于血漿中是具有高度活性的,可以參與多種氧化還原反應,產生多種活性氧(ROS)和脂類過氧化產物誘導氧化應激,循環中增加的鐵還會提高某些病原體的增殖能力誘導炎癥反應[18]。同時,細胞內大量的鐵會引起一些副反應:巨噬細胞內的鐵含量與受到各種炎性刺激時分泌的細胞因子水平密切相關。以上提示儲存紅細胞通過表面抗原發生改變,釋放促氧化劑及炎癥性分子。到目前為止,雖然儲存損傷對紅細胞臨床輸注的安全性和有效性的影響并無定論,但大量證據表明,儲存紅細胞輸注能誘導創傷后炎癥及感染的增強,提升機體發生膿毒血癥及導致感染性并發癥的風險。儲存后紅細胞變形能力的損害可能導致輸血后受者體內微循環的損害。紅細胞的儲存的時間應該加以考慮,以防止微循環損傷和組織輸送氧氣不足等問題的發生[19]。因此,開展儲存紅細胞質量檢定及功能評價對輸血的有效性和療效具有重要意義。
本研究檢測了儲存過程中去白懸浮紅細胞的溶血率、細菌生長、生化、能量代謝、膜損傷以及氧化損傷等指標評價紅細胞質量。研究發現,隨儲存時間的延長溶血率增高,前28天升高緩慢,35天和42天變化顯著。根據血常規參數,紅細胞在儲存過程中RDW-SD升高,表明紅細胞大小出現變化,這可能與儲存過程中膜通透性改變引起的細胞內外滲透壓變化有關。生化指標Na+、GLU和pH值會隨儲存時間延長檢測值下降,而K+、LDH含量升高。高濃度K+輸入人體內可能引發高鉀血癥,這是一種急危重癥嚴重者危害患者生命。因此儲存時間久的去白懸浮紅細胞中K+過高不宜輸注。Flatt等報道,儲存過程中的陽離子滲漏與紅細胞MCV、RDW、PS外翻、膜囊泡形成以及紅細胞膜的氧化損傷顯著相關[20]。另一方面,紅細胞膜表面有Na+-K+-ATP酶(鈉鉀泵),可分解ATP獲得能量。正常生理功能條件下,鈉鉀泵會將3個Na+泵出胞外,同時泵入2個K+,從而維持細胞內外滲透壓和正常的膜電位。但隨紅細胞儲存時間延長,ATP消失殆盡,鈉鉀泵無法繼續工作,導致胞內低鈉高鉀和胞外高鈉低鉀的情況改變,因此實驗結果中胞外血清鈉離子濃度降低,鉀離子濃度上升的現象可能也會由此引發。較Na+而言K+變化顯著,可能是由于在儲存過程中膜上的離子通道被破壞,導致胞內高濃度的K+流入上清中,而Na+離子主要在細胞外,所以引起K+的顯著變化。
細胞糖酵解的速率和溫度、2,3-DPG含量和pH值有關,其中最重要的是pH值。細胞糖酵解生成ATP的同時也會產生乳酸和H+,從而隨儲存時間延長出現pH下降的改變,我們的實驗結果也驗證了這一結論。ATP是紅細胞儲存損傷的重要變化之一,紅細胞ATP的含量與輸血后恢復有顯著的相關性。ATP含量降低會增強紅細胞磷酸戊糖旁路代謝途徑,產生大量的NADPH,抑制谷胱甘肽從而抑制紅細胞的抗氧化能力。2,3-DPG除是紅細胞糖酵解中間產物反映糖酵解速率外,還是評價紅細胞攜氧功能的有效指標之一,2,3-DPG的水平變化影響血紅蛋白與氧的親和力。同時2,3-DPG 還會降低細胞膜變形能力,影響紅細胞膜的穩定性。本研究發現ATP儲存第二周開始下降顯著,第21天降至初始值的36.4%,儲存終末期降至初始值的13.2%。儲存第一周,紅細胞內2,3-DPG含量稍升高,隨后降低。2,3-DPG也是在第14天之后就出現明顯降低,第28天降至初始值的57.5%。Bennett-Guerrero E等[21]報道紅細胞內2,3-DPG在儲存1周時基本完全消失,顧光煜等[22]用比色法研究發現,不同的保存液紅細胞內2,3-DPG含量差異顯著,ACD保養液儲存第14天時2,3-DPG便已檢測不出,而CPD-AI-DHA-Vit.C保養液保存至42天時,紅細胞內2,3-DPG仍然保持在初始水平。張瑞君等[23]用酶標儀測定時發現,從第14以后2,3-DPG出現明顯的下降趨勢,與我們的實驗結果一致。因此我們推測實驗結果的差異可能是實驗方法或保存液使用不一致引起。據報道,ATP與2,3-DPG含量變化與細胞內氧化應激具有顯著相關性,兩者含量下降會誘導胞漿內抗氧化物質的形成,最終結果是保護膜脂質及蛋白質的氧化損傷[24]。
MDA是評價紅細胞氧化損傷、反應紅細胞膜脂質過氧化的主要標志。SOD是紅細胞抗氧化防御系統主要的標志性抗氧化酶,反映紅細胞清除氧自由基的能力。MDA和SOD聯合使用可反映紅細胞的氧化損傷程度。本研究結果顯示,紅細胞在儲存過程中MDA含量無明顯改變,與文愛清等人[25]報道的隨著儲存時間的延長,MDA含量顯著增加結果不一致。MENG等人[26]發現隨儲存時間延長,MDA含量并未升高,與0天相比,各儲存階段差異無統計學意義,與本研究結果一致。SOD在儲存第28天時顯著下降,說明紅細胞在儲存過程中出現氧化損傷,但結合MDA檢測結果,后續需要增加紅細胞內活性氧、谷胱甘肽、谷胱甘肽過氧化物酶以及過氧化氫酶等指標及增加樣本量進行驗證。美國FDA規定,儲存紅細胞在輸注24小時后在受者循環系統中的回收率(即post transfusion recovery,PTR)應≥75%。儲存的衰老或損傷的紅細胞進入機體后主要被巨噬細胞清除,機制主要有以下幾種:band 3蛋白介導的紅細胞清除;磷脂酰絲氨酸(PS)介導的紅細胞清除;CD47介導的紅細胞清除等[27,28]。PS和CD47是反應紅細胞清除的主要指標,CD47分子是一種免疫球蛋白超家族蛋白,是信號調節蛋白α(SIRPα)的配體,這兩種蛋白共同構成了CD47-SIRPα信號系統。紅細胞上的CD47分子與巨噬細胞上SIRPα受體的相互作用可以阻止巨噬細胞的吞噬作用,因此CD47減少或缺陷都會提高紅細胞的清除率,決定紅細胞的壽命[29–31]。因此我們檢測了儲存紅細胞表面的PS外翻率和CD47分子平均熒光強度,與體內輸注后紅細胞的清除相對應。本研究顯示,隨儲存時間的延長,PS外翻率升高差異有統計學意義,但外翻率均在1.5%以下,對其介導的體內吞噬性細胞對其清除的增加可能并不明顯。CD47分子在儲存7天時平均熒光強度顯著下調,與J.Kamhieh-Milz等[32]的研究結果基本一致,他們也發現隨儲存時間的延長,CD47分子的表達水平降低,第7天時變化最為顯著,與新鮮紅細胞相比具有統計學差異。據此推測儲存終末期去白懸浮紅進入機體內后,可能因CD47分子下調表達而誘導更多的單核/巨噬細胞系統對其的體內清除,造成PTR下降從而影響輸血治療的有效性。值得注意的是,本研究中因條件所限,樣本量較少,擴充樣本量后的實驗結果應更為精準可靠。
總的來說,儲存去白紅細胞質量隨儲存時間的延長而發生變化,表現為溶血率增加,ATP、2,3-DPG含量降低,PS外翻率增加,細胞膜表面CD47分子表達下調,無明顯氧化損傷。我們對檢測溶血率、細菌生長、生化、能量代謝、清除以及氧化應激指標等的變化結果進行綜合分析,推薦去白懸浮紅的最佳儲存期限為14天。
利益沖突所有作者均聲明不存在利益沖突

