儲存紅細胞中circRNA變化對泛素介導蛋白水解通路調控的預測分析*
張怡宇 黃國清 張勇剛 苑召虎 王強 陳小潔 黃建云 李楠 魏亞明
國內紅細胞一般在血庫條件下可保存35天,在這個過程中,會發生儲存損傷,繼而儲存損傷會影響紅細胞的壽命及輸注質量。紅細胞內蛋白質發生降解也是儲存損傷中的重要現象之一。泛素介導的蛋白水解通路是細胞質依賴于ATP的非溶酶體途徑的蛋白質降解通路[1]。泛素是一種熱穩定蛋白質,通過與蛋白質的共價酰胺鍵結合將其降解[2]。在網織紅成熟過程中,細胞膜的蛋白組成發生變化,其中微管蛋白和肌動蛋白發生降解,而這種降解部分由泛素-介導的蛋白水解途徑實現。不僅如此,它還能降解紅細胞中的游離α-珠蛋白、變性異常的蛋白質,而且能降解細胞轉錄因子、細胞內膜蛋白和細胞周期蛋白等天然蛋白質[2-4]。泛素相關的酶主要包括:泛素激活酶E1,泛素載體蛋白E2和泛素蛋白連接酶E3,不同E3酶的底物特異性決定了哪些蛋白質能發生降解[5]。
環狀RNA(circRNA,circular RNA)是一種比線性RNA更穩定的環形分子,是紅細胞中轉錄組的天然組成部分[6]。有很多研究發現circRNA是miRNA海綿,通過多個結合位點吸附大量miRNA,從而解除miRNA對mRNA的抑制作用,促進mRNA表達[7,8]。circRNA在形成環化同時會影響其母基因生成線性RNA的豐度,從而達到調節母基因蛋白質翻譯的目的。circRNA能與RBP(RNA binding proteins,RNA結合蛋白)特異性結合,發揮生物學功能。若circRNA發生聚集,由于其環形分子可產生三級結構,對與之結合的大量RBP不僅起到了分類隔區的支架作用,與mRNA比,也產生了其特有的與多組蛋白質結合的能力,能增加circRNA轉錄本的穩定性[9,10]。
本研究發現有近200個circRNA都與泛素降解的蛋白水解通路相關,相比其它代謝通路,這個數量非常巨大。基于此,本研究對母基因富集在泛素降解的蛋白水解通路的全部circRNA做了統計分析,挑選了組間相比具有統計學意義的部分circRNA進行PCR驗證,并預測其作為miRNA的海綿功能和RBP結合的能力。
材料和方法
1 一般資料與實驗分組 血液標本為5名25~30歲O型健康合格獻血者的標本各200 mL,與CPDA-1保存液混合,過濾去除白細胞后制成懸浮紅細胞,分別收集新鮮組0 d、20 d、40 d收集標本進行試驗。收集方法如下:以(1 000×g,20 min,4℃)為條件進行慢速離心,在生物安全柜內將血漿層吸走,留取紅細胞層,用PBS洗滌三次,盡可能去除血小板與血漿。其中3名健康者標本用來circRNA測序,所有5名健康者標本用來circRNA的RT-qPCR驗證。研究獲廣州市第一人民醫院醫學倫理委員會批準(K-2018-027-01)。
2 試劑與儀器 紅細胞保存液CPDA-1購自廣州費森尤斯卡比;PrimeScript RT Master reagent Kit with gDNA Eraser(perfect Real Time)、SYBR Premix Ex Taq Master MixⅡ、無酶水均購自日本TaKaRa公司;TRIzol-LS購自美國life公司;RNaseR購自美國Epicentre公司;一次性白細胞過濾輸血器購自美國pall公司;自動紅細胞計數儀購自北京賽科希德公司;電熱恒溫培養箱購自上海精宏公司;低溫高速離心機購自美國Eppendorf公司;引物序列由上海捷瑞合成;使用qTOWER2.2購自德國analytikjena的PCR儀做qRT-PCR檢測。
3 circRNA高通量測序檢測 5名健康者標本的新鮮紅細胞和4℃儲存20 d紅細胞分別提取總RNA儲存于–80℃,其中3份進行circRNA高通量測序。對0 d組、20 d組、40d組的9份標本(9份/組)做高通量測序。該測序用到了QIAquick PCR 純化試劑(QIAGEN,Hilden,Germany),cDNA文庫在Illumina HiSeqTM 4000(Illumina,San Diego,CA,USA)擴增和測序。
4 circRNA的生物信息學方法與流程 用KEGG和GO分析篩選出母基因在泛素介導的蛋白水解通路中的circRNA。將這些circRNA的類型、來源、新舊進行分析,最終完成其功能注釋。用circBase(http://circbase.org/)與mirTarBase(http://mirtarbase.mbc.nctu.edu.tw/php/index.php)完成數據庫注釋與靶向預測。然后對cirRNA作用miRNA進行靶標預測,所用軟件是mireap(http://mireap.sourceforge.net/),miranda(https://sourceforge.net/projects/mireap/),targetscan(http://www.targetscan.org/vert_72/)。并將miRNA可能作用的mRNA也進行了關聯分析,所用軟件是mirTarBase(mirtarbase.mbc.nctu.edu.tw/php/index.php)。對circRNA預測其結合RBP的能力,所用軟件是circRNA interactome(https://circinteractome.nia.nih.gov)。本測序數據的fasta文件及fastq文件已上傳至NCBI數據庫,獲取地址:https://dataview.ncbi.nlm.nih.gov/object/PRJNA698240,https://dataview.ncbi.nlm.nih.gov/object/PRJNA698384。
5 circRNA、miRNA、mRNA表達量的測定 測定miRNA 的相對表達量采用 qRT-PCR 方法,具體方法參考文獻[11]。circRNA的引物如表1所示,miRNA及mRNA引物設計用軟件prime3(http://frodo.wi.mit.edu/primer3/)完成。

表1 qRT-PCR實驗的引物
6 統計學分析 采用SPSS 16.0軟件和Graphpad Prism5軟件行獨立樣本t檢驗,數據以均數±標準差()表示,P<0.05表示差異有統計學意義。
結 果
1 測序結果分析 經KEGG分析和GO分析顯示,儲存紅細胞中與泛素介導的蛋白水解通路相關的circRNA有近200種,其中大部分circRNA為未命名circRNA,即未被circBase數據庫收錄的novel開頭命名的circRNA,由本次測序研究首次發現。20 d組與0 d(新鮮)組對比,統計學上表達上升的circRNA有:hsa_circ_0036044,hsa_circ_0024173,表達下降的有:hsa_circ_0007112,hsa_circ_0035729,hsa_circ_0035761,hsa_circ_0044231,40 d組與0 d(新鮮)組對比表達上升的有hsa_circ_0035731,表達下降的有:hsa_circ_0002502,hsa_circ_0004724,hsa_circ_0041555。40 d組與20 d組對比表達上升的有:hsa_circ_0019567,hsa_circ_0007112,hsa_circ_0035761,hsa_circ_0044231,hsa_circ_0028196,hsa_circ_0002814,表達下降的有:hsa_circ_0024173。(圖1)。
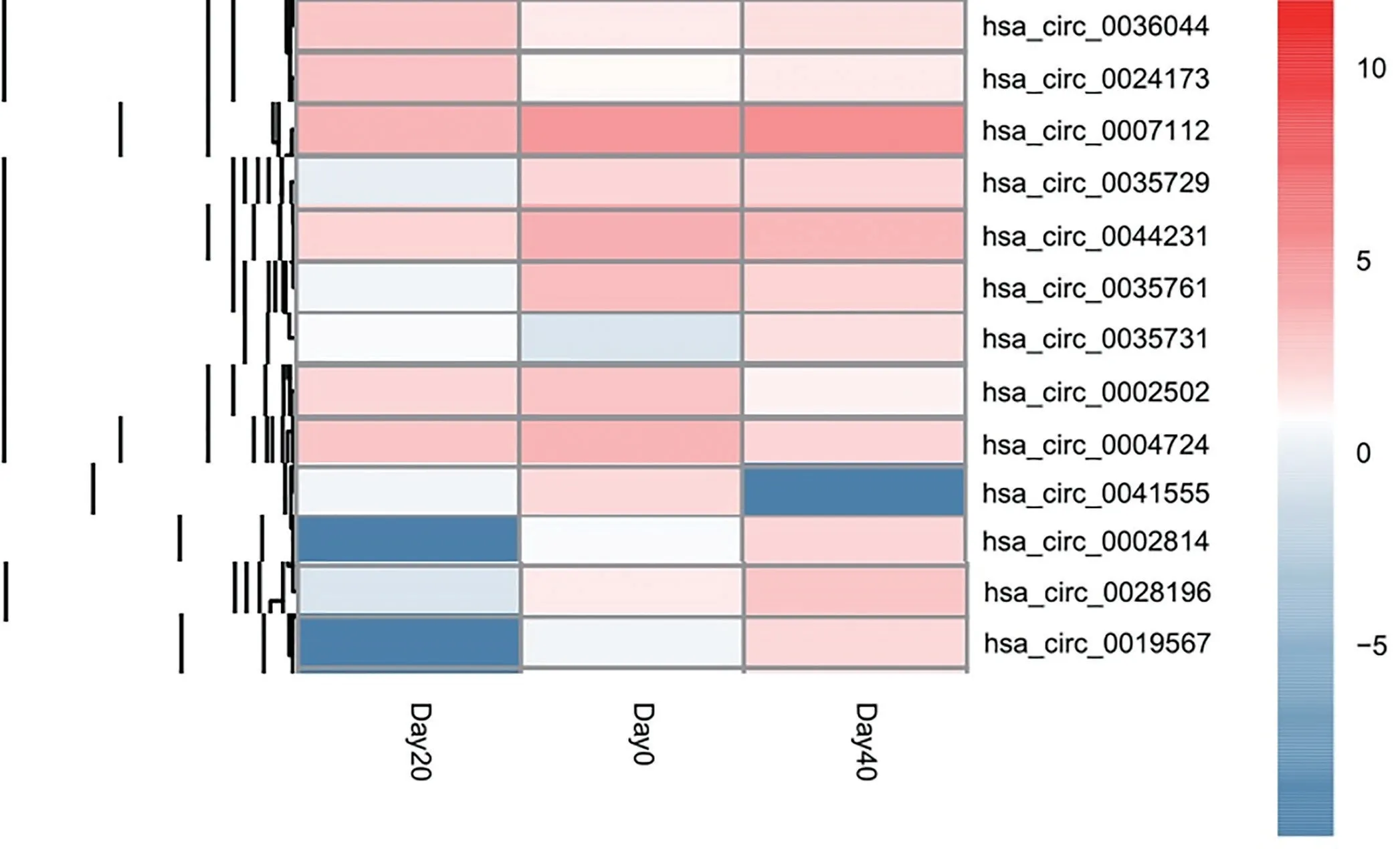
圖1 circRNA分組聚類圖
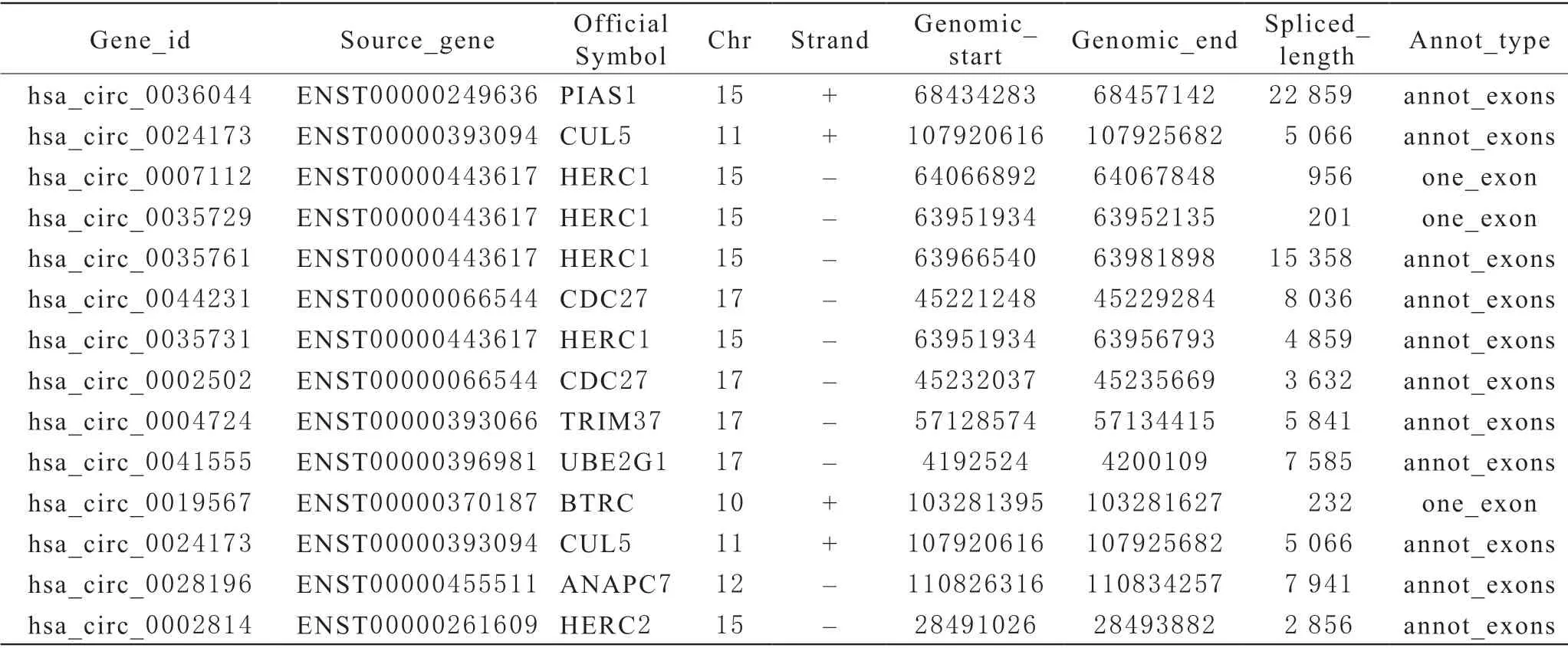
表2 circular RNA統計表
2 生物信息學預測結果 利用circBase和mirTarBase軟件預測,共發現 circRNA-miRNA 13組,其中hsa_circ_0036044能海綿吸附hsa-miR-6766-5p,hsa_circ_0024173能海綿吸附hsa-miR-25-3p,hsa_circ_0035761能海綿吸附hsa-miR-4530,hsa_circ_0044231能海綿吸附hsa-miR-1296-3p和hsamiR-5698,hsa_circ_0002502能海綿吸附hsa-miR-6085,hsa_circ_0004724能海綿吸附hsa-miR-3944-5p,hsa_circ_0041555能海綿吸附hsa-miR-433-3p,hsa_circ_0028196能海綿吸附hsa-miR-4299和hsamiR-7-5p,hsa_circ_0002814能海綿吸附hsa-miR-4675。hsa-miR-4530能靶向作用于TRAF2(TNF receptor-associated factor 2,TNF受體相關因子2),見表3。
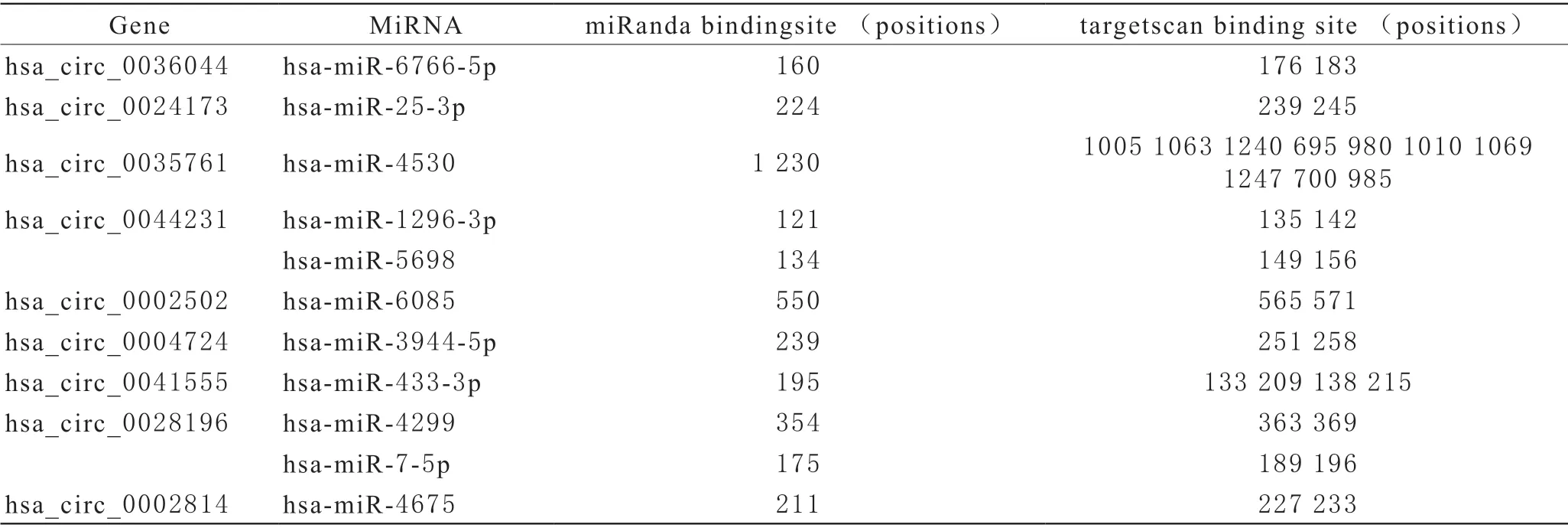
表3 與circRNA結合的miRNA
circRNA interactome數據庫預測顯示,在泛素介導的蛋白水解通路里,具有統計學意義的大部分circRNA可結合多個RBP,只有2個circRNA僅結合一個RBP,即EIF4A3(eukaryotic translation initiation factor 4A3,真核翻譯起始因子4A3),見表4。hsa_circ_0036044、hsa_circ_0007112、hsa_circ_0035729、hsa_circ_0035761、hsa_circ_0044231、hsa_circ_0028196、hsa_circ_0002814都與EIF4A3具有多個結合位點,有很強的結合能力。此外,hsa_circ_0028196和hsa_circ_0036044與U2AF65(U2 small nuclear ribonucleoprotein auxiliary factor 65,U2小核糖核蛋白輔助因子65);hsa_circ_0028196與AGO2(argonaute RISC catalytic component 2,精氨酸RISC催化組分2);hsa_circ_0028196與PTB(polypyrimidine-tract-binding protein,多嘧啶束結合蛋白);hsa_circ_0002814與TDP43(TAR DNA binding protein 43,TAR DNA結合蛋白43)也具3個及以上的結合位點。
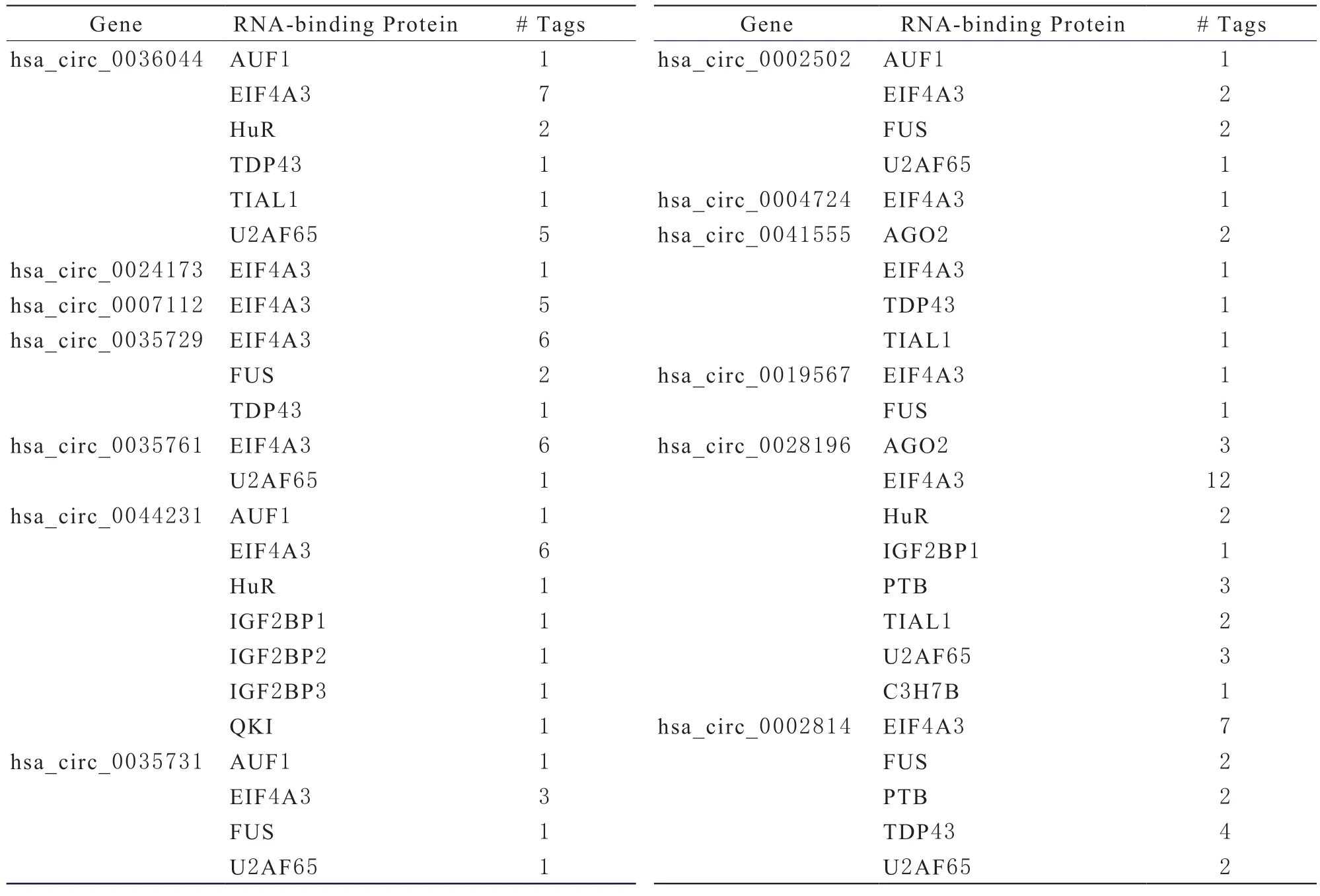
表4 與circRNA結合的RNA 結合蛋白(RBP)
3 qPCR驗證的circRNA的表達 在泛素介導的蛋白石水解通路中具有統計學意義的circRNA共有13個,我們選取了有結合多個RBP或miRNA能力的6個circRNA做熒光定量PCR驗證。顯示相對于0 d(新鮮)紅細胞組,儲存20 d組的hsa_circ_0036044和hsa_circ_0024173表達量上升,hsa_circ_0035761表達量下降,且具有顯著統計學意義。(P<0.001,圖2)。相對于新鮮紅細胞組,儲存40 d組的hsa_circ_0002502表達量下降,且具有統計學意義。(P<0.05,圖2)。相對于儲存20 d組,儲存40 d組hsa_circ_0024173表達量下降,且具有明顯統計學意義。(P<0.01,圖2),hsa_circ_0035761和hsa_circ_0028196表達量上升,且具有顯著統計學意義。(P<0.001,圖2)。

圖2 circRNA的表達量變化(n=5)
4 qPCR驗證預測的靶miRNA的表達 由于circRNA能海綿吸附miRNA,而miRNA能靶向作用于mRNA的性質,許多研究證實了ceRNA機制的存在。根據ceRNA機制原理,circRNA和mRNA的表達量變化應是同一方向,而circRNA和miRNA的表達量變化應是相反方向。hsa-miR-4530在儲存紅細胞芯片檢測中存在[12]。熒光定量PCR顯示相對于新鮮紅細胞組,儲存20 d組的hsa-miR-4530的表達量上升,且具有統計學意義(P<0.001),儲存40 d組相對于儲存20 d組的hsa-miR-4530的表達量下降,且具有統計學意義(P<0.001,圖3)。
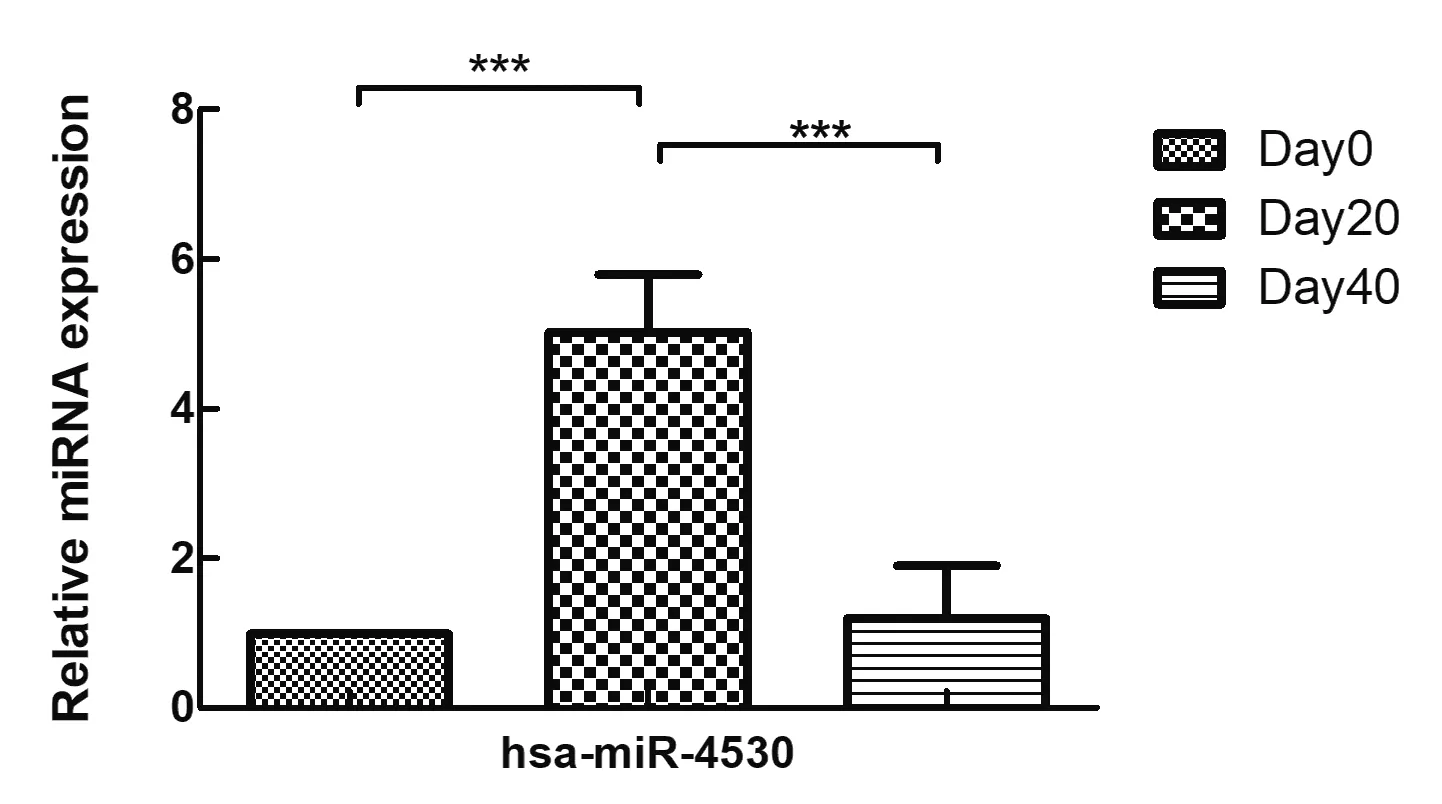
圖3 miRNA的表達量變化(n=5)
5 qPCR驗證的預測的靶mRNA的表達量 對hsa-miR-4530預測得到的靶mRNA,即TRAF2進行熒光定量PCR檢測。顯示相對于新鮮紅細胞組,儲存20 d組的TRAF2表達量下降(P<0.01),儲存40 d組相對于儲存20 d組的TRAF2的表達量上升,且差異具有統計學意義(P<0.001,圖4)。
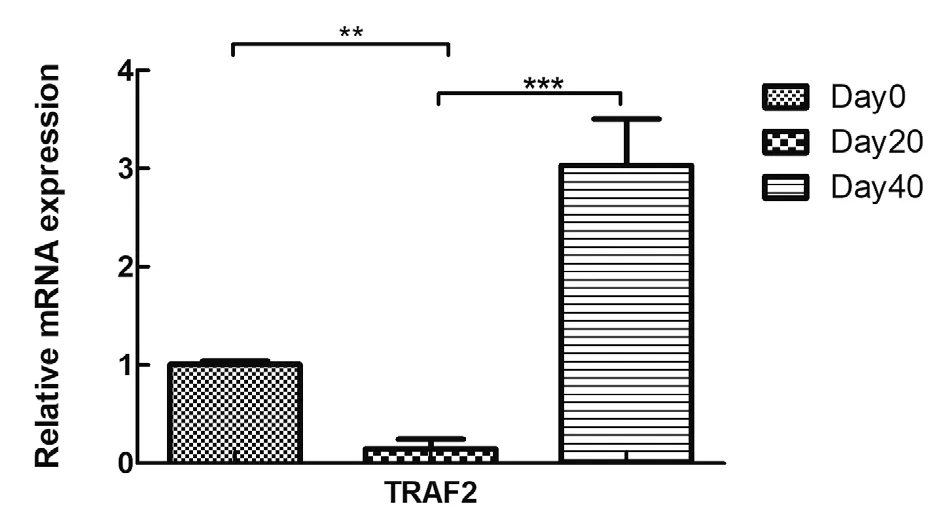
圖4 mRNA的表達量變化(n=5)
討 論
已有研究表明紅細胞儲存27天時,circRNA豐度高于相應mRNA的豐度,而且證實了紅細胞是脫核后產生了大量的circRNA富集現象[13]。circRNA的產生更不是一個隨機事件,在造血細胞中每個基因檢測到的circRNA變體數量與每個轉錄本的外顯子數量之間沒有明顯的相關性[14]。這些都暗示了circRNA有可能精細化調節紅細胞儲存損傷的生理過程。本研究選取了在儲存損傷中發揮重要作用的泛素介導的蛋白水解通路的circRNA表達進行統計分析,發現了有近200個cirRNA的母基因富集在這條通路且具有顯著統計學意義,相比其他通路而言數量十分巨大。有部分circRNA如hsa_circ_0036044、hsa_circ_0035729只在20 d與0 d對比時表達量變化明顯,呈現了儲存前期的變化。有部分circRNA如hsa_circ_0019567、hsa_circ_0028196、hsa_circ_0002814只在40 d與20 d對比時表達量變化明顯,呈現了儲存后期的變化。而hsa_circ_0035731、hsa_circ_0002502、hsa_circ_0004724、hsa_circ_0041555只在40 d時與0 d對比時表達量變化明顯,呈現一個累積量變的過程。還有部分cirRNA如hsa_circ_0024173、hsa_circ_0007112、hsa_circ_0035761、hsa_circ_0044231在20 d與0 d及40 d與20 d兩個儲存階段對比,表達量變化呈反向趨勢。
一般認為儲存損傷可由紅細胞自身代謝產物積累、氧化損傷、紅細胞凋亡漸增引起。細胞凋亡會激活胱天蛋白酶(半胱氨酸蛋白酶)的蛋白水解級聯反應,該事件可導致細胞最終死亡。泛素介導的蛋白水解在細胞凋亡中發揮重要作用,無用的和破損的蛋白質都通過此途徑降解,并通常需要消耗ATP。紅細胞雖然沒有核,但它仍能嚴格精細的執行mRNA翻譯[15],這些翻譯同樣存在不同程度的調控。本文發現hsa_circ_0035761能海綿吸附hsa-miR-4530,而hsamiR-4530又能靶向作用于腫瘤壞死因子受體相關因子2(TNF receptor-associated factor 2,TRAF2)。腫瘤壞死因子(TNF)是一種炎癥因子,可通過激活兩種不同的受體TNFR1和TNFR2發揮其功能。兩種受體都可以激活經典的NF-κB和JNK MAP激酶信號傳導,而TNFR2也可以激活非經典的NF-κB信號傳導,導致與炎癥、細胞增殖和細胞壽命相關的基因表達量發生變化[16]。TRAF2是TNF-α介導的c-Jun N末端激酶(JNK)激活所必需的,它有助于NF-kappaB的激活并介導抗凋亡信號[17]。在兔網織紅細胞中,TRAF2可以與細胞凋亡蛋白1的抑制劑結合,抑制某些胱天蛋白酶(caspases)活性,控制某些促凋亡刺激物的表達量[18]。細胞凋亡蛋白1在細胞凋亡中發揮作用表現在能直接結合caspases,以及通過結合RING結構域激活E3泛素連接酶[18]。本研究推測在儲存40 d比20 d時,由于紅細胞的儲存損傷明顯加劇,hsa_circ_0035761出于抗凋亡作用,表達量明顯增高,解除了hsa-miR-4530對TRAF2抑制作用,使TNFR2表達量增高。
本研究還表明很多circRNA具有多個RBP結合位點。真核翻譯起始因子4A3(eukaryotic translation initiation factor 4A3,EIF4A3)是出現頻率最高的RBP。最近的研究發現,乳腺癌中EIF4A3和E2F1可以促進circSEPT9的表達,而circSEPT9表達的增加與腫瘤晚期預后不良呈正相關[19]。EIF4A3通過與MMP9 mRNA轉錄物結合,誘導了circMMP9環化,增加了膠質母細胞瘤中充當致癌基因的circMMP9表達[20]。目前文獻都證明了在各種通路及代謝過程中RBP具有促進circRNA生成表達的功能,并無抑制功能。而處于泛素介導的蛋白水解酶通路中多個circRNA表達量都增高的現象與它們具有多個RBP結合能力有待進一步研究。
本文選擇了母基因富集在泛素介導的蛋白水解通路中的circRNA做相關預測研究,用PCR證實了它們及相關把分子的表達變化,它們不同的表達變化模式可能暗示了其有精細調節儲存損傷機制。通過生物信息學預測下游的功能,初步展示了circRNA通過miRNA調控mRNA的生成途徑,RBP促環化可能是其生成的調控機制。盡管母基因來源于泛素介導的蛋白水解通路中的單個circRNA并不一定作用于泛素介導的蛋白水解通路,但通過與母基因的調控關系去探討它的功能是很主要的一部分。我們的數據為紅細胞儲存損傷中的circRNA分子機制研究提供了新研究視角,并發現某些circRNA可能與儲存損傷中抗凋亡密切相關。
利益沖突所有作者均聲明不存在利益沖突

