硫酸銨與鈦酸鈣焙燒動力學(xué)
劉維燥,胡金鵬,劉清才,李春
(1重慶大學(xué)材料科學(xué)與工程學(xué)院,重慶 400044;2四川大學(xué)化學(xué)工程學(xué)院,四川成都 610065)
自工業(yè)革命以來,人類大量使用化石燃料,導(dǎo)致CO2排放量迅速增加,CO2減排已成為全球的熱點話題[1]。CO2捕集與封存(CCS)是國內(nèi)外主要研究的末端碳減排技術(shù)[2]。CO2礦化利用與封存是采用堿性的天然礦物或工業(yè)固廢將CO2礦化,得到高附加值的化學(xué)品,而CO2被轉(zhuǎn)化為自然界中穩(wěn)定存在的固體碳酸鹽[3-6]。鋼鐵工業(yè)是最大的工業(yè)CO2排放源之一,同時也是最大的工業(yè)固廢源之一,主要固廢包括高爐渣和鋼渣。高爐渣的主要成分是鈣、鎂、鋁等金屬的硅酸鹽[7],其中氧化鈣含量通常在34%~52%、氧化鎂含量在6%~10%、氧化鋁含量在10%~14%。2018年全球生鐵產(chǎn)量約為12.5億噸,副產(chǎn)高爐渣為3億~3.6億噸[8]。如果利用高爐渣中的鈣、鎂組分固碳,理論上每年可以固定CO2為0.84億~1.01億噸。
含鈦高爐渣是一種特殊的高爐渣,是以釩鈦磁鐵礦為原料高爐煉鐵過程中產(chǎn)生的廢渣,除了常規(guī)的鈣、鎂、硅、鋁組分外,還含有約20%的TiO2,其主要物相為鈣鈦礦、鈦透輝石、富鈦透輝石和鎂鋁尖晶石等[9]。2016年以來,我國每年排放2000萬噸以上含鈦高爐渣。目前,研究者們采用鹽酸[10]、硫酸[11-12]等無機酸浸出含鈦高爐渣提取鈦,但是由于廢渣組分復(fù)雜導(dǎo)致酸耗量大、廢酸難以循環(huán)或回收等問題,使得其工業(yè)化遙遙無期。
近年來,李春等[13-14]提出以可循環(huán)的硫酸銨為助劑,利用含鈦高爐渣礦化CO2同時提取其中的高附加值鈦鋁組分,鈦和鋁分別以高純度TiO2和Al2O3回收,在最優(yōu)條件下回收率分別達(dá)87%和75%,同時鈣鎂組分用于固定CO2,每噸含鈦高爐渣可固定240kg CO2。由于提取率高、助劑可循環(huán)、三廢排放少等優(yōu)點,該法或成為最有前景的方法之一。在這個過程中硫酸銨的熱分解行為至關(guān)重要,同時鈦酸鈣作為含鈦高爐渣中的主要物相之一,其與硫酸銨的反應(yīng)動力學(xué)及機理的研究將有助于更深刻地認(rèn)識硫酸銨焙燒法,從而進(jìn)一步優(yōu)化工藝過程。
Raisaku等[15]研究了硫酸銨的熱分解行為,認(rèn)為該過程存在硫酸氫氨、氨基磺酸及焦硫酸銨等中間產(chǎn)物。劉科偉[16]、范蕓珠[17]等認(rèn)為硫酸銨的分解分為3個階段,反應(yīng)見式(1)~式(3)。

潘騰等[18]研究了硫酸銨熱分解動力學(xué),計算了上述3個階段的反應(yīng)活化能分別為96.47kJ/mol、79.47kJ/mol、98.3kJ/mol,屬于化學(xué)反應(yīng)控制范疇。由于沒有足夠的證據(jù)證明焦硫酸銨的存在,因此范蕓珠等[17]認(rèn)為焦硫酸銨不穩(wěn)定,極易分解。唐定興等[19]則認(rèn)為熱分解僅包括兩個階段:①硫酸銨分解為硫酸氫銨;②硫酸氫銨完全分解為氣體。
硫酸銨與礦物反應(yīng)的動力學(xué)研究報道較少,其中Shen等[20]研究其與氧化鋅礦的反應(yīng)動力學(xué),認(rèn)為該過程受化學(xué)反應(yīng)控制,活化能為41.74kJ/mol。Yin等[21]研究其與高爐渣的反應(yīng)動力學(xué),認(rèn)為反應(yīng)包括硫酸銨分解為硫酸氫銨、硫酸氫銨與高爐渣反應(yīng)兩個步驟,前者為限制環(huán)節(jié),活化能為102kJ/mol。硫酸銨與鈦酸鈣的反應(yīng)動力學(xué)研究尚未見報道。本文分別采用等溫法和非等溫法研究了硫酸銨與鈦酸鈣的焙燒動力學(xué),考察了焙燒反應(yīng)的動力學(xué)參數(shù)和控制步驟。
1 實驗部分
1.1 實驗原料
本實驗所采用的硫酸銨、鈦酸鈣、氫氧化鈉、碳酸氫鈉、硫酸鐵銨等均為分析純,由成都市科龍化工試劑廠提供。
1.2 實驗方法
等溫動力學(xué)的實驗過程中,硫酸銨與鈦酸鈣反應(yīng)[式(4)]的理論質(zhì)量比約為1.94∶1,因此為保證硫酸銨大大過量,將硫酸銨與鈦酸鈣以6∶1的質(zhì)量比均勻混合后,放置在馬弗爐中隨爐升溫至一定溫度,并保溫一定時間。所得焙燒渣采用3.5%的稀硫酸在55℃下攪拌浸出1h后過濾,提取出的Ti和未分解完全的銨進(jìn)入濾液中,測定其含量,并分別計算鈦酸鈣中Ti的提取率和硫酸銨的分解率。將測得的硫酸銨的分解率和鈦的提取率分別代入合適的動力學(xué)模型進(jìn)行數(shù)據(jù)擬合,得到不同溫度下的動力學(xué)參數(shù)。

1.3 分析測試
采用蒸餾法測定溶液中銨根離子的含量。采用氧化還原滴定法測定溶液中鈦離子的含量。在測定原料鈦酸鈣中鈦元素的總含量時,先用過氧化鈉與氫氧化鈉在750℃下高溫熔融樣品,再用1+1鹽酸浸出,用氧化還原滴定法測定濾液中的鈦離子含量,并以此來計算原料中鈦的含量。
采用同步熱重差熱掃描儀(TG-DSC,STA449C,德國Netzsch公司)完成焙燒過程的非等溫動力學(xué)研究,溫度區(qū)間為20~800℃。掃描電鏡(SEM,JSM-7500F,日本電子株式會)和電子能譜(EDS,IS250,英國牛津儀器公司)聯(lián)用對樣品分別進(jìn)行形貌分析和元素組成分析,所采用的加速電壓為5kV。
2 結(jié)果與討論
2.1 硫酸銨分解等溫動力學(xué)
為保證硫酸銨大大過量,將硫酸銨與高爐渣的焙燒質(zhì)量比定為6∶1,考察了溫度對硫酸銨分解生成硫酸氫銨的影響,結(jié)果如圖1所示。從結(jié)果中可以看出,化學(xué)反應(yīng)速率對溫度非常敏感,硫酸銨的分解率在相同的焙燒時間內(nèi)隨著溫度升高而增加,化學(xué)反應(yīng)加快。因此,推測硫酸銨的分解過程為化學(xué)反應(yīng)控制。然而,從結(jié)果中可以發(fā)現(xiàn),當(dāng)焙燒溫度升高至350℃、焙燒溫度延長至45min以后,硫酸銨分解率的增長開始逐漸趨于緩和,分解率結(jié)果與焙燒時間之間的線性關(guān)系隨著焙燒溫度的升高而變差。
將圖1中的數(shù)據(jù)代入化學(xué)反應(yīng)控制所對應(yīng)的機理函數(shù)中進(jìn)行擬合,并繪制動力學(xué)曲線,結(jié)果見表1。從結(jié)果中可以看出,隨著焙燒溫度的升高,化學(xué)反應(yīng)速率常數(shù)逐漸增大而機理函數(shù)積分式[1-(1-α)1/3]與時間之間的線性擬合度逐漸變差,當(dāng)焙燒溫度高于320℃時,其線性擬合度低于0.98。在溫度段290~320℃之間,機理函數(shù)積分式[1-(1-α)1/3]與時間之間良好的線性擬合結(jié)果,可證明硫酸銨分解為化學(xué)反應(yīng)控制。
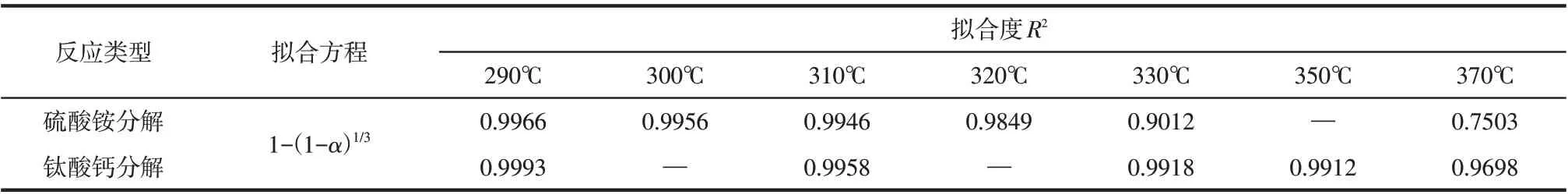
表1 硫酸銨與鈦酸鈣分解動力學(xué)方程擬合結(jié)果

圖1 不同焙燒溫度下焙燒時間對硫酸銨分解的影響
根據(jù)阿倫尼烏斯公式lnk=lnA-E/(RT),將lnk對T-1作圖,結(jié)果如圖2所示,由此得出該反應(yīng)的動力學(xué)方程為lnk=-7885.28/T+7.15。其中活化能E=65.56kJ/mol、指前因子A=1299.81,與前面的實驗分析結(jié)果一致,進(jìn)一步驗證了該硫酸銨分解過程受化學(xué)反應(yīng)控制。

圖2 硫酸銨分解過程ln k-T-1曲線
2.2 鈦酸鈣分解等溫動力學(xué)
考察了焙燒溫度和焙燒時間對鈦酸鈣中鈦的提取率的影響。從圖3中可以看出,化學(xué)反應(yīng)速率對反應(yīng)溫度非常敏感,溫度升高,Ti的提取率在相同的焙燒時間內(nèi)逐漸升高,可根據(jù)溫度對化學(xué)反應(yīng)速率的影響初步推斷硫酸氫銨分解鈦酸鈣的反應(yīng)為化學(xué)反應(yīng)控制。但Ti的提取率隨時間增長的線性隨溫度升高而降低。當(dāng)焙燒溫度達(dá)到370℃、焙燒時間達(dá)到60min以后,硫酸銨分解鈦酸鈣的反應(yīng)趨于結(jié)束。

圖3 不同焙燒溫度下焙燒時間對Ti的提取的影響
將圖3中的數(shù)據(jù)代入化學(xué)反應(yīng)控制機理函數(shù)中進(jìn)行擬合并繪制動力學(xué)曲線,結(jié)果如表1所示。所得化學(xué)反應(yīng)速率常數(shù)與溫度之間呈正相關(guān)性,但該模型機理函數(shù)的積分式[1-(1-α)1/3]與時間之間的線性擬合度逐漸變差,當(dāng)溫度升高至370℃時,其線性擬合度低于0.99,這與Ti的提取率結(jié)果趨勢一致。290~350℃內(nèi),積分式[1-(1-α)1/3]與時間之間較好的擬合度可證明硫酸銨分解鈦酸鈣為化學(xué)反應(yīng)控制。
根據(jù)阿倫尼烏斯公式lnk=lnA-E/(RT),將lnk對T-1作圖,結(jié)果如圖4所示,由此得出該反應(yīng)的動力學(xué)方程為lnk=-6031.69/T+4.03。其中活化能E=50.15kJ/mol,指前因子A=56.31,與前面的實驗分析結(jié)果一致,進(jìn)一步驗證了鈦酸鈣分解過程受化學(xué)反應(yīng)控制。

圖4 鈦酸鈣分解過程ln k-T-1曲線
對比硫酸銨和鈦酸鈣的分解過程的動力學(xué)結(jié)果,可以看出硫酸銨分解反應(yīng)的溫度段較低,當(dāng)焙燒溫度超過330℃時硫酸銨的分解反應(yīng)趨于結(jié)束,而鈦酸鈣分解反應(yīng)的溫度段相對較寬。硫酸銨和鈦酸鈣分解反應(yīng)的活化能分別65.56kJ/mol和50.15kJ/mol。硫酸銨分解以及鈦酸鈣分解的兩步反應(yīng)同時存在,且均為化學(xué)反應(yīng)控制。鈦酸鈣與硫酸銨的反應(yīng)可分為兩個步驟:①硫酸銨分解為硫酸氫銨;②硫酸氫銨與鈦酸鈣反應(yīng)。反應(yīng)如式(5)、式(6)所示。

文獻(xiàn)表明[21],硫酸氫銨與礦物的反應(yīng)十分迅速,因此鈦酸鈣和硫酸氫銨的反應(yīng)受到硫酸銨的分解控制;實際上鈦酸鈣分解的活化能(50.15kJ/mol)為上述反應(yīng)式(5)的活化能,對比單一的硫酸銨的分解活化能(65.56kJ/mol),其數(shù)值降低,這是因為反應(yīng)(6)促進(jìn)了硫酸銨的分解。
對焙燒前后原料進(jìn)行SEM分析,結(jié)果如圖5所示。從圖5(a)可知,原料鈦酸鈣形貌為團(tuán)聚的小球狀,其團(tuán)聚緊密、表面光滑。進(jìn)一步對焙燒浸出渣進(jìn)行分析[圖5(b)],SEM結(jié)果結(jié)合EDS結(jié)果可以知道,長條狀產(chǎn)物為反應(yīng)生成的硫酸鈣,而未反應(yīng)完全的鈦酸鈣其形貌由反應(yīng)前的光滑緊密轉(zhuǎn)變成反應(yīng)后的粗糙多孔。

圖5 鈦酸鈣和浸出渣的SEM圖及EDS結(jié)果
2.3 硫酸銨與鈦酸鈣焙燒非等溫動力學(xué)
將硫酸銨與鈦酸鈣按6∶1的質(zhì)量比進(jìn)行均勻混合后,進(jìn)行熱分析。圖6是在N2氛圍(30mL/min)下以不同升溫速率(β=5℃/min、10℃/min、15℃/min、20℃/min)得到的TG-DSC曲線圖。根據(jù)TG-DSC結(jié)果可知,這個升溫過程包含了多個反應(yīng),而之前的等溫動力學(xué)結(jié)果表明,包括硫酸銨和鈦酸鈣兩步分解反應(yīng)的整個焙燒過程反應(yīng)溫度段在370℃以下,這與DSC結(jié)果中第一個吸熱峰所在的溫度區(qū)間相匹配。因此,對該峰所在溫度區(qū)間內(nèi)的TG-DSC數(shù)據(jù)進(jìn)行處理,采用三種不同非等溫動力學(xué)法對焙燒過程進(jìn)行研究。

圖6 不同升溫速率(β)下的TG-DSC曲線
以ln(β/Tm2)為縱坐標(biāo),1/Tm為橫坐標(biāo)作圖,采用基辛格法求取硫酸銨與鈦酸鈣的焙燒反應(yīng)過程的表觀活化能,結(jié)果如圖7所示。根據(jù)該直線的斜率-E/R,可求得硫酸銨與鈦酸鈣焙燒反應(yīng)的表觀活化能為E=53.96kJ/mol。

圖7 基辛格法得到的對的關(guān)系
將第一個吸熱峰所在溫度區(qū)間內(nèi)的失重量劃分成10等份,并讀取每個點的溫度值,這就是得到轉(zhuǎn)化率(即失重率)為10%~90%時的數(shù)據(jù)。根據(jù)FWO法和KAS法分對所得數(shù)據(jù)進(jìn)行處理后,按照其所對應(yīng)的方程,分別以lnβi為縱坐標(biāo)、1/Tαi為橫坐標(biāo)和以lnβi/Tαi2為縱坐標(biāo)、1/Tαi為橫坐標(biāo)作圖(圖8)。得到不同轉(zhuǎn)化率下的擬合直線,并分別按照其斜率-1.052Eα/(RTαi)和lnβi/Tαi2求解兩種方法不同轉(zhuǎn)化率下的表觀活化能,結(jié)果見表2。對兩組表觀活化能分別求平均值,可計算硫酸銨與鈦酸鈣焙燒過程采用FWO法和KAS法時,其反應(yīng)表觀活化能值分別為76.67kJ/mol和71.05kJ/mol。

圖8 FWO法得到的lgβi對關(guān)系及KAS法得到的對關(guān)系

表2 FWO法和KAS法不同轉(zhuǎn)化率下的活化能
從結(jié)果中可以看出,采用基辛格法所得表觀活化能位于等溫法所得硫酸銨和鈦酸鈣分解活化能之間,與實驗結(jié)果相符;而FWO法和KAS法所得表觀活化能均大于硫酸銨分解活化能,這可能是由上述所介紹的非等溫法的不足之處引起的,但從活化能隨轉(zhuǎn)化率的變化(圖9)可知,隨著溫度升高、反應(yīng)的正向進(jìn)行,焙燒過程的活化能降低,這與等溫動力學(xué)所得結(jié)果相符,即整個過程為多步反應(yīng)過程,焙燒反應(yīng)受活化能較高的硫酸銨分解控制,鈦酸鈣促進(jìn)其分解。因此在實際工業(yè)應(yīng)用中,采用加快硫酸銨分解的手段將促進(jìn)鈦的提取,例如在物料中加入一些酸性組分,使其與硫酸銨分解產(chǎn)生的氨結(jié)合,或通過控制焙燒過程氣氛,降低氨氣分壓,促進(jìn)硫酸銨分解向右進(jìn)行。

圖9 FWO法和KAS法得到的活化能與轉(zhuǎn)化率的關(guān)系
3 結(jié)論
本文采用等溫動力學(xué)法對硫酸銨焙燒鈦酸鈣過程中的硫酸銨分解和硫酸氫銨分解鈦酸鈣兩步反應(yīng)分別進(jìn)行了研究,求取了相應(yīng)的動力學(xué)參數(shù),結(jié)合SEM對反應(yīng)前后鈦酸鈣形貌變化的分析,進(jìn)一步闡述了焙燒機理。同時采用三種非等溫動力學(xué)法對整個焙燒過程進(jìn)行了對比輔助研究,并得到以下結(jié)論。
(1)硫酸銨與鈦酸鈣的分解等溫動力學(xué)結(jié)果表明,硫酸銨與鈦酸鈣的焙燒過程分為兩步,即硫酸銨分解和硫酸氫銨與鈦酸鈣反應(yīng)。其中硫酸銨分解為限制環(huán)節(jié),受化學(xué)反應(yīng)控制。單一硫酸銨分解反應(yīng)活化能為65.56kJ/mol,加入鈦酸鈣后促進(jìn)硫酸銨的分解,活化能降低至50.15kJ/mol。
(2)采用三種非等溫動力學(xué)方法(基辛格法、FWO法和KAS法)求得硫酸銨與鈦酸鈣焙燒過程的表觀活化能值分別為53.96kJ/mol、76.67kJ/mol和71.05kJ/mol。其中基辛格法所得表觀活化能位于等溫法所得硫酸銨和鈦酸鈣分解活化能之間,驗證了等溫動力學(xué)的活化能結(jié)果。
盡管FWO法和KAS法所得活化能均大于硫酸銨與鈦酸鈣的分解活化能,但表觀活化能隨著轉(zhuǎn)化率增加而減小,這與等溫動力學(xué)所得控制步驟結(jié)論相一致,即低溫段受活化能較高的硫酸銨分解所控制,高溫段受活化能較低的鈦酸鈣分解所控制。因此,三種非等溫動力學(xué)可以從活化能和控制步驟兩個不同的方面對等溫動力學(xué)進(jìn)行輔助證明。

