用于水中有機污染物處理的Co3O4/TiO2/多孔炭復合材料
張書泉,徐敏,王國滔
(福州大學至誠學院,福建福州 350002)
隨著化工、制藥與印染等工業的快速發展,水中有機污染物的治理問題已經成為制約社會可持續發展的重要因素。工業廢水中的有機污染物主要包含個人護理產品、藥物、印染肥料以及殺蟲劑等,這些對人類健康甚至整個生態系統危害很大。目前工業上主要采取物理法、化學氧化法、生物氧化法和焚燒法等技術處理有機污染物[1-2],其效果較好,但是存在耗時長、耗能大、投資高的問題。因此開發一種可以高效處理水中污染物又能容易回收、避免造成二次污染的新型功能材料,是目前材料化學領域備受重視的研究方向。
目前,材料學家廣泛認可的通過新型功能材料處理水中污染物的方法有兩種:①多孔材料吸附法;②光催化法。多孔材料吸附法,主要是利用多孔材料的微/介孔特性,對有機或無機小分子具有很強的吸附能力,通過物理吸附作用將水溶液中的污染物分子移除。目前所用的多孔材料主要有活性炭[3]、黏土材料[4]、沸石[5]及金屬有機框架材料(MOF)[6]等。如B??ek等[7]制備了一種在水中具有高度穩定性的MOF材料Al-ICR-6,該材料比表面積高達1362m2/g,對水中雙酚A吸附量可達326mg/g。又如Lin等[8]將含Co的MOF(ZIF-67)通過炭化的方法,原位生成了Co3O4/多孔炭復合材料,發現該材料能夠快速地吸附水中的羅丹明B,并且能夠通過磁鐵進行回收。這些材料具有的共同特性就是孔隙率高、比表面積大、對污染物吸附量大、吸附速率高并且價格低廉,是一類比較理想的吸附質材料。但是這類材料缺少將污染物分解成無害物質的能力,因此往往需要額外的手段將吸附的污染物移除后才能繼續使用,對材料的實際應用造成阻礙。
光催化法是通過太陽光照射光催化劑,使其產生光生電子和空穴,再與水分子或溶解氧氣反應生成高活性的羥基自由基,進而把水中的有機污染物或重金屬以氧化還原的方法變為無毒或低毒害性物質[9]。目前應用于水中污染物處理的光催化材料有改性的TiO2、CdS、g-C3N4等諸多半導體材料[10-11]。這類光催化材料通過太陽能有效分解有機污染物,綠色環保,但是通常存在著表面積較小、對有機污染物移除速度較慢的問題。目前多有報道將光催化材料與多孔材料進行復合,這類復合材料同時具有較強的吸附與降解的能力[12]。例如Zhang等通過水熱法制備了Zn2SiO4-ZnO-生物炭三元復合材料,該材料不僅對水中抗生素甲硝唑具有較好的吸附能力,并且可以通過光催化作用實現污染物的完全降解[13]。這類復合光催化材料雖然實現了吸附能力的提升,但是依然存在著一個問題,就是將其投入到水體中就很難再次回收,這不僅造成了材料的浪費,還有可能造成二次污染。因此研發一種既可以快速吸附水中污染物,還能在溫和條件下綠色環保地將污染物分解成無害物質,同時還容易回收再利用的新型功能材料,十分具有研究意義。
由于MOF材料具有易合成、孔結構及成分具有可調節性等特點,近年來以MOF為前體模板,通過高溫炭化法制備的金屬氧化物(或氮化物、炭化物等)/多孔炭復合材料,及其在催化[14]、能源[15]、環境[16]等領域的應用受到越來越多研究者的關注。本研究選取NH2-MIL-125(Ti),一種經典的含Ti的MOF材料作為前體,通過后修飾的方法,在MOF孔道中引入Co2+,再經過炭化處理得到Co3O4/TiO2/多孔炭復合材料,并考察了該材料對水中甲基橙的處理效果。這類材料綜合了多孔炭的吸附特性、TiO2的光催化特性以及磁性Co3O4帶來的易回收特性,對應用于水污染物處理的新型功能材料的開發提供了依據。
1 材料和方法
1.1 實驗材料及儀器
本研究所使用的試劑均為分析純。Ti(OC4H9)4、Co(NO3)2·6H2O、2-氨基對苯二甲酸、甲基橙,上海阿拉丁生化科技股份有限公司;無水甲醇、N,N-二甲基酰胺(DMF)、正己烷,國藥集團化學試劑有限公司。
用Micromeritics ASAP 2020吸附儀在77K下,通過N2吸附測試樣品比表面積(BET測試)。用RIGAKU公司的DMAX 2500粉末衍射儀測得粉末衍射曲線(PXRD)。使用ESCALAB 250型X射線光電子能譜儀檢測樣品中Co的化學狀態。采用美國FEL公司TECNAL G2 F20型場發射透射電鏡(TEM)表征樣品的形態。使用美國FEI公司的Quanta 250掃描電子顯微鏡所配套的X射線能譜儀(XPS)對樣品的化學成分進行分析。使用美國Thermo Fisher Scientific公司的iCAP7000型電感耦合等離子體發射光譜儀(ICP-AES)對樣品進行元素分析。使用Cary 7000紫外可見近紅外分光光度計測試污染物水溶液的紫外-可見吸收光譜。
1.2 樣品制備
(1)NH2-MIL-125(Ti)制備 NH2-MIL-125(Ti)的制備參照文獻[17]所述。稱取510.5mg的Ti(OC4H9)4,溶于12.5mL無水甲醇配成溶液A;將543mg的2-氨基對苯二甲酸溶于12.5mLN,N-二甲基酰胺,配成溶液B;再將A、B溶液混合均勻,攪拌10min,裝入反應釜,于150℃下反應16h。自然冷卻后離心分離,將沉淀物用甲醇洗滌3次后,真空干燥。繼而將樣品在甲醇中浸泡3天,以交換出NH2-MIL-125(Ti)孔道中的DMF溶劑分子,離心干燥后,得到預處理的NH2-MIL-125(Ti)。
(2)Co(NO3)2/NH2-MIL-125(Ti)的制備 稱取120mg Co(NO3)2·6H2O,將其溶于0.6mL蒸餾水中。而后稱取800mg預處理的NH2-MIL-125(Ti)分散于150mL除水的正己烷中,超聲30min使之分散均勻。在劇烈攪拌下,將硝酸鈷水溶液逐滴加入NH2-MIL-125(Ti)的正己烷懸浮液中,滴加速度約為20μL/min。繼續攪拌2h,過濾得到黃色沉淀物,烘干得到前體120-Co(NO3)2/NH2-MIL-125(Ti),記為C120-pre。采用同樣方法制備一批硝酸鈷含量不同的樣品作為對比樣(硝酸鈷含量分別為0、80mg、120mg、200mg及240mg)。
(3)Co3O4/TiO2/多孔炭的制備 將制備的前體Co(NO3)2/NH2-MIL-125(Ti)置于氧化鋁坩堝中,在N2保護下在750℃進行炭化,升溫速率為5℃/min,恒溫時間5h。自然降溫后得到產物Co3O4/TiO2/多孔炭。根據前體中硝酸鈷含量不同,分別命名為C0、C80、C120、C160、C200、C240。為了方便進行對比,不同樣品制備時加入的各原材料含量列于表1。與此同時,通過ICP-AES對合成的各個樣品進行了元素分析,以表征樣品中各組分含量,測試結果同樣列于表1(元素分析測試所得的Ti與Co含量換算成TiO2及Co3O4含量,以便對比)。

表1 樣品制備時加入各原料含量以及實測樣品中各組分含量
1.3 吸附及催化降解實驗
在吸附實驗中,稱取50mg的樣品于燒杯中,再加入100mL、濃度為100mg/L的甲基橙(MO)水溶液。在遮光條件下進行磁力攪拌,分別在吸附時間為2min、5min、8min、15min、20min及30min時取2mL樣品,用微孔濾膜過濾,濾液通過紫外-可見分光光度計確定甲基橙濃度。
在降解實驗中,稱取25mg的樣品于燒杯中,再加入70mL、濃度為50mg/L的甲基橙水溶液,遮光攪拌30min以達到吸附/脫附平衡。去除遮光設施,將250W的高壓Hg燈懸掛于液面上方15cm處,在攪拌下開始光催化實驗。將開燈時間記為t=0時刻,并在t=0及60min時用注射器取樣,并用微孔濾膜過濾,對濾液進行紫外-可見吸收光譜測試,以計算降解率。
2 結果與討論
2.1 PXRD分析
選取了3個Co3O4含量不同的樣品,C0、C120及C240進行了PXRD測試,以表征其物相組成。從圖1中可以看出,在2θ=27.5°、36.3°、41.2°、44.1°、51.6°、54.3°、69.2°出現了金紅石相TiO2的衍射峰,而2θ=25.2°、47.7°、63.4°處出現的衍射峰則可以歸屬于銳鈦礦TiO2。從衍射峰強度來看,金紅石相TiO2為樣品的主要成分。但是Co3O4的衍射峰在C120及C240樣品的PXRD譜圖中難以被觀察到,可能原因是Co3O4的含量太少且顆粒太小,導致衍射峰強度太弱。將C240的粉末衍射譜圖放大,并與Co3O4標準卡片(PDF#65-3103)進行對比(圖2),可以在2θ=19.1°、31.4°、36.9°處發現立方Co3O4的強度微弱的衍射峰。
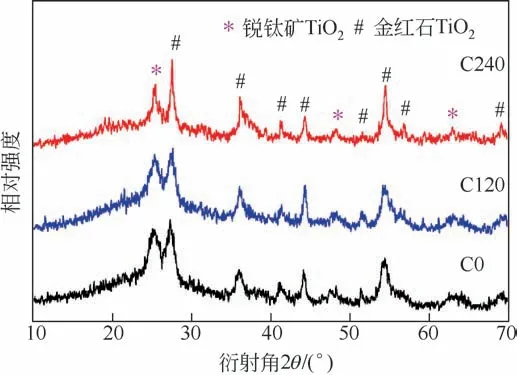
圖1 樣品C0、C160及C240的粉末衍射譜圖
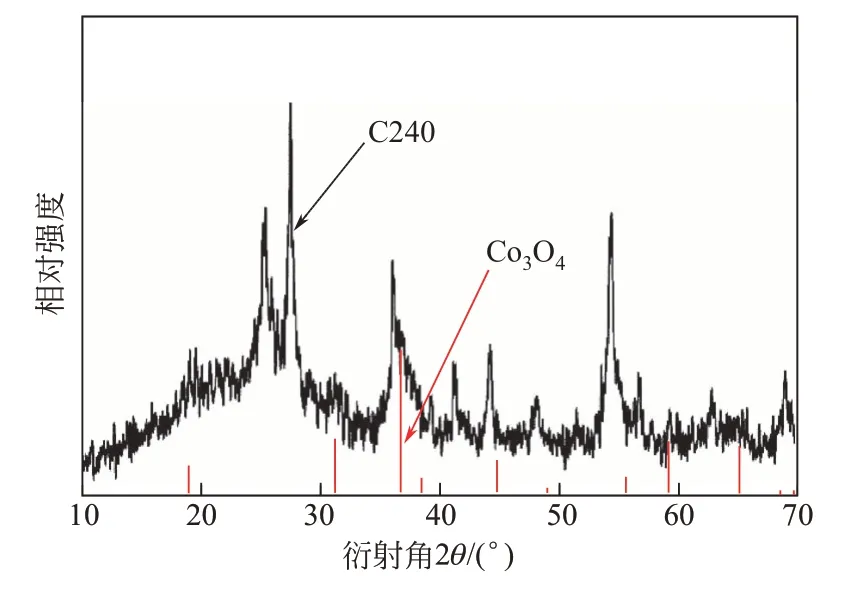
圖2 樣品C240及標準的Co3O4的粉末衍射譜圖
2.2 XPS分析
為了進一步分析樣品中Co的化學狀態,對樣品C240進行了X射線光電子能譜分析。圖3是樣品中Co2p1/2的XPS譜圖。原始的曲線可以被細分為三個峰,分別位于796.05eV、797.35eV以及802.35eV。其中796.05eV及797.35eV的特征峰可以歸屬于Co3O4中Co3+及Co2+,這與先前文獻[18]報道的結果一致。而位于802.35eV處的峰則可以歸屬于Co3O4表面的羥基化物種(如Co—OH)所產生的衛星峰[19]。這也證實了樣品中Co以Co3O4形式存在,并與PXRD測試結果相匹配。
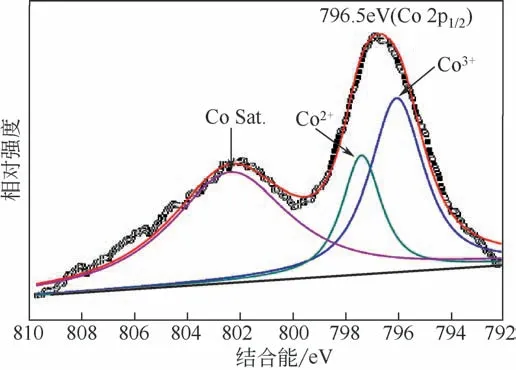
圖3 樣品C240中Co2p1/2的XPS譜圖
2.3 TEM及能譜分析
圖4是樣品C120的TEM照片及EDS能譜圖。圖4(a)所示為Co3O4/TiO2/多孔炭呈現出立方塊狀結構,基本保持了NH2-MIL-125(Ti)的形狀,其顆粒尺寸為200~300nm。圖4(b)為樣品某一邊角的放大圖,從圖中可以清楚看出,TiO2為25nm左右的塊狀顆粒,鑲嵌在多孔炭的內部及表面上,并且分布十分均勻。TiO2顆粒尺寸較NH2-MIL-125(Ti)中Ti-O簇的直徑(約1.3nm)更大,這表明在炭化過程中鈦氧簇發生了團聚[20]。而由于Co3O4顆粒尺寸較小,在圖4(b)中無法分辨出來,因此對樣品表面顆粒拍攝了高分辨TEM照片,如圖4(c)所示。圖4(c)中大塊顆粒為TiO2,在其表面可以觀察到間距為0.325nm的晶格條紋,這對應于金紅石相TiO2的(110)晶面。而Co3O4顆粒[圖4(c)中橢圓圈里]分布在TiO2的顆粒表面,尺寸為3nm左右,在顆粒上可以看到間距為0.285nm的晶格條紋,對應于立方Co3O4的(220)晶面。樣品的EDS能譜如圖4(d)所示,復合材料中含有除了Ti、Co、O以外,還具有C元素,表明了多孔炭的存在。此外,EDS分析結果顯示,樣品中重元素Ti與Co的質量比為7.6,這與理論值7.3十分接近,說明在樣品制備的過程中,所有Co(NO3)2都進入了NH2-MIL-125(Ti)的孔道,并在熱解過程中轉換成了Co3O4,這也與ICP-AES測試結果相吻合。

圖4 C120的TEM照片及EDS能譜
2.4 BET測試
所制備樣品的多孔性能(比表面積、孔徑、孔容等)通過氮氣吸附實驗進行表征。圖5(a)為制備的樣品的氮氣吸、脫附等溫線,樣品的比表面積及孔容信息列于表2。從測試結果來看,不含Co3O4的樣品C0具有最大的表面積及孔容,并隨著樣品中Co3O4含量增加,樣品比表面積都有所降低。其原因可能是Co3O4顆粒在孔洞里生長,其表面積也就降低。而在Co3O4/TiO2/多孔炭樣品中,C120的表面積大于C80,可能是因為前體NH2-MIL-125(Ti)孔道中的Co以水合物及氨基配合物形式存在,在熱解炭化過程中分解出氣體,使孔道擴張,這與先前文獻報道的Co9S8@CNST相類似[21]。這種現象與樣品中Co含量有關,因而C120及C160的比表面積較C80更大。而相比于C120,在C160及C200樣品中,由于Co3O4含量逐漸增加,致使孔道堵塞的可能性增大,因而比表面積及孔容逐漸下降。圖5(b)為各樣品的孔徑分布圖,從圖中可以看出樣品的孔徑主要分布在介孔范圍(3~5nm),這與各樣品的氮氣吸、脫附等溫線在p/p0為0.5~1區間內出現的脫附遲滯現象相吻合(脫附遲滯回線的出現通常表明材料內存在介孔結構)。其中材料C0孔徑最大,C120次之,而其余樣品孔徑較小,這也與樣品的比表面積以及孔容大小變化趨勢相一致。
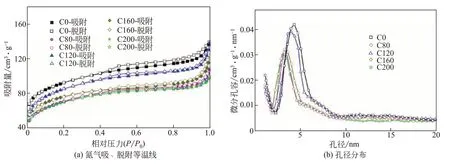
圖5 樣品的BET測試結果

表2 不同樣品的比表面積及孔容
2.5 吸附性能分析
圖6顯示了Co3O4含量不同的樣品在遮光條件下對甲基橙的吸附動力學曲線。從圖6可以看出,幾個樣品在8min左右就達到了吸附平衡,表明樣品對甲基橙具有很快的吸附速率。為了綜合對比幾個樣品對甲基橙的吸附能力,將其平衡位置(30min時)的吸附量以柱狀圖形式展示在圖7中。其中吸附量計算方法如式(1)所示。
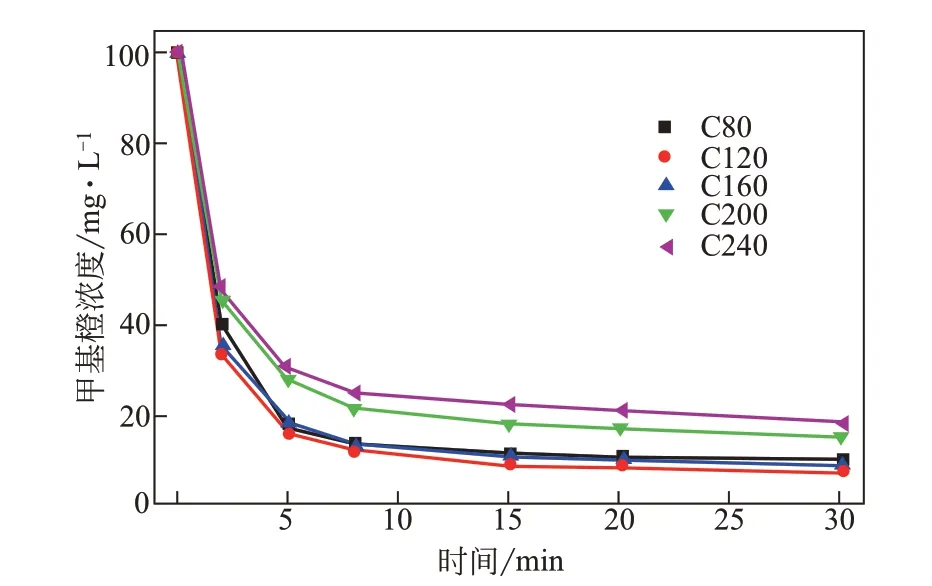
圖6 樣品對甲基橙的吸附動力學曲線
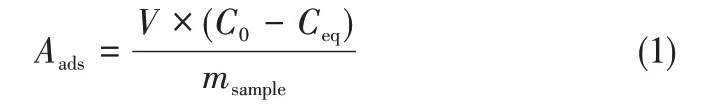
式中,Aads為平衡時樣品對甲基橙的吸附量,mg/gsample;V為溶液體積,L;C0為初始甲基橙濃度,mg/L;Ceq為平衡時溶液中甲基橙濃度,mg/L;msample為加入的樣品質量,g。
如圖7所示,樣品對甲基橙的吸附性能隨著樣品中Co3O4含量先增加后降低,C120具有最高的吸附能力,該趨勢與樣品的比表面積隨Co3O4含量變化趨勢一致,表明樣品的吸附能力與材料的多孔結構密切相關。樣品對甲基橙的吸附動力學行為可以用準二級動力學方程式(2)來描述[22]。
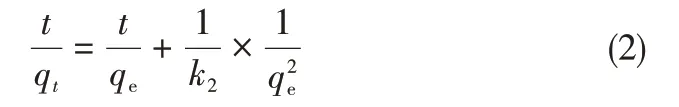
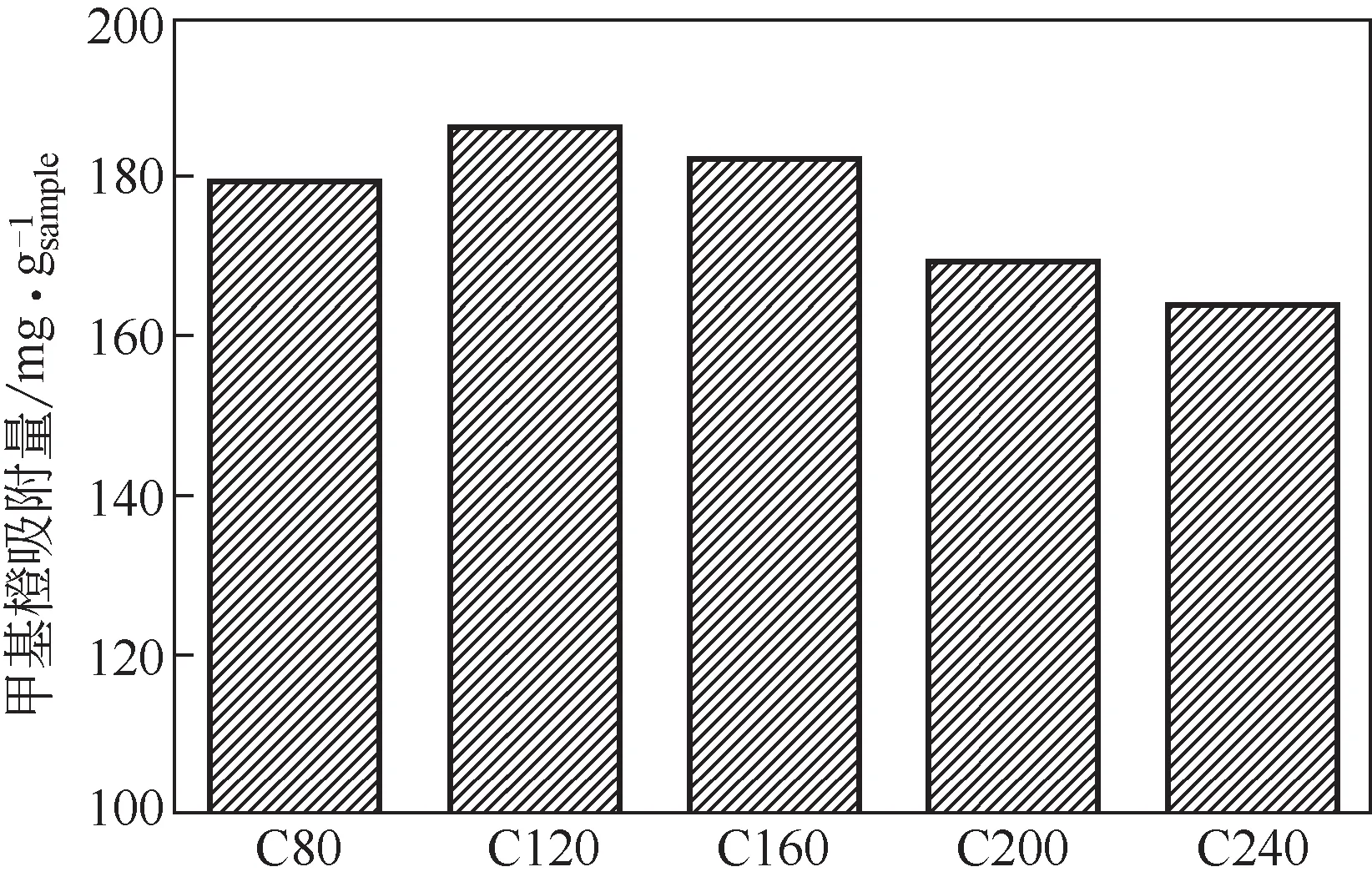
圖7 樣品對甲基橙的平衡吸附量
式中,t為吸附時間,min;qt為t時刻甲基橙被吸附的量,mg/gsample;qe為平衡時甲基橙的吸附量,mg/gsample;k2為準二級吸附速率常數,gsample/(mg·min)。
擬合的準二級動力學常數列于表3。各樣品對甲基橙吸附數據所擬合的準二級動力學方程都具有極高的相關系數(R2>99%),表明樣品對甲基橙的吸附遵循著準二級動力學模型。不同樣品中C120具有最高的甲基橙平衡吸附量,達到273.22mg/gsample。本文對比了近年來報道的其他磁性吸附劑對甲基橙的吸附能力(表4),C120的平衡吸附量優于大多數已報道的磁性吸附材料[23-32]。此外,目前對磁性吸附材料的研究往往只聚焦于對有機污染物的吸附性能,而對吸附的有機污染物的進一步處理則少有報道。而Co3O4/TiO2/多孔炭復合材料不僅具有出眾的吸附性能,還具備較強的光催化能力,能進一步將有機污染物進行降解。

表3 Co3O4/TiO2/多孔炭對甲基橙吸附的準二級動力學常數
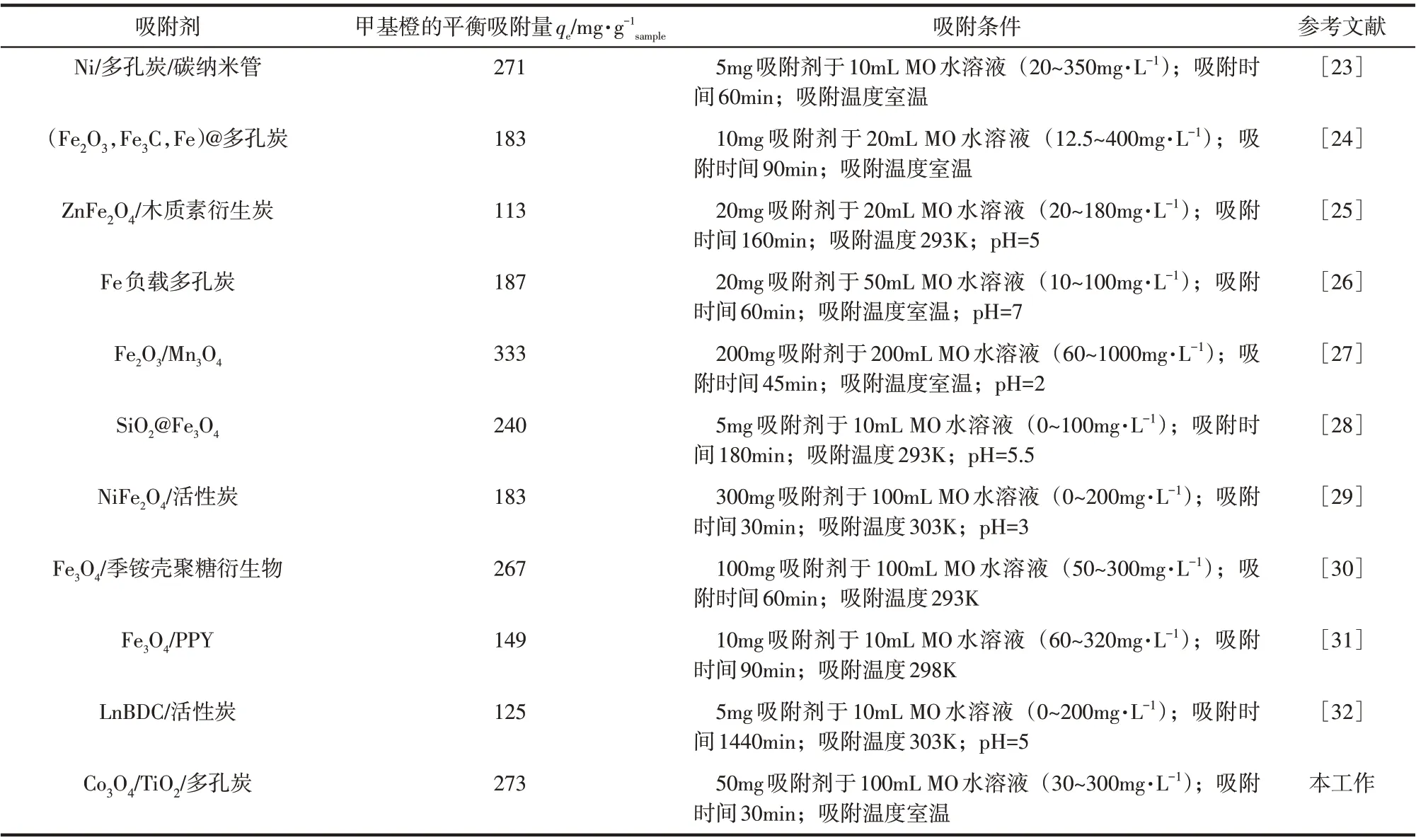
表4 不同磁性吸附劑對甲基橙的吸附能力
為了進一步研究Co3O4/TiO2/多孔炭復合材料對甲基橙的吸附能力,本工作研究了樣品C120在25℃、不同甲基橙初始濃度(分別為30mg/L、60mg/L、100mg/L、150mg/L、200mg/L、300mg/L)下的等溫吸附實驗。圖8為樣品C120對甲基橙的吸附等溫線。從吸附等溫線上可以看出,C120對甲基橙的平衡吸附量(qe)隨著初始濃度升高而快速上升,直到達到最高值,隨后繼續升高甲基橙初始濃度,并不能繼續增加樣品對甲基橙的吸附量,說明此時甲基橙在樣品表面上的吸附已經達到了飽和。為了更深入地了解樣品對甲基橙的吸附行為,采用Langmuir等溫方程式(3)對吸附數據進行擬合[24]。
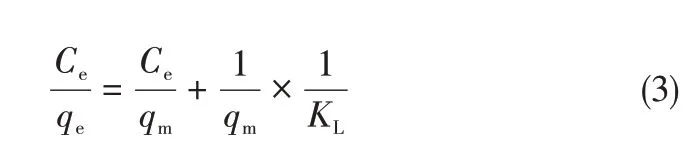
式中,Ce為吸附平衡時溶液中甲基橙濃度,mg/L;qe為平衡時甲基橙的吸附量,mg/gsample;qm為樣品對甲基橙的最大吸附量,mg/gsample;KL為Langmuir常數,L/mg。
Langmuir等溫曲線擬合結果(圖8中插圖)與實驗數據相匹配(R2>0.990),表明甲基橙在樣品表面的吸附機理可以用Langmuir吸附模型進行解釋,即均質單層吸附。其吸附可能是通過復合材料中石墨化的碳與甲基橙芳香環之間的π-π作用實現的[33]。
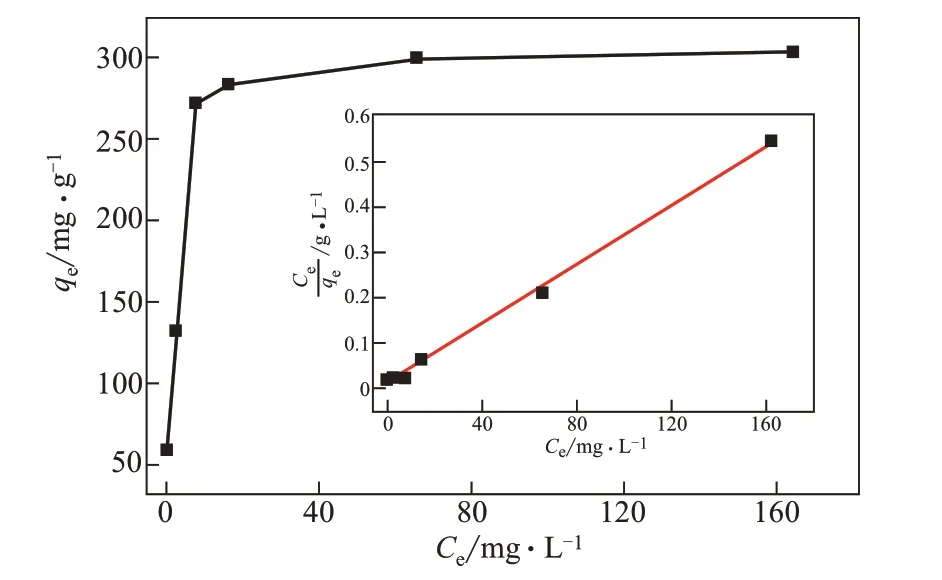
圖8 樣品C120對甲基橙的等溫吸附曲線
2.6 光催化性能分析
本研究中通過Co3O4/TiO2/多孔炭對甲基橙的光催化降解實驗,衡量樣品對有機污染物的分解能力。在經過30min的暗反應達到吸附平衡后,將樣品在紫外燈下照射,并在60min后通過紫外可見分光光度計測試甲基橙溶液的最大吸收波長465nm處的吸光度,并通過式(4)計算樣品對甲基橙的降解率。
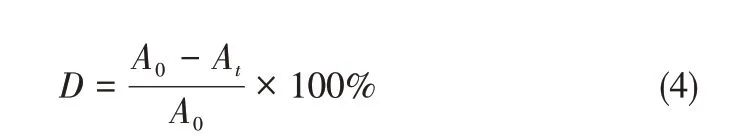
式中,D為反應結束時樣品對甲基橙的降解率,%;A0為暗反應后溶液中甲基橙的吸光度;At為反應結束時溶液中甲基橙的吸光度。
表5列舉了不同樣品對甲基橙的光降解效果。從表中看出,不同樣品對甲基橙都具有明顯的降解能力,并且差異較小,主要原因可能在于催化效果主要來自于TiO2,而不同樣品中TiO2含量、顆粒尺寸差異不大。而C200及C240樣品光催化效果稍低于其他幾個樣品,其原因可能在于C200及C240中Co3O4對樣品孔結構的堵塞程度加大而導致比表面積降低。由于復合材料體系中立方Co3O4(禁帶寬度約2.2eV)與金紅石-銳鈦礦混合相TiO2(禁帶寬度約3.2eV)在紫外光下就具備光激發活性[34-35],所以為了驗證樣品的光催化活性位點,也在可見光照射下檢驗樣品對甲基橙的光降解能力。但是很遺憾地發現,全部樣品都僅表現出了微不足道的光降解能力(降解率<5%)。這可能是由于復合材料中Co3O4的含量太低而導致其對復合材料光催化性能貢獻很低。因此,在該復合材料的光催化活性中心可能位于TiO2上。此外,相比于文獻報道的其他光催化材料[35],樣品對甲基橙的降解效率并不出眾,可能是因為在本實驗中樣品對甲基橙具有很強的吸附能力,而光催化實驗結果只能反映溶液中甲基橙含量的變化,而被吸附在樣品孔道中的甲基橙的降解情況則無法體現。為了檢驗被吸附的甲基橙是否被降解,本工作將C120樣品催化結束后,分離后重新分散在蒸餾水中,超聲處理60min后浸泡一天。經過一天的浸泡,蒸餾水依然為無色,表明樣品所吸附的甲基橙基本已被完全分解(圖10中溶液C)。相應的光催化機理類似于其他TiO2基光催化材料[36],可以解釋為:材料受光照射后產生光生電子-空穴,光生電子與溶液中的溶解氧以及水反應生成羥基自由基(OH·),同時光生空穴也與水反應生成羥基自由基(OH·)。進而強氧化性的光生自由基(OH·)與吸附在樣品表面的甲基橙反應,將其氧化降解。

表5 不同樣品對MO的降解效果
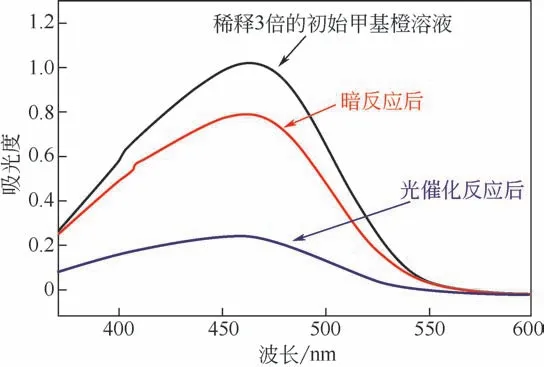
圖9 C120進行光催化反應前后甲基橙溶液的紫外-可見吸收光譜

圖10 三種溶液的照片
2.7 樣品回收及再利用
由于Co3O4具有較強的磁性,近年來基于納米Co3O4的復合材料在磁性材料方面的應用多有報道[37]。本工作中在復合體系中引入Co3O4的目的也在于利用Co3O4在外磁場作用下可以從水相中分離與收集的特性,使工作樣品回收。圖11是分散在水中的C120被磁鐵回收的效果圖,結果表明樣品具有較好的可回收性。

圖11 通過外磁場將樣品從水中分離
此外,本工作也對樣品的可重復利用性進行了研究,選取了吸附與光催化效果都較為出眾的C120為研究對象。將50mg樣品分散在100mL濃度為100mg/L的甲基橙(MO)水溶液中進行吸附實驗,在30min后測試樣品對甲基橙的吸附量,隨后將樣品分離出來并浸泡于100mL蒸餾水中,并用紫外燈照射60min,進行污染物降解。然后將樣品真空干燥,并進行第二輪吸附實驗。進行了三組循環實驗,每組實驗中C120對甲基橙的吸附量對比如圖12(a)所示,分別為186.04mg/gsample、180.33mg/gsample及176.87mg/gsample,說明樣品具有很好的穩定性以及可重復使用性。
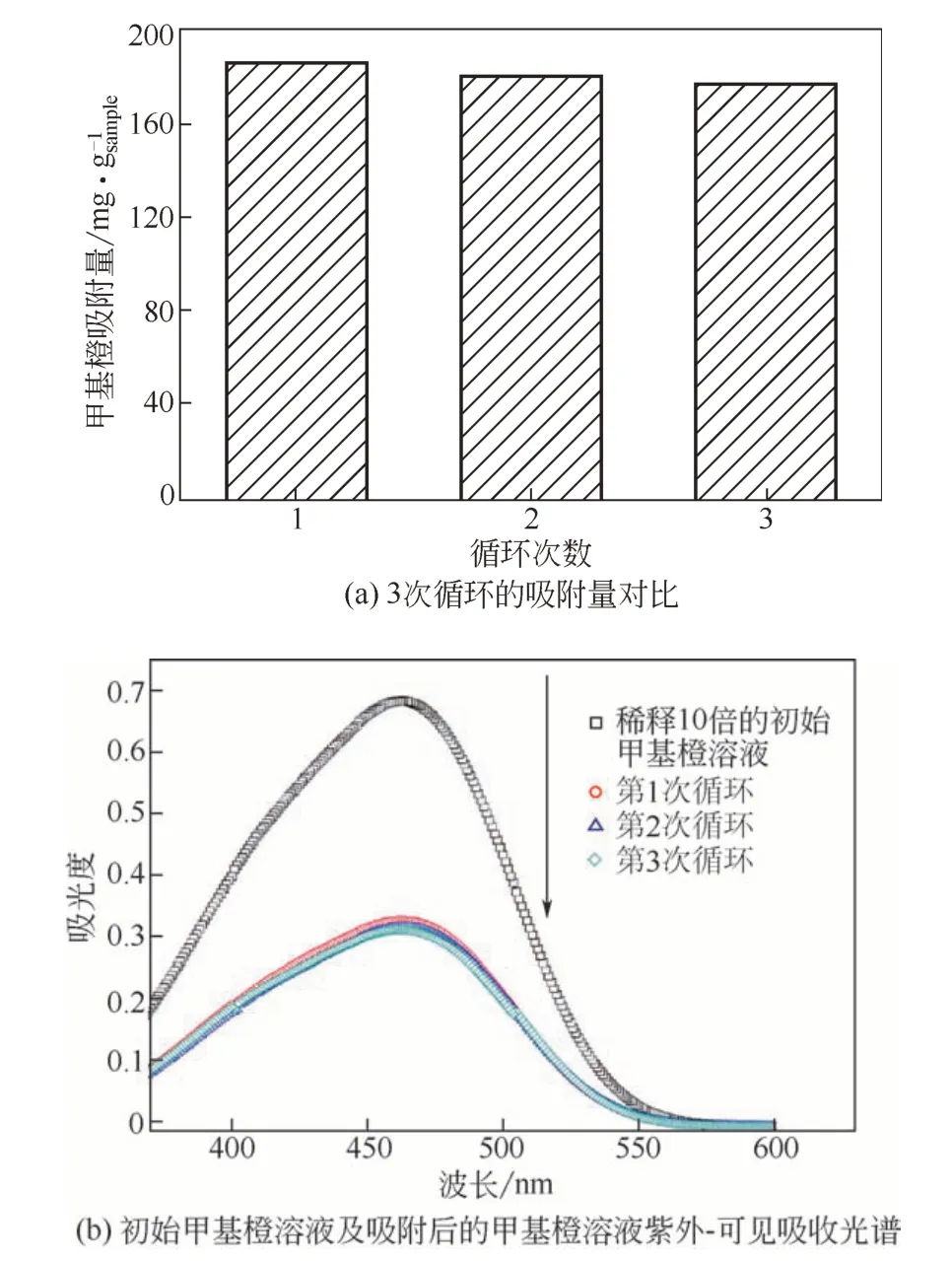
圖12 樣品C120的循環實驗結果
3 結論
(1)以金屬有機框架材料NH2-MIL-125(Ti)為前體,通過硝酸鈷的吸附、炭化等步驟制備了Co3O4/TiO2/多孔炭復合材料。
(2)PXRD、XPS測試表明,復合材料由金紅石及銳鈦礦相TiO2、立方Co3O4以及多孔炭組成。
(3)TEM分析表明復合材料具有立方塊狀結構,TiO2內嵌在多孔炭中,而Co3O4則沉積在TiO2表面。通過對比實驗發現,隨著復合材料中Co3O4含量增加,復合材料的比表面積呈現先升高后降低的趨勢,C120樣品具有最大的比表面積及孔容。
(4)吸附實驗表明復合材料能夠快速吸附水中甲基橙,并具有較高的吸附量,其中C120的平衡吸附量達到273.22mg/gsample。同時復合材料還具備很強的光降解能力、易回收特性以及出色的可循環利用能力。

