金屬有機骨架NH2-MIL-101(Fe)對酸性橙 吸附性能的研究
林曉宇,崔龍哲,吳桂萍*
(1. 中南民族大學 資源與環境學院,湖北 武漢 430074;2. Division of Semiconductor and Chemical Engineering, Jeonbuk National University, Jeonju Jeonbuk 561-756, Republic of Korea)
我國每年染料使用量居世界首位,印刷、紡織、印染等行業產生大量的染料廢水,其高色度、高CODcr、三致性(致癌、致畸、致突變)的特點,對生態環境造成嚴重危害[1]。目前,常用的處理方法有吸附法、化學氧化法[2]、催化法[3]和生物法等,其中以吸附法最為簡單、安全、高效。目前常用的吸附劑主要有活性炭、硅藻土、農業廢棄物等,但其吸附效果較差[4-6]。
金屬有機骨架(MOFs),是金屬離子通過配位鍵與有機配體上的配體官能團相互作用形成的一種無限結構的配合物,具有孔隙率較高、品種較多、比表面積較大、結構性能優良等優點[7,8]。近年來,金屬有機骨架在藥物運輸[9]、氣體儲存[7,10]、載體、催化[11]以及吸附[12,13]等領域都有較為廣泛的應用。MIL-101型金屬有機骨架是以鐵、鋁或鉻與對苯二甲酸通過配位作用形成一種具有八面體結構的柔性材料。作為一種新型的吸附材料,被廣泛的應用于氣體分離與富集以及水中污染物的吸附。金屬有機骨架NH2-MIL-101 (Fe)結合了MIL-101材料與氨基的優點,使得功能化的金屬有機骨架具有更加良好的吸附性能。近年來, NH2-MIL-101 (Fe)作為一種新穎的吸附材料被廣泛應用于水中抗生素,酚等有機污染物的去除[14,15]。然而,NH2-MIL-101 (Fe)對水溶液中染料的吸附少有研究。
1 實驗部分
1.1 試劑
N,N-二甲基甲酰胺DMF(AR)、六水三氯化鐵(AR)、2-氨基對苯二甲酸(AR)、無水乙醇(AR)、酸性橙(AR)、氫氧化鈉(AR)、鹽酸(AR)。
1.2 材料制備
稱取1.0483g 2-氨基對苯二甲酸和3.1534 gFeCl3·6H2O超聲溶于70mlDMF中,轉移至反應釜中,于383.15K下反應24h。將得到的深褐色固體用DMF和無水乙醇交替洗滌多次至中性,抽濾,將所得固體于333.15K下真空干燥、研磨,得到深褐色產品,即為NH2-MIL-101(Fe)。
1.3 吸附實驗
1.3.1 溶液pH對吸附性能的影響
移取50mL濃度為100 mg·L-1的酸性橙溶液至100mL錐形瓶中,用HCl或者NaOH溶液調節酸性橙溶液pH為1-8。隨后稱取0.01g的NH2-MIL-101(Fe)加入酸性橙溶液中震蕩攪拌8h。吸附結束后,抽取部分溶液過膜(0.45um),通過可見分光光度計(721E,上海光譜儀器有限公司)測定溶液中酸性橙濃度。根據式(1)計算NH2-MIL-101(Fe)對酸性橙的吸附量。

式中:q為吸附量,mg·g-1;C0為初始濃度,mg·L-1;Ct為 t時刻溶液濃度,mg·L-1;V為溶液的體積,mL;m 為NH2-MIL-101(Fe)的質量,g。
1.3.2 吸附動力學研究
移取500mL濃度為100 mg·L-1的酸性橙溶液至1000mL燒杯中并調節溶液pH=6。稱取0.1g NH2-MIL-101(Fe)加入酸性橙溶液中磁力攪拌。在設定時間下抽取部分溶液過濾后測定溶液中酸性橙的殘留濃度。
1.3.3 等溫吸附研究
移取50mL濃度分別為50-1000 mg·L-1的酸性橙溶液至100mL錐形瓶中并調節溶液pH=6。稱取0.01g NH2-MIL-101(Fe)加入酸性橙溶液中震蕩攪拌8h。吸附結束后,抽取部分溶液過膜并測定溶液中酸性橙的濃度。
1.3.4 吸附熱力學研究
稱取0.01g NH2-MIL-101(Fe)投加入50mL初始濃度為100 mg·L-1,pH=6的酸性橙溶液中。分別將溶液至于 293.15,303.15,313.15,323.15以及333.15 K 條 件 下 吸附 8h后取樣過膜,測定溶液中酸性橙濃度。
2 結果與討論
2.1 NH2-MIL-101(Fe)性能表征
2.1.1 XRD分析
用X-射線衍射儀(D8 ADVANCE,德國Bruker公司)對所制備的NH2-MIL-101(Fe)進行了晶體結構分析,結果如圖1所示。分析NH2-MIL-101(Fe)的XRD圖譜可知,在2θ=5.103°、8.333°、8.971°、10.205°以及16.377°出現較明顯的吸收峰,與文獻報道的NH2-MIL-101 (Fe)的特征峰基本一致[16,17],表明成功合成得到金屬有機骨架材料NH2-MIL-101 (Fe)。同時NH2-MIL-101(Fe)與MIL-101標準圖譜特征峰位置基本一致,表明NH2-MIL-101(Fe)保留了與MIL-101一樣的晶型結構。

圖1 NH2-MIL-101(Fe)的XRD圖譜
2.1.2 SEM分析
用場發射掃描電子顯微鏡對合成樣品進行SEM分析,分析結果如圖2所示。由圖2(a)可知,合成的樣品為正八面體結構,其尺寸約為637nm。圖2(b)顯示合成的材料形狀尺寸基本一致。

圖2 NH2-MIL-101(Fe)的SEM圖譜:(a)100000倍;(b)50000倍
2.2 溶液pH對吸附的影響
溶液pH是影響吸附過程的重要參數,研究中考察了溶液pH對NH2-MIL-101(Fe)吸附酸性橙的影響,結果如圖3(a)所示。在pH值為1-6范圍內,隨著pH值的增大,吸附量從140.71mg· g-1增加到246.67mg· g-1。從圖3(b)中可知,pH<6時,NH2-MIL-101 (Fe)的Zeta電位大于0,表面帶正電,可以靜電的方式對溶液中帶負電的離子產生吸附,而pH較低時,酸性橙(D-SO3Na)在溶液中以(D-SO3H)形式存在,不利于靜電吸附。隨著溶液pH增大,溶液中磺酸根(D-SO3-)增多,有利于吸附的進行。當pH>6時,NH2-MIL-101(Fe)對酸性橙的吸附量減少,這是因為隨著pH升高,NH2-MIL-101(Fe)表面Zeta電位降低,當pH≥7時,NH2-MIL-101(Fe)表面帶負電,而酸性橙(D-SO3Na)在溶液中以磺酸根(D-SO3-)形式存在,不利于吸附;且溶液中存在大量的OH-與磺酸根(D-SO3-)形成競爭吸附,所以當pH>6時,隨著pH的升高,NH2-MIL-101(Fe)對酸性橙的吸附量呈下降趨勢[18]。

圖3 溶液pH對吸附效果以及 NH2-MIL-101(Fe) Zeta電位的影響
2.3 吸附動力學研究
在pH=6,酸性橙溶液初始濃度C0=100mg·L-1,投加量為0.2g·L-1的條件下,NH2-MIL-101(Fe)對酸性橙的吸附量隨時間變化如圖4所示。由圖4可知,在吸附初始階段,吸附速率較快,50min之后吸附速率逐漸變緩,180min左右基本達到吸附平衡。

圖4 時間對吸附性能的影響
為了進一步研究NH2-MIL-101(Fe)吸附酸性橙的動力學特征。對圖4實驗數據進行準一級動力學(式(2))、準二級動力學(式(3))、液膜擴散理論(式(4))以及顆粒內擴散模型(式(5))線性擬合。擬合結果如圖5(a-d)所示,相關參數如表1、表2所示。

圖5 NH2-MIL-101(Fe)對酸性橙吸附動力學模型

其中qt為t時刻的吸附量,mg·L-1;qe為平衡吸附量,mg·g-1;F為t時刻吸附量與平衡吸附量比值,即qt/qe;k1為準一級動力學速率常數,min-1;k2為準二級動力學速率常數,g·mg-1·min-1。
分析表1中的數據可知,準二級動力學模型的相關系數R2大于準一級動力學,說明NH2-MIL-101(Fe)吸附酸性橙的過程更符合準二級動力學特征。且其擬合得到的平衡吸附量更接近于真實實驗數據[18,19]。液膜理論線性擬合結果如圖5(c)所示,由圖可知擬合直線不通過原點,故而表明液膜擴散并非影響吸附速率的控制因素,且擬合參數t1/2=16.558min,表明NH2-MIL-101(Fe)對酸性橙的吸附速率較快[20]。顆粒內擴散模型擬合結果如圖5(d)所示,相關參數列于表2。從圖5(d)可看到吸附過程大致可以擬合成3段,并且均不通過原點,表明吸附過程的限速因素不止受顆粒內擴散控制,還受膜擴散等其他吸附因素共同控制[21]。表2中,k1>k2>k3,分析原因可能是在吸附初期,速率控制步驟為膜擴散,吸附劑表面活性位點數量較多,酸性橙非常容易被吸附。當吸附劑的外表面逐漸達到飽和后,進入緩慢吸附階段,其吸附速率以顆粒內擴散過程控制為主,最后達到吸附平衡[22,23]。

表1 NH2-MIL-101(Fe)對酸性橙吸附動力學模型相關參數

表2 NH2-MIL-101(Fe)對酸性橙吸附顆粒內擴散相關參數
2.4 等溫吸附研究
不同溫度(293.15K、303.15K、313.15K)下,溶液平衡濃度對吸附量的影響如圖6所示。不同溫度條件下,吸附量均隨著平衡濃度的增大而增大,且在平衡濃度相同的條件下,溫度升高,吸附量下降。
為了更好地了解NH2-MIL-101(Fe)對酸性橙的等溫吸附特性,對圖6中的實驗數據進行Langmuir(式(6))、Freundlich(式(7))、BET(式(8))、TemKin(式(9))模型擬合,擬合結果如圖7(a-d)所示,相關參數如表3所示。
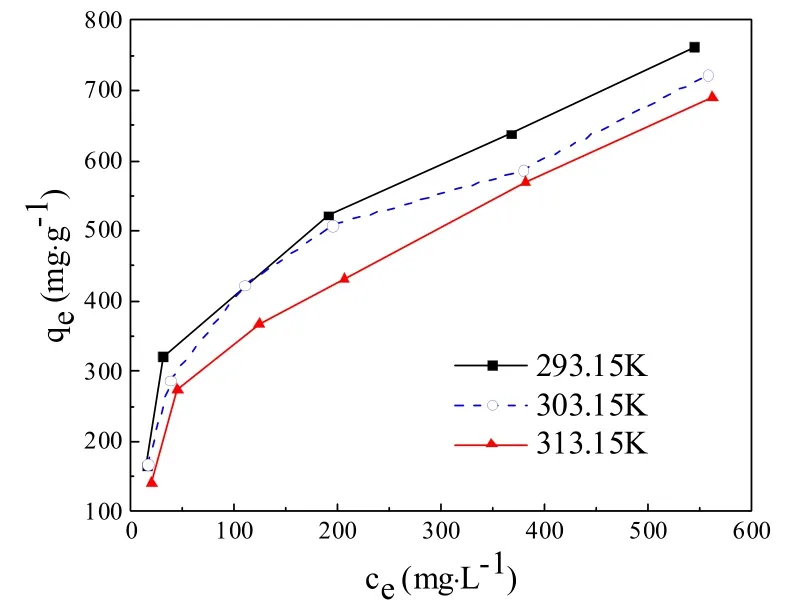
圖6 溶液濃度對吸附效果的影響

圖7 NH2-MIL-101(Fe)對酸性橙吸附等溫模型

其中C0為酸性橙的初始濃度,mg·L-1;Ce為吸附平衡濃度,mg·L-1;qe為吸附達到平衡時的吸附容量,mg·g-1;qm為最大吸附量,mg·g-1;qen為單層鋪滿時的吸附量,mg·g-1。
由表3可知Langmuir模型擬合相關系數大于Freundlich模型,故而NH2-MIL-101(Fe)對酸性橙的等溫吸附模型更加符合Langmuir模型。同時表明NH2-MIL-101(Fe)表面的活性位點的均勻分布,且吸附為單層吸附[23,24]。根據Langmuir模型擬合結果, NH2-MIL-101(Fe)在293.15k、303.15k、313.15k溫度下對酸性橙的最大吸附量分別為818.67mg·g-1、787.25 mg·g-1、781.40 mg·g-1。BET模型主要適合于多層吸附,吸附劑與吸附劑之間的作用力主要為范德華力。若吸附符合BET模型,則認為屬于物理吸附。TemKin模型適用于吸附熱隨著覆蓋度的增加而減小的吸附模型,若等溫吸附符合TemKin模型,則認為吸附以化學吸附為主。 由表3可知,相比較BET模型而言,NH2-MIL-101(Fe)對酸性橙的吸附更加符合TemKin 模型,故而表明吸附主要以化學吸附為主。

表3 NH2-MIL-101(Fe)對酸性橙吸附等溫模型相關參數
2.5 吸附熱力學研究
溫度對NH2-MIL-101(Fe)吸附酸性橙的影響可以從熱力學參數,例如吉布斯自由能(ΔG)焓變(ΔH)、熵變(ΔS)反映出來。相關參數可以通過公式(10)、(11)、(12)以及圖8(b)擬合計算得到。

式中:Kc代表平衡常數;qe為吸附達到平衡時的吸附容量,mg·g-1;Ce為溶液平衡濃度,mg·L-1;ΔG為吉布斯自由能;ΔH為焓變;ΔS為熵變; R為氣體常數,8.314 J·mol-1·K-1。
溶液溫度對吸附量的影響如圖8(a)所示,由圖8(a)可知,NH2-MIL-101(Fe)對酸性橙的吸附量隨著溫度的升高而減小。熱力學相關參數如表4所示。由表4的數據可知:ΔG<0,表明酸性橙被NH2-MIL-101(Fe)吸附是自發進行;ΔS=-59.44 (J·mol-1·K-1),表明在吸附過程中,體系熵值減少,即NH2-MIL-101(Fe)吸附酸性橙的過程中整個水溶液體系的混亂度減少[20];ΔH=-23.19(kJ·mol-1),即吸附過程為放熱過程,升高溫度使得吸附平衡向解吸方向移動,不利于吸附,與實驗結果相符合[25]。其可能是因 為在吸附過程中,NH2-MIL-101(Fe)上的Fe與酸性橙上的氧、氮等元素在吸附過程中形成穩定的化學鍵或者配位鍵,使得吸附過程為放熱反應。以上結果同時表明,NH2-MIL-101(Fe)對溶液中酸性橙的吸附之所以可以自發進行的推動力為吸附體系能量的降低。

圖8 吸附熱力學:(a)溶液溫度對吸附效果的影響;(b)熱力學擬合

表4 NH2-MIL-101(Fe)對酸性橙吸附熱力學參數
3 結論
采用水熱法合成金屬有機骨架材料NH2-MIL-101(Fe),用其吸附溶液中酸性橙得到主要結論如下:
(1)溶液pH對吸附有較明顯的影響,pH =6條件下,NH2-MIL-101(Fe)對酸性橙溶液的吸附效果最佳;
(2)NH2-MIL-101(Fe)對酸性橙的吸附速率較快,180min基本達到吸附平衡.吸附過程符合準二級動力學,且吸附過程中,顆粒內核擴散不是控制吸附的唯一控制因素;
(3)NH2-MIL-101(Fe)對酸性橙的等溫吸附數據與Langmuir和TemKin模型擬合良好,吸附以單層化學吸附為主,最大吸附量為818.67 mg·g-1;
(4)吸附過程中,體系ΔG、ΔS、ΔH均小于0,此吸附反應為自發放熱反應,且體系的混亂度減少。

