超聲波植冰對L-02肝細胞低溫保存的影響
李維杰 宋立勇 劉寶林 宗 果
(1 上海理工大學生物系統熱科學研究所 上海 200093;2 上海明悅醫療科技有限公司 上海 200120)
細胞低溫保存是用于現代再生醫學、器官移植和輔助生殖的一項關鍵技術,細胞治療是目前公認對抗癌癥等疑難雜癥的有效手段,受到各方的廣泛關注。細胞的冷凍保存一般是將細胞冷凍至較低的溫度(通常為-196 ℃),細胞在低溫下無生命活動,因此能夠長期保存,但在冷卻過程中可能會發生嚴重的細胞損傷。為了減輕冷凍損傷,現在普遍采用的細胞冷凍方案是在細胞溶液中加入一定濃度的低溫保護劑,采用慢速冷凍或玻璃化的方法進行冷凍。對于慢速冷凍,降溫速率會對細胞的存活率和繼續發育造成巨大的影響。根據兩因素假說理論,認為細胞低溫損傷主要是胞內冰損傷[1]和溶液損傷[2-3],冷卻速率過快,導致胞內冰晶產生,冷卻速率越快,該損傷越大;冷卻速率過慢,導致細胞長期暴露于高濃度溶液中造成溶液損傷,冷卻速率越慢,損傷越大。在降溫速率主導的兩種損傷因素共同作用下,細胞低溫保存必然存在一個最佳的降溫速率,使得在該速率下既能夠減少胞內冰晶的產生,又能避免溶液損傷。但在實際降溫過程中,細胞溶液會出現過冷現象[4-5],較大的過冷度會使細胞溶液因釋放潛熱而溫度上升,導致細胞的降溫速率遠高于最佳的降溫速率,較高的降溫速率會引起細胞不可控的結晶,細胞突然結冰,脫水不充分,胞內冰大量生長,導致細胞大量死亡。
降低過冷度是提高低溫保存效果的關鍵。目前降低過冷度主要通過植冰操作完成,植冰是指通過人為操作使細胞溶液在較高的零下溫度提前結冰的過程,該過程可以避免較大過冷度下的胞內冰損傷[6]。傳統的植冰方法主要是用預冷探針(如金屬棒或手術鉗)來接觸容器的側面,從而提供局部過冷誘發成核[7-9],也可以在細胞溶液中添加冰核細菌誘發凍結[10-12],還可以通過電極誘導[13-15],搖晃、振動、超聲[16-18]等機械能,或改變降溫速率[19]、壓力[20]等方式誘導成核。目前關于超聲波誘導冰晶生成的研究,僅限于食品材料的凍結,例如,用于冰淇淋制造,珍貴食品、藥物、疫苗的冷凍濃縮和冷凍干燥等[21-23],但在細胞低溫保存領域,鮮有文獻報道。
關于超聲波影響結晶的作用機理尚不明確,針對超聲成核有三種理論模型,第一種理論模型,R.Hickling[24]認為在空化氣泡破裂的最后階段會發生大于1 000 MPa正壓力波,由于較高的壓力下空化氣泡附近的液體短暫進入亞穩態的過冷狀態,從而增加水的平衡凍結溫度并導致冰成核;第二種理論模型,J.D.Hunt等[25]認為空化氣泡破裂的負壓會增加水的平衡凍結溫度并導致成核;第三種理論模型,R.Chow等[26]認為當空化氣泡產生劇烈的循環運動,氣體進出氣泡以及周圍的流體中形成強渦流時均會形成微流,微流可以增強伴隨冷凍過程的傳熱和傳質過程,溶液達到一定過冷度,可能會觸發成核。三種理論模型中,空化氣泡在冰的成核中起著重要的作用。
本實驗選取人肝細胞為研究對象,利用自行設計的超聲波植冰裝置研究超聲波誘導成核對肝細胞低溫保存的影響,同時探索超聲波成核的相關機理。
1 材料和方法
1.1 實驗裝置
本文超聲波植冰裝置如圖1所示,由4個部分組成。1)超聲容器:多個細胞凍存管和對照凍存管可盛放于樣本槽管中,樣本槽管安置在超聲內盒體中。2)溫度檢測系統:由第一熱電偶電極、第二熱電偶電極和溫度數據采集模塊組成,第一熱電偶電極放在對照凍存管內,用于實時檢測細胞溶液的溫度,第二熱電偶電極放在超聲內盒體的相變液溶液中,用于實時檢測控溫相變液的溫度。3)超聲波誘導成核系統:由超聲波振子和超聲波發生器組成,其中超聲波振子均勻的粘結在樣本槽管的底部,超聲波從樣本槽管底部向上傳播至凍存管中,超聲波頻率為40 kHz,超聲波強度由低到高分別為0.032 9、0.104 1、0.208 8、0.331 2、0.392 5、0.431 6、0.460 7、0.502 6 W/cm2。4)冷卻循環系統:配制體積分數為38.5%的乙二醇控溫相變液,該溶液可降溫至-20 ℃不結冰,超聲內盒體和低溫恒溫槽中加載配制好的控溫相變液,超聲容器內冷凍液與低溫恒溫槽內冷凍液組成一個閉合循環回路,低溫恒溫槽自帶制冷循環系統,超聲容器內的溫度分布均勻。
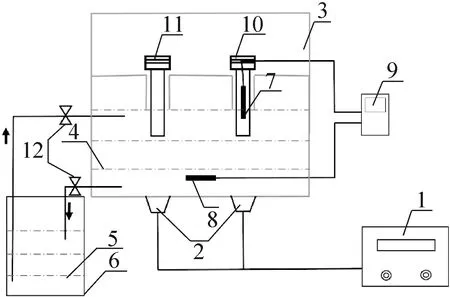
1超聲波發生器;2超聲波振子;3超聲內盒體;4、5 控溫相變液;6低溫恒溫槽;7第一熱電偶;8第二熱電偶;9溫度數據采集模塊;10對照凍存管;11細胞凍存管;12流量控制閥。圖1 超聲波冷凍植冰系統Fig.1 The ultrasonic ice seeding system
1.2 材料和試劑
實驗所用主要材料和試劑:L-02原代肝細胞(購于上海富衡生物科技有限公司),胎牛血清(Gemini公司),培養基RPMI-1640(Gibco公司),胰蛋白酶(TBD公司),二甲基亞砜Me2SO(阿拉丁公司),PBS緩沖液(TBD公司),乙二醇(麥克林),T-25培養瓶(NEST耐思),50 mL離心管(NEST耐思),15 mL離心管(NEST耐思),1.5 mL離心管無菌(Axygen公司),2 mL凍存管(NEST耐思),AO/PI雙染試劑盒(BestBio)。
1.3 儀器和設備
本文所用儀器設備:光學顯微鏡(日本尼康公司),熒光顯微鏡(日本尼康公司),低速臺式離心機(上海安亭),CO2細胞培養箱(上海博訊公司),程序降溫盒(賽默飛世爾生物化學制品有限公司),超低溫冰箱(青島海爾特種電器有限公司),低溫恒溫槽(寧波天恒儀器廠),智能多路溫度測試儀(常州安柏精密儀器有限公司),差示掃描量熱儀(德國耐馳公司)。
1.4 細胞培養
在補充有體積分數為10%胎牛血清的1640培養基中培養L-02肝細胞。將它們放在37 ℃,體積分數為5% CO2的培養箱中進行培養。實驗時,先觀察培養瓶中的數量,待細胞長滿底壁時,輕輕吸棄培養瓶里的上清液,向長滿底壁的L-02細胞培養瓶中加入1 mL PBS緩沖液,輕柔洗滌兩次后吸棄PBS,加入800 μL胰蛋白酶,將培養瓶置入培養箱中進行消化3 min,待光學顯微鏡下觀察到細胞形態已成圓狀,輕輕拍打培養瓶的側面,細胞能夠完全脫離壁面,加入2 mL完全培養基終止消化。利用1 mL的移液槍吸取培養液對培養瓶底壁進行輕柔均勻的反復吹打,確保細胞脫離底壁已全部進入溶液中,將細胞從培養瓶中取出,以1 000 r/min的轉速離心4 min,然后重懸于培養基中備用。
1.5 保護劑結晶溫度測量
使用差式掃描量熱儀(DSC)測量體積分數分別為0%、3%、5%的Me2SO保護劑的結晶溫度。將DSC程序設定為:30 ℃等溫1 min,以30 ℃/min速率降溫至-80 ℃,平衡1 min,再以10 ℃/min速率升溫至30 ℃。參比側放置一個空白坩堝,每組保護劑實驗重復三次。采用DSC分析軟件PYRIS Manager分析相變溫度。
1.6 肝細胞的冷凍保存
肝細胞凍存方法包括兩種,分別采用超聲波植冰凍存和程序降溫慢速凍存,每組設置3個平行組。超聲波植冰凍存的方法如下:提前準備載冷劑,該液體為體積分數38.5%的乙二醇,溫度最低可降至-20 ℃。將含有不同體積分數(3%、5%、10%)的Me2SO細胞溶液重懸后,各取500 μL分裝到3個2 mL的凍存管中,每個凍存管肝細胞懸液體積為500 μL,另取凍存管作為對照凍存管,并添加等量不含肝細胞的保護劑溶液,將對照凍存管和3個細胞凍存管同時放置在超聲波植冰裝置的樣本槽中。植冰時,首先將搭載好的超聲容器與低溫恒溫槽連接,將配制好的體積分數為38.5%的乙二醇載冷劑注入超聲內盒體和低溫恒溫槽中,開啟低溫恒槽的制冷循環系統,待第二熱電偶檢測到超聲容器內控溫相變液溫度達到指定需要的溫度并保持恒溫狀態,通過第一熱電偶實時監測凍存管溫度,當凍存管溫度達到指定植冰溫度時,啟動超聲波發生器電源,超聲波啟動,植冰結束后關閉超聲波,細胞凍存管在控溫相變液中平衡5 min使冰晶生長完全,平衡結束之后蓋上降溫盒的蓋子,將降溫盒轉移至-80 ℃冰箱進行低溫保存過夜,第二天再將凍存管轉移至液氮凍存24 h。程序降溫慢速冷凍組方法是將含有體積分數分別為3%、5%、10% 的Me2SO的細胞重懸后,等份分裝到3個2 mL的凍存管中,每支含有500 μL肝細胞懸液的凍存管直接裝入程序降溫盒置于-80 ℃的冰箱過夜,第二天轉移至液氮深低溫保存。
1.7 肝細胞的復蘇
低溫保存24 h后,將凍存管從液氮中取出,放入37 ℃水浴鍋中搖晃振蕩2~3 min進行細胞復蘇。最后,將凍存管中細胞溶液轉移至15 mL離心管中,以1 000 r/min離心4 min,去除上清液,再加入PBS緩沖液清洗一遍,以1 000 r/min轉速離心4 min,加入完全培養基重懸,以進一步檢查細胞存活率。
1.8 肝細胞計數和存活率測定
細胞離心后用培養基重懸1 mL,吸取10 μL的細胞重懸液到血球計數板一側凹槽內,加蓋蓋玻片后在光學顯微鏡下進行細胞計數,計數方法如式(1)所示,計數要求按照:計上不計下,計左不計右的原則,細胞濃度為1×105~1×106個/mL。由于AOPI染料比臺盼藍染料精確度更高,本實驗采取AOPI染料檢測細胞的存活率。為評估冷凍保存后細胞的存活率,將離心后細胞用培養基稀釋成細胞懸液,用15 μL移液槍吸取15 μL細胞懸液至1.5 mL離心管中,避光加入15 μL AOPI染液。AOPI染液的配制方法:取100 μL試劑C用900 μL的PBS緩沖液稀釋,充分混勻后,加入10 μL的AO染色液和20 μL的PI染色液。當避光加入體積比為1∶1的AOPI染色液后,輕輕混勻在4 ℃避光孵育10~20 min,孵育完成后吸取15 μL細胞染色液在載玻片的中央,蓋上蓋玻片在熒光顯微鏡下進行觀察,熒光顯微鏡激發光源波長為488 nm,接受光波長為520 nm。明場里找到細胞后,再打開熒光在暗室里觀察,最后利用Image Pro Plus 6.0軟件進行計數。細胞存活率如式(2)所示。
(1)
式中:β為細胞濃度,個/mL;a為4個大方格總數;b為稀釋倍數。
(2)
式中:γ為細胞存活率;m為活細胞數;n為死細胞數。
1.9 統計分析
獲得的熒光圖片采用Image Pro Plus 6.0軟件進行分析。數據采用IBM SPSS Statistics 22.0軟件處理。每個樣本重復3次,數據以平均數±標準差(SD)表示,以p<0.05作為差異顯著評判標準,有統計學意義。
2 結果與討論
2.1 植冰溫度上閾的確立
利用DSC分析軟件Pyris Manager計算出不同體積分數Me2SO溶液的熔融溫度,結果如圖2所示,此處每組僅展示不同體積分數Me2SO中的一次熔融溫度曲線,其中體積分數為0%、3%、5%的Me2SO熔融溫度分別為(-3.77±0.2)℃、(-5.84±0.49)℃、(-7.37±0.81)℃。當溶液溫度高于熔融溫度,溶液不會結冰,只有當溶液溫度低于熔融溫度時,溶液才有結冰的可能。根據相變溫度,可以確定超聲波植冰的溫度范圍。體積分數為0%、3%、5%的Me2SO溶液植冰溫度上閾分別為-4、-6、-7 ℃。
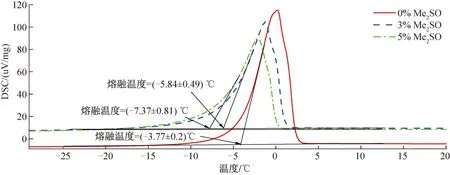
圖2 不同體積分數Me2SO肝細胞溶液復溫相變熔融曲線Fig.2 Melting curves of phase transition in different volume concentrations of Me2SO hepatocyte solution
2.2 超聲植冰對細胞凍存的影響
對使用體積分數分別為5%和10%的Me2SO肝細胞懸液進行傳統慢速冷凍和超聲波植冰操作,預冷溫度為 -9 ℃,超聲波強度為0.331 2 W/cm2,結果如圖3所示(不同字母代表有顯著性差異。顯著性:p<0.05;誤差:SD,下同)。由圖3(a)可知,兩個超聲植冰組均取得較好的保存效果,幾乎無死細胞,體積分數為10%的Me2SO組作為實驗室最常用的保存方式,效果相對較好,但也有部分細胞死亡,而體積分數為5%的Me2SO組保存效果較差,有較多的死細胞。結合圖3(b)可知,10%Me2SO+超聲植冰組和5%Me2SO+超聲植冰組與新鮮組細胞存活率無顯著性差異,傳統的保護劑方案,加入10%Me2SO的細胞溶液凍存后,細胞存活率也能夠達到(87.2±5.6)%,但與新鮮組對照有顯著差異。當降低懸液中Me2SO體積分數為5%時,細胞存活率僅為(62.2±2.9)%,這也驗證經典的細胞保存方案為何使用體積分數為10%的Me2SO。但5%Me2SO+超聲植冰組細胞存活率能達到(93.4±1.1)%,與傳統保存方案相比,細胞存活率大幅提高,且與新鮮對照組無顯著性差異,表明超聲植冰有效改善了細胞低溫保存。
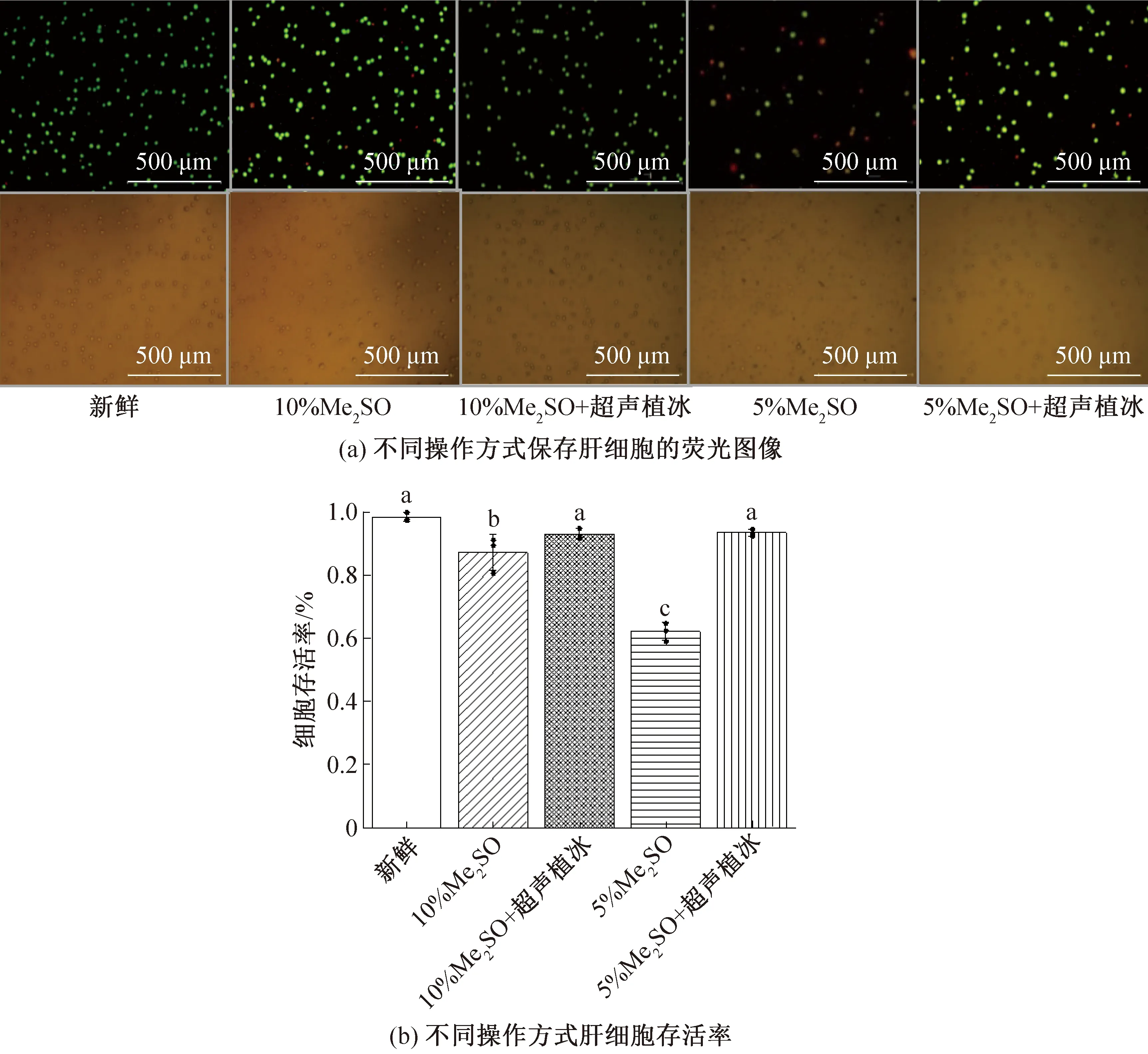
圖3 超聲植冰對肝細胞存活率的影響Fig.3 The effect of ultrasonic ice seeding on the survival rate of hepatocytes
2.3 超聲波植冰與傳統植冰方式的對比
圖4所示為傳統植冰與超聲植冰對肝細胞存活率的影響。當添加體積分數為10%Me2SO,預冷溫度為-9 ℃時,傳統植冰細胞存活率為(88.81±1.6)%,超聲植冰細胞存活率為(92.98±1.7)%,存在顯著性差異;當添加體積分數5%Me2SO,預冷溫度為-9 ℃時,與傳統植冰方式相比,超聲植冰存活率大幅提高,細胞存活率達到(93.4±1.1)%,而傳統植冰方式細胞存活率僅為(76±1.4)%,顯然超聲植冰在不同體積分數Me2SO下要比傳統植冰更具優勢。與傳統保存方案相比,傳統植冰在-9 ℃植冰能略微提高細胞存活率,但降低Me2SO的體積分數為5%時,傳統植冰在較低預冷溫度下植冰的效果不顯著,而超聲植冰在較低的植冰溫度下發揮了更大的改善細胞存活率的作用。原因可能是超聲波植冰操作過程中無需將凍存管從冰盒中取出,植冰成功率較高,而傳統植冰需要將凍存管反復取出,溫度波動大,且成功率低,充分體現了超聲波植冰一致性強、成功率高、保存效果好的特點。
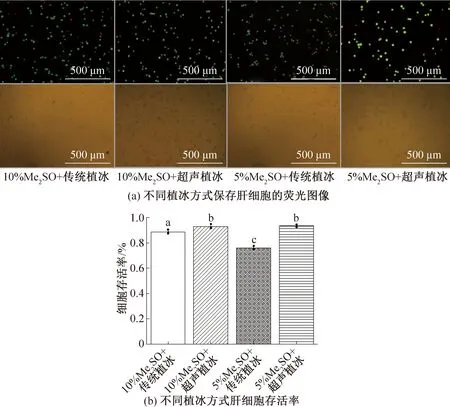
圖4 傳統植冰與超聲波植冰對肝細胞存活率的影響Fig.4 The effect of traditional ice seeding and ultrasonic ice seeding on the survival rate of hepatocytes
2.4 不同超聲波強度對肝細胞凍存的影響
圖5所示為不同超聲波強度對肝細胞存活率的影響。當使用體積分數為5%的Me2SO,植冰溫度為-9 ℃時,超聲波強度分別為0.032 9、0.104 1、0.331 2、0.431 6、0.502 6 W/cm2對細胞進行保存,檢測細胞的冷凍存活率。當超聲波強度小于0.431 6 W/cm2時,細胞均得到較好的保存,存活率均在90%以上,滿足樣本庫等細胞庫的需求,組別間無著性差異,當超聲波強度大于0.431 6 W/cm2時,細胞存活率顯著下降。這是由于超聲波植冰利用了空化效應,空化氣泡中的氣壓會增至氣泡無法承受的程度而發生破裂[27],氣泡生長、收縮、破裂的過程可以增強伴隨細胞冷凍過程中的傳熱和傳質過程[28-29],降低界面能[30-33],觸發成核,大功率的超聲波對植物細胞膜產生破壞[34],在合適的超聲強度范圍,對細胞凍存均有積極影響。
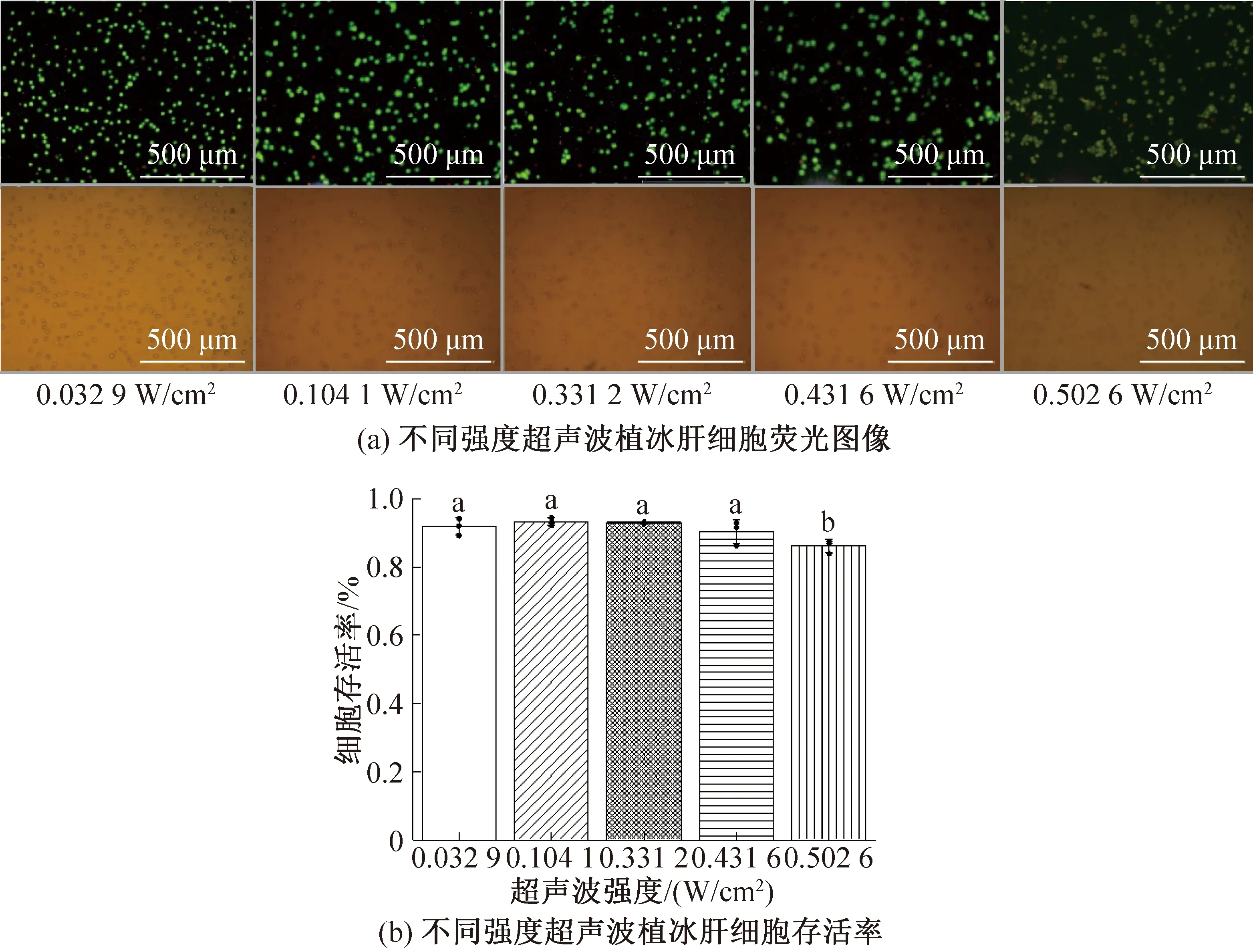
圖5 不同超聲波強度對肝細胞存活率的影響Fig.5 The effect of different ultrasonic intensities on the survival rate of hepatocytes
2.5 植冰溫度對細胞存活率的影響
當使用體積分數為5% Me2SO,超聲波強度為0.104 1 W/cm2時,不同植冰溫度(-7、-8、-9 ℃)時的細胞存活率如圖6所示。由圖6可知,當植冰溫度為-7 ℃和-8 ℃時,細胞得到較好保存,幾乎全部存活,存活率分別為(97±2.6)%、(95.9±0.2)%。當植冰溫度為-9 ℃時,細胞存活率略有下降,為(90.8±1.9)%,可知不同溫度對保存效果存在顯著性差異。這是由于植冰溫度越低,細胞的過冷度越高,由于過冷度是造成細胞死亡的重要因素,應盡量提高植冰溫度,減少過冷度,但植冰溫度不能無限制提升,必須低于溶液結晶溫度。

圖6 不同預冷溫度下超聲波植冰對肝細胞存活率的影響Fig.6 The effect of ultrasonic ice seeding on hepatocytes survival rate under different pre-cooling temperatures
2.6 最優體積分數Me2SO的確立
使用超聲波強度為0.104 1 W/cm2,對不同體積分數Me2SO(0 %、3 %、5 %)的細胞懸液進行低溫保存,根據2.5的結論,在保證植冰成功的前提下,植冰溫度應盡量高,即采用對應體積分數的上閾溫度(-4、-6、-7 ℃)進行植冰。結果如圖7所示,當Me2SO體積分數為0%時,細胞依然有存活,存活率高達(11.7±2.0)%,而體積分數為3% Me2SO細胞存活率為(91.32±1.3)%,低于5% Me2SO細胞存活率為(97±2.6)%時的保存效果,各組別之間均有顯著性差異。可知,超聲波植冰可以降低細胞溶液過程中的過冷度,改變較大過冷度下因釋放潛熱而與周圍環境溫度形成較大溫差,細胞內外形成應力,最后形成較快的降溫速率,防止胞內冰的形成。Me2SO作為一種小分子的滲透性保護劑,可以滲透到細胞內,它們以比水慢的速度進入細胞,使細胞因滲透而失水,使胞內冰減少,減少胞內冰的損傷,有一定的毒性,但植冰操作仍然無法消除Me2SO的使用。
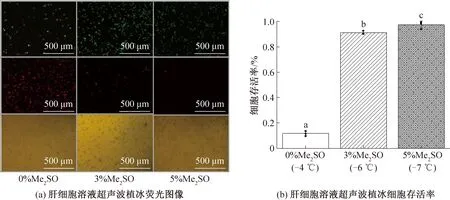
圖7 熔融溫度下超聲植冰對肝細胞存活率的影響Fig.7 The effect of ultrasonic ice seeding on hepatocytes survival rate at melting temperature
3 結論
為了提高傳統慢速冷凍方案過程中細胞低溫保存后的存活率,降低滲透性保護劑Me2SO的添加量,本文設計的超聲波植冰系統誘導冰晶成核,與傳統的保護劑方案進行對比,研究了在慢速冷凍過程中超聲植冰,不同超聲波強度、不同植冰溫度、不同保護劑濃度對肝細胞存活率的影響,得到如下結論:
1)當超聲波頻率為40 kHz,超聲波強度為0.104 1 W/cm2,預冷溫度為-9 ℃時,10%Me2SO+超聲植冰組和5%Me2SO+超聲植冰組低溫凍存后復蘇肝細胞存活率分別為(92.98±1.7)%、(93.4±1.1)%,與新鮮組(98.4±1.1)%相比,無顯著性差異(p<0.05),比對應保護劑非植冰操作方案有顯著提高;與10%Me2SO+傳統植冰組和5%Me2SO+傳統植冰組低溫凍存后復蘇肝細胞存活率分別為(88.81±1.6)%、(76±1.4)%相比,有顯著性差異(p<0.05),比傳統植冰組存活率高。
2)當超聲波頻率為40 kHz,超聲波強度為0.032 9~0.431 6 W/cm2,預冷溫度為-9 ℃時,細胞存活率均在90%以上,組間無顯著性差異(p<0.05),當超聲波強度大于0.431 6 W/cm2時,肝細胞存活率顯著下降。
3)使用體積分數為5%的Me2SO在-7 ℃超聲植冰,超聲波強度為0.104 1 W/cm2,肝細胞存活率最高,存活率達到(97±2.6)%,與新鮮組無顯著性差異。

