基于誘導突變牡蠣共生真菌的代謝產物*
梁夢迪 尹楠楠 李藤藤 王 月 張 震 王煥南
(濟寧醫學院藥學院,日照 276826)
海洋微生物作為生物活性代謝物最豐富的來源之一,是先導化合物的重要源泉[1-3]。海洋真菌產生的次級代謝產物分子質量相對較小,但活性優良,多數化合物具有抗腫瘤、抗病毒、抗AD、免疫抑制和酶抑制等作用[4-6]。微生物變異是生物進化的基礎推動力[7],然而在人工培養的單一穩定環境下,微生物大部分基因簇通常處于沉默狀態[8],很多基因未能完全表達,而自然選育耗時長,工作量大且效率低。人工誘變育種可采用加入誘變劑、紫外照射、微波等加速微生物突變,從而在相對較短的時間內獲得有實用價值的突變體,改善菌株特性[9-11]。本研究基于前期從牡蠣中分離得到的真菌Alternariaalternata,通過化學、物理以及復合誘導調控等方法,以期激活真菌的沉默基因簇,充分發掘微生物次級代謝的潛力,為獲得大量新型結構活性天然產物提供信息支持。
1 材料和試劑
1.1 主要試劑和儀器
葡萄糖、麥芽糖、乙酸乙酯(國藥集團化學試劑有限公司);UN1Q-10柱式真菌基因組DNA抽提試劑盒(上海生工公司);瓊脂粉(青島海博生物公司);乙酰膽堿酯酶(蒼蠅頭部)、碘代硫代乙酰膽堿、DTNB、胰蛋白胨、DPPH、磷酸二氫鈉、硫酸二乙酯(DES)、抗壞血酸等購自上海源葉生物科技有限公司。
恒溫振蕩培養箱(天津市萊玻特瑞公司);恒溫恒濕培養箱(上海精宏公司);電泳儀(北京六一公司);離心機(賽默飛公司);超凈工作臺(蘇州安泰公司);立式蒸汽滅菌器(上海博訊公司);EYELA旋轉蒸發儀(上海愛朗公司);高效液相色譜儀(島津公司);PCR擴增儀(美國伯樂公司);全功能酶標儀(美國伯騰公司)。
1.2 方法
1.2.1菌種來源 本實驗室前期從日照海域野生牡蠣中分離得到的真菌,經菌種鑒定為鏈格孢菌Alternariaalternata,命名為YS-4。金黃色葡萄球菌(S.aureus)和大腸桿菌(E.coli)-80℃保存于藥學實驗中心。
1.2.2菌株誘變 1)DES誘變。適量YS-4菌體接種至PDB培養基中,恒溫振蕩培養箱中培養3~7d,得到菌懸液。取適量菌懸液至5mL離心管中,充分研磨,測定其吸光度,用PDB培養基稀釋,進行菌液濃度的預篩選。取700μL菌懸液置1.5mL離心管中,分別加入0、1、2、4、6、8、10μL DES,DMSO補至1000μL,混勻,放置4℃,按表1進行誘變劑濃度的預篩選,12h和24h后分別于取菌懸液涂布、培養,連續觀察15d,及時分離出新的菌株[12]。
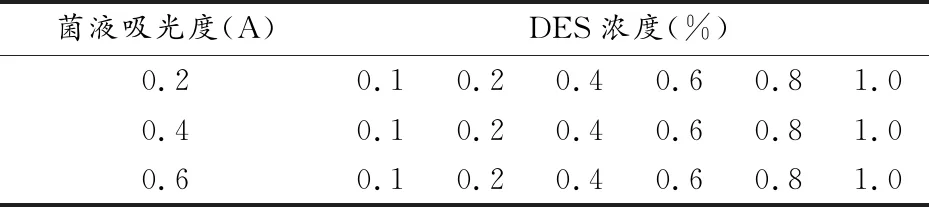
表1 化學誘變劑(DES)濃度
2)紫外誘變。菌懸液制備過程同1),取菌懸液置PDA培養基,涂布,28℃培養箱培養24h,取出用20W紫外燈照射,照射距離20cm,照射時間分別為0、3、5、10、15、20、40、60、120、180、360s,密封放置在恒溫培養箱中培養,連續觀察15d,及時分離出新的菌株[13]。
3)微波誘變。菌懸液制備過程同1),取1mL菌懸液加入1.5mL EP管中,將EP管放置在冷卻后燒杯中,用微波分別處理0、10、20、30、40、50、60s,密封、4℃冷藏12h涂布培養,連續觀察15d,及時分離出新的菌株[14-15]。
4)復合誘變。0.4% DES處理24h后,取200μL菌懸液置PDA培養基涂布培養12h,紫外照射60s,重新放至恒溫培養箱中培養,連續觀察15d,及時分離出新的菌株。
1.2.3穩定性考察 挑取誘變菌株的菌絲(母代)適量,在新PDA培養基上劃線,培養箱中培養7~15d,同種方法連續10代接種培養,觀察突變株的生長形態,以確定突變菌株的遺傳穩定性。
1.2.4菌種鑒定 將誘變菌株接種至PDB培養基上,搖床中培養3~7d,吸取菌體至1.5mL EP管中,離心,棄上清,將菌體于冰浴中充分研磨,根據UNIQ-10柱式真菌基因組DNA抽提試劑盒提取DNA,基于18S基因序列將提取得到的DNA,采用真菌通用引物ITS4 (5'-TCCTCCGCTTATTGATATGC-3')和ITS5 (5'-GGAAGTAAAAGTC GTAACAAGG-3')進行PCR擴增,PCR反應體系(1μL上、下游引物+10μL Mix+3μL DNA+6μL dd H2O),PCR產物經1%瓊脂糖凝膠電泳純化回收后,送至蘇州金唯智公司測序。基因序列經Genbank數據庫Blast對比,采用MEGA7.0軟件的鄰接法構建系統發育樹[16]。
1.2.5誘變菌株代謝產物的提取 挑取適量誘變菌株的菌絲轉移至500mL PDB培養基中,培養10~15d。將發酵液經離心、萃取得乙酸乙酯層,濃縮得粗浸膏,備用。
1.2.6色譜條件 采用Wondasil C18 Superb(250mm×4.6mm,5μm)色譜柱,以水(A)-甲醇(B)為流動相進行梯度洗脫(0~40min,5%B~100%B;40~50min,100%B;50~60min,100%B~5%B),流速為0.8mL/min,檢測波長為254nm,柱溫35℃,進樣量為10μL。
1.2.7生物活性測定 1)ACh E抑制活性測定。參照表2,配制總體積為700μL的反應體系,37℃水浴260s,取200μL轉移至96孔板中,平行3個復孔。412nm處測定其OD值,按公式計算其抑制率,鹽酸多奈哌齊(Donepezil)為陽性對照。抑制率%=[(AⅡ-AⅠ)-(AⅣ-AⅢ)]/(AⅡ-AⅠ)×100%。

表2 Ellman法各組加樣量(μL)
2)體外抗氧化活性測定。參照表3加樣反應,517nm處測定其OD值,按下列公式計算其清除率,VC為陽性對照。清除率(%)=[A陰性-(A樣品-A本底)]/A陰性。
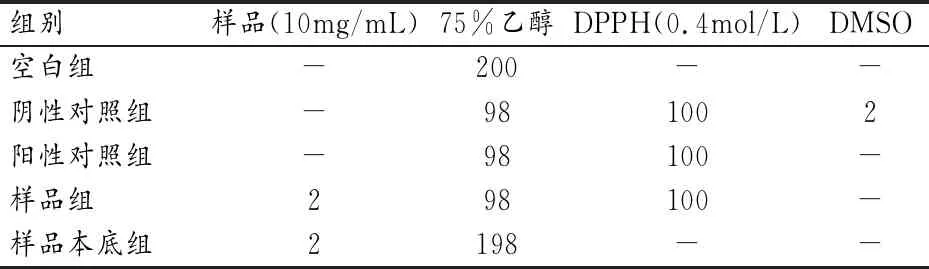
表3 DPPH法各組加樣量(μL)
3)抗菌活性測定。將100μL指示菌的菌懸液均勻涂布在LB培養基上,培養12~16h,將培養皿分為四區并放置濾紙片,每個區域分別加入誘變菌株浸膏溶液和YS-4菌株的浸膏溶液(10mg/mL),DMSO為陰性對照,利福平和氯霉素為陽性對照,恒溫培養箱中倒置培養,分別在12、24、36、48、72h測量其抑菌圈大小。
1.2.8數據的處理與分析 采用GraphPad Prism 8.0軟件進行統計分析;采用MAGE 7.0中鄰接法構建系統發育樹。
2 結果
2.1 YS-4真菌及其突變菌株形態圖
野生菌株YS-4經過DES、紫外、微波以及復合誘變等方法分離得到48種菌株,經過穩定性考察后得到6種具有穩定遺傳特性的突變菌株,其形態圖見圖1。
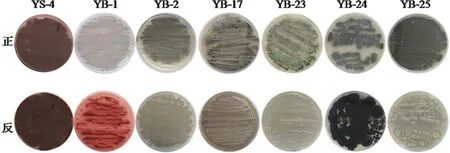
圖1 YS-4及其誘變菌株的形態圖
2.2 突變菌株的菌種鑒定及系統發育樹的構建
基于18S基因序列,采用鄰接法構建系統發育樹,見圖2。野生菌株經誘變得到穩定遺傳的菌株分別為聚多曲霉(Aspergillussydowii)、煙曲霉(Aspergillusfumigatus)、皮落青霉(Penicilliumcrustosum)、指狀擬青霉(paecilomycesdactylethromorphus)、糙刺籃狀菌(Talaromycessp)和青霉菌(Penicilliumsp)。
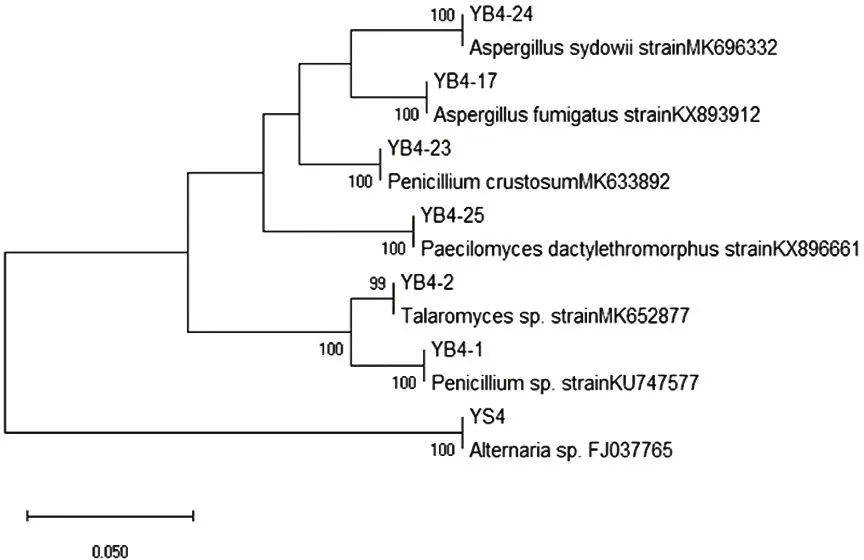
圖2 誘變菌株系統發育樹
2.3 突變菌株代謝產物的HPLC分析
與野生菌株YS-4粗提物的HPLC圖譜相比,在波長254nm下,突變菌株YB-1和YB-17不同保留時間出現明顯新峰,說明其突變菌株出現了新的次級代謝產物。見圖3。
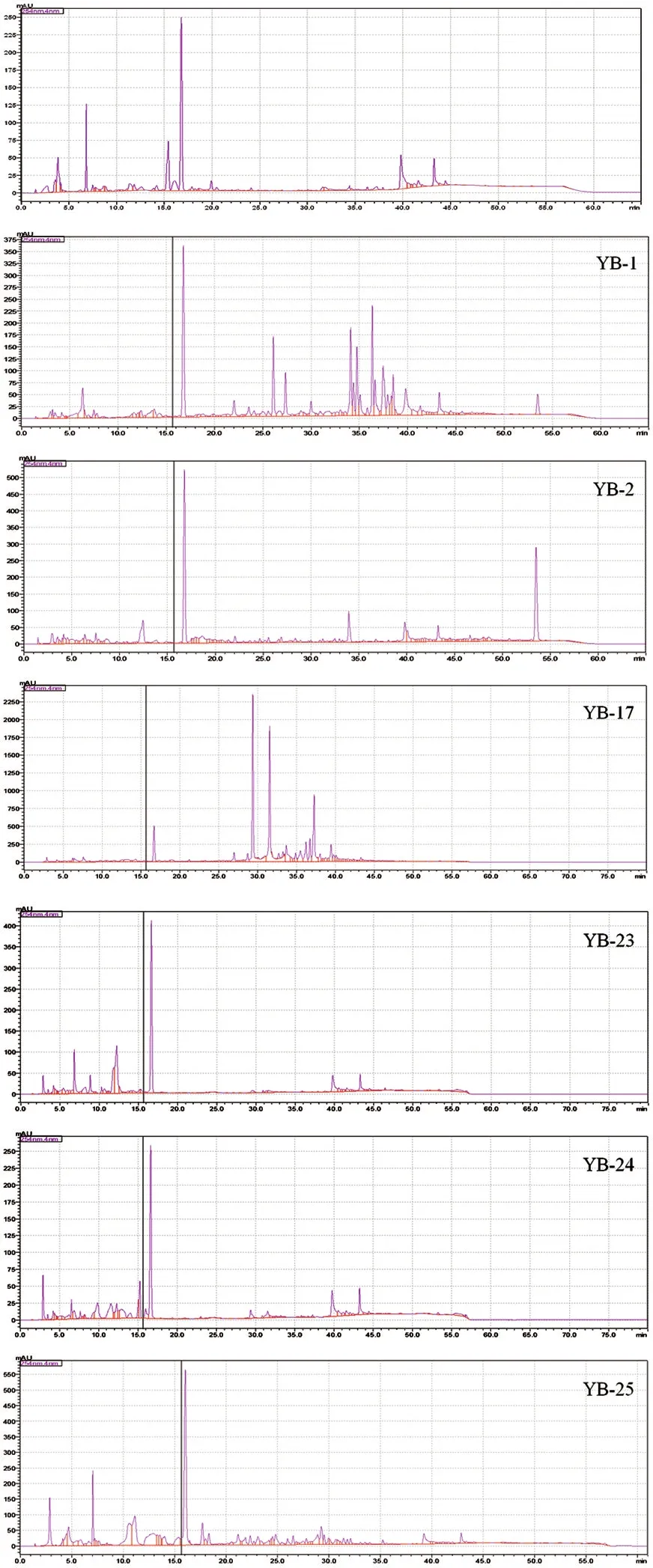
圖3 誘變菌株代謝產物的HPLC分析
2.4 突變菌株代謝產物的生物活性
2.4.1乙酰膽堿酯酶的抑制活性 采用Ellman法研究菌株代謝產物對ACh E的抑制活性。樣品終濃度為200μg/μL時,野生真菌YS-4的粗提物對ACh E活性抑制率為45.22%,而突變菌株YB-1、YB-17 和YB-23對ACh E抑制活性增強,其抑制率分別為55.86%、60.31%和49.67%, Donepezil為陽性對照,抑制率為75.50%(50μg/μL)。見圖4。

圖4 YS-4及誘變菌株代謝產物對AChE活性抑制作用
2.4.2抗氧化活性 采用DPPH自由基清除法研究菌株代謝產物的體外抗氧化活性。與YS-4相比(清除率為15.62%),濃度為100μg/μL時,突變菌株YB-1、YB-17、YB-25對DPPH自由基的清除能力均有明顯提高,清除率分別為41.72%、36.85%和23.59%。見圖5。
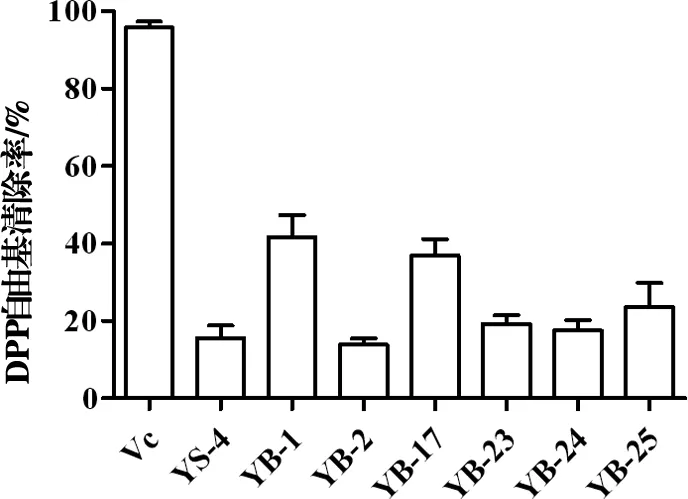
圖5 YS-4及誘變菌株的代謝產物對DPPH自由基清除作用
2.4.3抗菌活性 與YS-4相比(抑菌圈直徑為12mm),YB-17、YB-23和YB-24對金黃色葡萄球菌的抑制作用增強,其粗提物(10mg/mL)抑菌圈直徑分別為20、16和19mm,所有菌株對大腸桿菌E.coli無抑制作用。見表4。

表4 不同真菌對受試菌種的抑菌圈直徑
3 結論
通過對野生牡蠣內生真菌YS-4誘變育種,得到6株具有穩定遺傳特性的突變菌株,分別為聚多曲霉(Aspergillussydowii),煙曲霉(Aspergillusfumigatus),皮落青霉(Penicilliumcrustosum),指狀擬青霉(Paecilomycesdactylethromorphus),糙刺籃狀菌(Talaromycessp)和青霉菌(Penicilliumsp)。HPLC圖譜分析可知,突變菌株YB-1和YB-17的代謝產物更為豐富;生物活性結果表明,突變菌株YB-1、YB-17和YB-23對AchE具有良好的抑制作用,抑制率分別為55.86%、60.31%和49.67%;YB-1、YB-17和YB-25對DPPH自由基的清除能力較強,清除率分別達41.72%、36.85%和23.59%;YB-17、YB-23和YB-24對金黃色葡萄球菌具有一定的抑制作用。本研究通過誘變方法激活牡蠣內生真菌的沉默基因簇,得到次級代謝產物具有良好生物活性的目標菌株,為進一步活性化合物的分離奠定基礎。
利益沖突:所有作者均申明不存在利益沖突。

